恩替卡韦联合苦参素与单用恩替卡韦治疗CHB临床疗效及安全性的 Meta 分析*
张明亮,马润然,刘方洲,李伟霞,王晓艳,张 辉,陈盼盼,贾文汇,牛 璐,王 炎,唐进法,△
(1.河南中医药大学第一附属医院/中药临床评价技术河南省工程实验室/河南省中药饮片临床应用现代化工程研究中心,郑州 450000;2.成都中医药大学药学院,成都 611137;3.河南中医药大学药学院,郑州 450000;4.河南省中医药研究院中药药理研究所,郑州 450000)
慢性乙型肝炎(CHB)是由乙型肝炎病毒(HBV)引起的全球性、大流行病、传染性疾病。WHO报道全球约2.57亿HBV感染者,全球每年约有88.7万人死于HBV感染相关疾病,其中有52%死于HBV感染所致的肝硬化,38%死于HBV感染所致的肝癌,给家庭与社会带来了沉重的负担[1]。2014年中国疾病预防控制中心统计的我国1~29岁人群HBV感染率[乙型肝炎表面抗原(HBsAg)阳性]约为5.64%,慢性HBV感染者约有7 000万,其中2 000~3 000万人患有CHB[2]。CHB病情反复、进展为肝硬化、肝衰竭和原发性肝癌的重要原因是HBV不断复制导致机体免疫功能失调,因此,治疗CHB的关键在于抗病毒联合调节机体免疫。恩替卡韦是新一代抗HBⅤ核苷类抗病毒药物,具有起效快、抗HBV活性强、单用效果欠佳的特点[3]。苦参素是从苦豆子及苦参根中提取的四环喹啉类生物碱(主要成分是氧化苦参碱),具有抗HBV与调节机体免疫的作用[4]。近年来临床普遍采用恩替卡韦联合苦参素治疗CHB,因治疗剂量、疗程等不一致,导致临床结果存在不一致现象,联合用药的安全性与有效性也有待评估。为明确恩替卡韦联合苦参素发挥治疗CHB的作用,本研究基于以往相关随机对照试验(RCTs),对恩替卡韦(0.5 mg)联合苦参素(0.6 g)治疗CHB 3、6、12个月后的有效性与安全性进行系统评价,为临床医生规范用药提供循证证据。
1 资料与方法
1.1 文献检索策略
在中国生物医学文献数据库、中国知网、万方数据库、维普中文科技期刊数据库中检索中文文献。中文检索词:慢性乙型肝炎、恩替卡韦、苦参素,在PubMed、EMBASE、Web of Science、CENTRAL、The Cochrane Library数据库中检索外文文献,无语言限制,英文检索词:chronic hepatitis B、Entecavil、Matrine。检索时间从数据库建库时间至2020年4月。
1.2 方法
1.2.1文献纳入与排除标准
(1)研究对象:CHB患者,排除其他慢性肝炎患者与动物实验。(2)文献类型:随机对照试验研究(RCTs),排除横断面研究、病例对照研究、队列研究或非RCTs。(3)干预措施:对照组单用恩替卡韦0.5 mg口服,每天1次;试验组为苦参素联合恩替卡韦(苦参素0.2 g口服,每天3次,恩替卡韦0.5 mg口服,每天1次),试验组与对照组基础对症治疗需一致,治疗疗程少于3个月,排除存在不同干预措施的文献。(4)结局指标:乙型肝炎E抗原(HBeAg)阴转率、HBV DNA阴转率、丙氨酸氨基转移酶(ALT)复常率、HBeAg血清转换率,透明质酸(HA)、层黏蛋白(LN)、三型前胶原(PCIII)、Ⅳ型胶原蛋白(C-Ⅳ)、CD4/CD8比率及安全性评价。
1.2.2纳入研究文献质量评价与资料提取
文献筛选由2名研究者独立阅读检索所获得文献题目和摘要,剔除明显不符合纳入标准的文献,对潜在符合纳入标准的文献进行全文阅读,依据纳入和排除标准确定是否最终纳入研究,并进行交叉核对。存在意见不一致时,通过讨论并征求第3位研究者意见解决。对符合标准的文献按照Cochrane Reviewer′s Handbook 5.1.0进行方法学质量评价[5],评价内容包括随机方法、分配方案是否隐藏、盲法具体措施、结果数据是否完整、是否选择性报告结果和是否存有其他偏倚来源等6个方面。提取主要信息:研究对象人口学特征,随机化分组方法,盲法实施等,试验组与对照组样本量,给药途径、剂量与疗程,上述结局指标。
1.3 统计学处理
采用RevMan 5.3软件对数据进行统计分析。对于二分类资料,采用相对危险度(RR)和95%CI表示;对于连续性资料,采用SMD和95%CI表示。通过I2值判断不同研究间的统计学异质性大小:I2<50%时,异质性较小,采用固定效应模型(FE);I2≥50%时,异质性较大,采用随机效应模型(RE),并依据异质性可能原因进行分层分析。纳入文献大于10篇时采用倒漏斗图分析纳入研究的发表偏倚情况。指标或亚组分析时纳入文献不少于5篇方进行统计分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 文献检索结果与纳入文献特征
通过计算机检索和手工辅助检索,共获得111篇潜在相关文献。经过阅读题目、摘要和全文后,剔除不合格文献81篇,纳入合格文献30篇[6-35]。剔除文献[11-12]与文献[29-30],作者用同一批样本检测的不同指标发表在不同杂志的两篇文章样本量,共计纳入恩替卡韦联合苦参素治疗(联合治疗组)1 528例,恩替卡韦组1 492例,见表1。

表1 纳入文献特征表
2.2 偏倚风险评估
纳入文献在随机对照和分配方法等方面较好,但是盲法、选择性报告等方面存在未知风险。
2.3 Meta分析结果
2.3.1两组患者HBeAg转阴率及转换率比较
(1)HBeAg转阴率:在治疗3个月时,共纳入6个研究[6-7,17-18,20,23],联合治疗组与恩替卡韦组的血清HBeAg合并转阴率分别为33.82%与25.00%,I2=0%,FE分析显示两组差异有统计学意义(RR=1.33,95%CI:1.07~1.64,P=0.009);治疗6个月时,共纳入10个研究[6-8,14,17,19-20,25-26,35],联合治疗组与恩替卡韦组的血清HBeAg合并转阴率分别为43.03%与26.26%,I2=49%,FE分析显示两组差异有统计学意义(RR=1.63,95%CI:1.38~1.91,P<0.000 01);治疗12个月时,共纳入14个研究[6-7,9,11-12,16-18,21,23,28-29,31,33],联合治疗组与恩替卡韦组的血清HBeAg合并转阴率分别为54.06%与33.01%,I2=0%,FE分析显示两组差异有统计学意义(RR=1.63,95%CI:1.45~1.83,P<0.000 01),见图1A。(2)HBeAg转换率:在治疗3个月时,共纳入7个研究[6-7,10,13,17,20,24],联合治疗组与恩替卡韦组的血清HBeAg合并转换率分别为16.42%与9.39%,I2=20%,FE分析显示两组差异有统计学意义(RR=1.66,95%CI:1.17~2.36,P=0.005);治疗6个月时,共纳入10个研究[6-8,10,13-14,17,20,24,26],联合治疗组与恩替卡韦组的血清HBeAg合并转换率分别为32.68%与19.64%,I2=24%,FE分析显示两组差异有统计学意义(RR=1.64,95%CI:1.34~2.00,P<0.000 01);治疗12个月时,共纳入14个研究[6-7,10,12-13,15-17,22,27-29,32-33],联合治疗组与恩替卡韦组的血清HBeAg合并转换率分别为42.73%与23.78%,I2=0%,FE分析显示两组差异有统计学意义(RR=1.78,95%CI:1.54~2.07,P<0.000 01),见图1B。

图1 HBeAg转阴率森林图(A)与HBeAg转换率森林图(B)
2.3.2两组患者HBV DNA转阴率及ALT异常率比较
(1)HBV DNA转阴率:在治疗3个月时,共纳入8个研究[6-7,10,17-18,20,23-24],联合治疗组与恩替卡韦组的血清HBV DNA合并转阴率分别为44.78%与34.38%,I2=0%,FE分析显示两组差异有统计学意义(RR=1.30,95%CI:1.11~1.53,P=0.001);治疗6个月时,共纳入12个研究[6-8,10,14,17,19-20,24-26,35],联合治疗组与恩替卡韦组的血清HBV DNA合并转阴率分别为72.18%与60.86%,I2=2%,FE分析显示两组差异有统计学意义(RR=1.19,95%CI:1.11~1.27,P<0.000 01);治疗12个月时,共纳入18个研究[6-7,9-12,15-18,21,23,27-29,31-33],联合治疗组与恩替卡韦组的血清HBV DNA合并转阴率分别为83.14%与65.41%,I2=32%,FE分析显示两组差异有统计学意义(RR=1.27,95%CI:1.20~1.34,P<0.000 01),见图2A。(2)ALT复常率:在治疗3个月时,共纳入8个研究[6-7,10-11,18,20,23-24],联合治疗组与恩替卡韦组的血清ALT合并复常率分别为59.09%与46.30%,I2=76%,RE分析显示两组差异有统计学意义(RR=1.27,95%CI:1.12~1.44,P=0.03);治疗6个月时,共纳入10个研究[6-8,10-11,19-20,24,26,35],联合治疗组与恩替卡韦组的血清ALT合并复常率分别为82.88%与65.25%,I2=23%,FE分析显示两组差异有统计学意义(RR=1.27,95%CI:1.18~1.37,P<0.000 01);治疗12个月时,共纳入16个研究[6-7,10-13,15-18,21,23,27-29,33],联合治疗组与恩替卡韦组的血清ALT合并复常率分别为86.01与73.41%,I2=42%,FE分析显示两组差异有统计学意义(RR=1.17,95%CI:1.12~1.23,P<0.000 1),见图2B。
2.3.3两组患者LN及HA水平比较
治疗12个月时,LN检测共纳入5个研究[15-16,31,34],I2=25%,FE分析结果显示,联合治疗组与恩替卡韦组的血清LN差异有统计学意义(SMD=-1.37,95%CI:-1.58~-1.16,P<0.000 1),见图3A;HA检测共纳入5个研究[15-16,31,34],I2=80%,RE分析显示,联合治疗组与恩替卡韦组的血清HA差异有统计学意义(RR=-1.49,95%CI:-1.67~-1.31,P<0.000 01),见图3B。
2.3.4安全性评价
治疗6个月时,共有3篇文献报道了不良反应,不符合统计学要求,故舍弃;治疗12个月时,共有9篇文献报道了有头晕、消化道不适等非严重不良反应(其中文献[11-12]为同一批标本检测不同指标在不同杂志发表,但不良反应情况一样,舍去1篇,剩余8篇),符合统计学要求,I2=0%,FE分析显示,两组患者不良反应发生率比较差异无统计学意义(RR=1.11,95%CI:0.69~1.79,P=0.66)。
2.4 发表偏倚估计
HBeAg换阴率在6个月时有1篇文献呈非对称性分布(图4A);HBeAg血清转换率在3、6、12个月时均有1篇文献呈非对称性分布(图4B);HBⅤ DNA转阴率在6、12个月时均有1篇文献呈非对称性分布(图4C);ALT复常率在3、6、12个月时分别有1、2、1篇文献呈非对称性分布(图4D),其余均呈对称分布,且所有Egger′s均P>0.05,提示存在较小发表偏倚,可能与个别纳入的文献方法学质量不高有关。
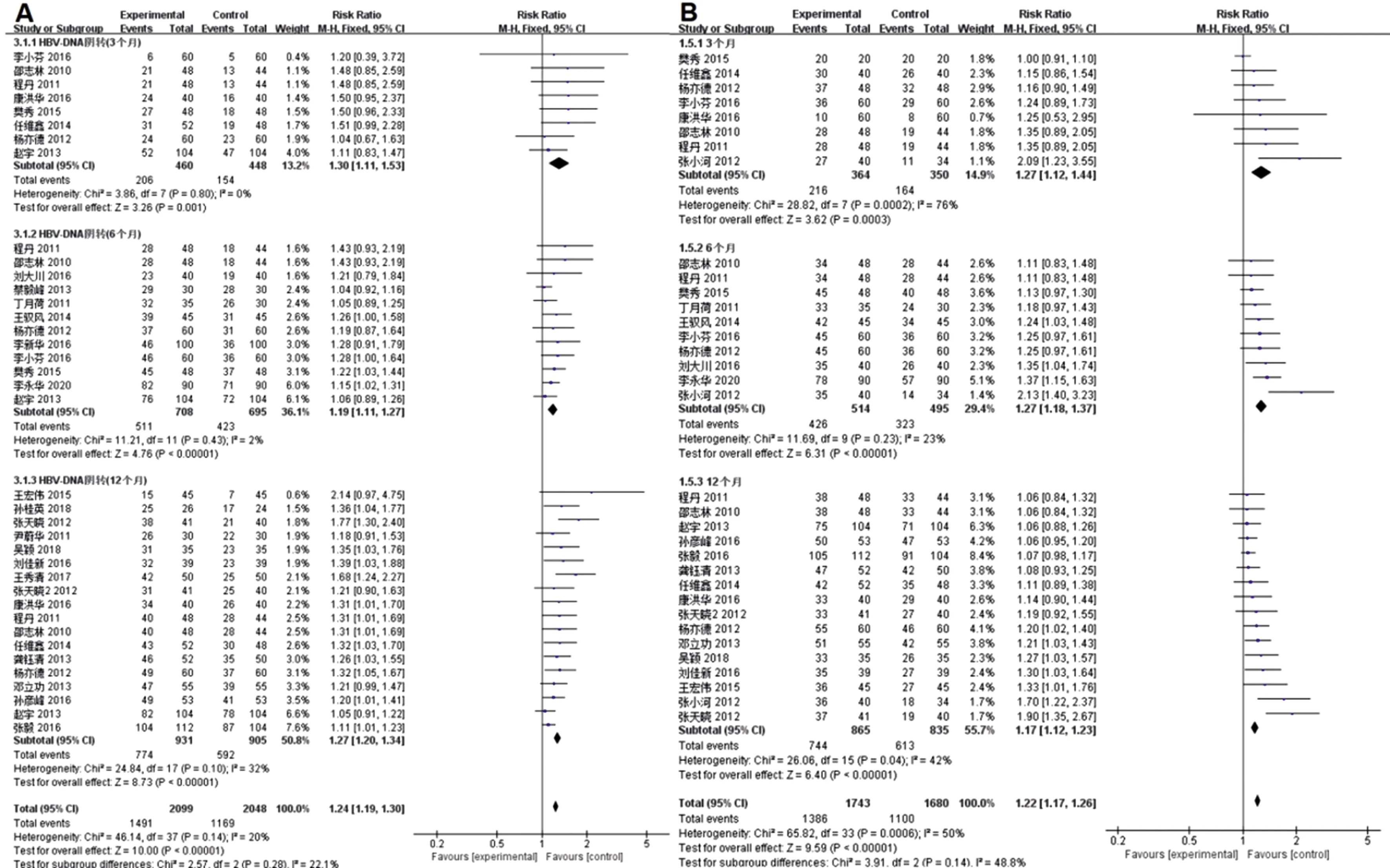
图2 HBV DNA转阴率森林图(A)与ALT复常率森林图(B)
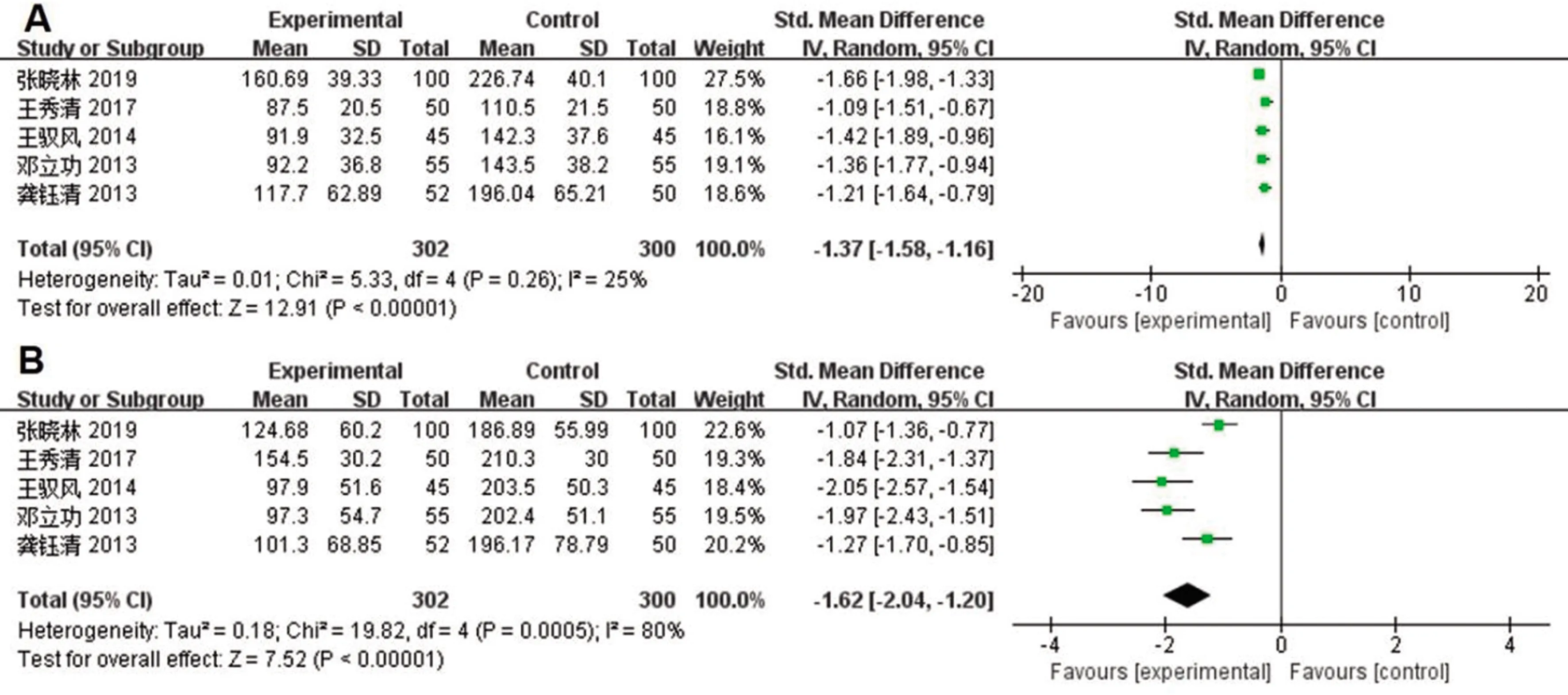
图3 LN森林图(A)与HA森林图(B)
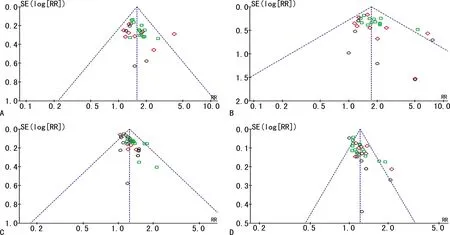
A:HBeAg转阴率;B:HBeAg转换率;C:HBV DNA转阴率;D:ALT复常率;○:3个月;◇:6个月;▭:12个月。
3 讨 论
HBV持续复制引发机体免疫功能紊乱是导致CHB、肝硬化及原发性肝癌的最主要病因,抗病毒联合调节机体免疫成为当前治疗CHB的主要手段之一。恩替卡韦是核苷类抗HBV药物,具有较强的抗HBV病毒作用,苦参素具有明显的免疫调节作用[36],可明显改善肝CHB患者肝脏功能[37],二者联用已经成为临床常用治疗CHB的组合药物之一。
Meta分析结果显示,恩替卡韦联合苦参素治疗CHB在升高HBeAg转阴率、HBeAg转换率、HBV DNA转阴率与ALT复常率方面均明显优于单独使用恩替卡韦。这一结果与纳入的大部分文献研究结果一致。分析认为苦参素可能通过调节机体CD3、CD4、CD8等 T淋巴细胞免疫平衡,促进干扰素-γ和白细胞介素-2等细胞因子表达以抑制肝脏炎症,改善恩替卡韦这类抗HBV病毒引起的机体免疫失衡,同时苦参素还可以调动机体B细胞产生大量抗HBV抗体,干扰HBV病毒的合成,起到协同恩替卡韦治疗CHB的作用[29,35]。有研究认为,苦参素还可以稳定肝细胞膜,阻断肝细胞凋亡,改善肝脏微循环,促进肝细胞再生,对于延缓CHB患者肝纤维化进程也有明显疗效[38-39]。而作为传统安全无毒的中药苦参提取物,苦参素无明显毒副作用,联合恩替卡韦也不明显增加CHB患者的不反应发生,二者联用具有较好的安全性。因此,苦参素可起到安全有效地增强恩替卡韦治疗CHB的效果。
本研究存在以下局限性:(1)仅检索中英文文献,忽略了其他国家发表的非中英文文献,也不包括正在研究的数据,可能会导致文献选择性偏倚;(2)基于大家普遍对阳性结果的认可,可能出现部分阴性结果未被发表的情况,这将导致发表结果偏倚;(3)缺乏该类大样本、多中心的临床RCT,可能是导致发表偏倚产生的主要原因;(4)检索后纳入的均为国内文献,文献方法学质量不高,影响结果可靠性。尽管存在以上局限性,本研究证实了恩替卡韦联合苦参素治疗CHB在升高HBeAg转阴率、HBeAg转换率、HBV DNA转阴率与ALT复常率方面明显优于恩替卡韦单独使用,而恩替卡韦联合苦参素较单用恩替卡韦治疗CHB安全性方面没明显差异,均无明显毒副反应,为临床恩替卡韦联合苦参素治疗CHB提供了有力的数据支撑,但还需进一步的多中心、大样本的RCT研究加以验证。

