351例Ⅰ~Ⅲ期左、右半结肠癌临床病理特征及生存对比研究*
阿古达木,王朝阳,杨志文,郝 钦,张 震,乌新林
(内蒙古医科大学附属医院胃肠外科,呼和浩特 010050)
近年来,结直肠癌(CRC)发病率维持在一个较高的水平,在全球恶性肿瘤中居第4位[1]。参考我国最新的癌症流行病学谱,CRC的发病率和病死率居恶性肿瘤的第5位[2]。故对CRC的关注度越来越高。随着精准化医学的发展,大量的研究旨在有效地针对肿瘤的不同特征采取适当的措施。对于肿瘤个体化评价治疗尤为重要。因左、右半结肠胚胎来源、解剖功能及肿瘤发生机制的差异,早在1990年芬兰学者BUFILL[3]就提出左半结肠和右半结肠肿瘤为两种不同的肿瘤。也有越来越多的临床研究支持这一结论[4]。右半结肠从盲肠到横结肠。左半结肠始于脾曲,包括降结肠,乙状结肠,不包括直肠。相应部位的癌症被称为右半结肠癌(RCC)和左半结肠癌(LCC)。但是,目前没有确切的证据证明LCC、RCC生存预后差异是否与肿瘤位置相关[5-7]。本研究对LCC、RCC患者的临床病理特征及生存状况进行比较,现报道如下。
1 资料与方法
1.1 一般资料
选择本院2009年1月1日至2012年12月31日收治的结肠癌并行结肠癌根治术的患者351例。纳入标准:(1)根治性切除术后结肠癌患者;(2)手术后病理为TNM分期Ⅰ~Ⅲ期结肠癌,根据美国癌症联合委员会(AJCC)结肠恶性肿瘤TNM分期标准(第8版)进行分期;(3)患者的临床数据完整。排除标准:(1)多部位(两处及以上)结肠癌的患者;(2)除结肠癌同时患有其他恶性肿瘤的患者;(3)患有严重传染病的患者;(4)患有心脏、肝或肾衰竭患者;(5)新辅助放化疗患者;(6)遗传性非息肉病性结直肠癌( HNPCC)及家族性腺瘤性息肉病(FAP)患者。根据肿瘤位置将351例患者分为两组,LCC组(n=170):包括乙状结肠癌133例,降结肠癌33例,脾曲癌4例;RCC组(n=181):包括横结肠癌35例,肝曲癌15例,升结肠癌91例,回盲部癌40例。
1.2 方法
收集比较两组患者年龄、性别、临床症状、手术前血红蛋白、癌胚抗原(CEA)、糖类抗原(CA19-9),组织病理学类型、肿瘤分化程度、TNM分期及5年总生存率(OS)等。通过电话、门诊随访等,定期复查了解患者病情情况。
1.3 统计学处理
数据采用SPSS20.0软件进行统计分析,计数资料以率表示,组间比较采用χ2检验。用Kaplan-Meier绘制生存曲线,用Log-rank分析比较生存时间。多因素Cox回归分析生存预后的影响因素,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者临床特征比较
351例结肠癌患者中,男220例(62.68%),女131例(37.32%),男性患者比例明显高于女性(P<0.05)。LCC组中男性患者比例明显高于女性[54.54%(120/220)vs.38.17%(50/131)],RCC组中女性患者比例明显高于男性[61.83% (81/131)vs.45.45%(100/220)],两组患者性别比较差异有统计学意义(P<0.05)。两组患者均以60~<75岁为高发年龄段,两组患者各年龄段发病率比较差异无统计学意义(P=0.868)。临床首发症状中,两组患者出现便血、排便习惯改变、腹痛、腹胀、腹泻、腹部肿块等症状方面比较,差异均有统计学意义(P<0.05)。两组患者手术前血红蛋白水平及CEA阳性(>5 ng/mL)、CA19-9阳性(>37 U/mL)比较,差异均有统计学意义(P<0.05),见表1。

表1 两组患者临床特征比较[n(%)]
2.2 两组患者组织病理特征比较
RCC组患者病理特征是以中低分化的腺癌为主,黏液腺癌、印戒细胞癌比例明显高于LCC组;肿瘤分型中RCC组患者以溃疡型为主、直径较大,两组患者病理特征比较,差异有统计学意义(P<0.05),见表2。
2.3 两组患者肿瘤TNM分期比较
LCC、RCC组患者T分期中,T1~2分期比较差异无统计学意义(χ2=0.637,P=0.430),而T3~4分期比较差异有统计学意义(χ2=5.340,P<0.047),且两组患者总T分期比较差异有统计学意义(χ2=9.128,P=0.028)。两组患者N分期比较差异无统计学意义(χ2=0.365,P=0.833)。两组患者TNM分期比较差异有统计学意义(χ2=7.950,P=0.048),见表3。

表2 两组患者组织病理特征比较[n(%)]

表3 两组患者肿瘤TNM分期比较[n(%)]
2.4 两组患者5年生存率比较
失访50例患者,失访率为14.25%,其他原因死亡20例。最终LCC、RCC组分别有128、153例患者获得随访,绘制Kplan-Meier曲线显示,LCC组患者的5年总生存率为71.88%(92/128),RCC组患者为60.13%(92/153),LCC组患者的5年总生存率明显高于RCC组患者(χ2=6.368,P=0.012)。通过亚组分析,两组Ⅰ、Ⅱ期患者的5年生存率比较差异无统计学意义(P>0.05),而LCC组Ⅲ期患者的生存率明显高于RCC组(P<0.05),见表4及图1~4。

表4 两组患者TNM分期5年生存状况比较[n(%)]

图1 LCC、RCC生存曲线
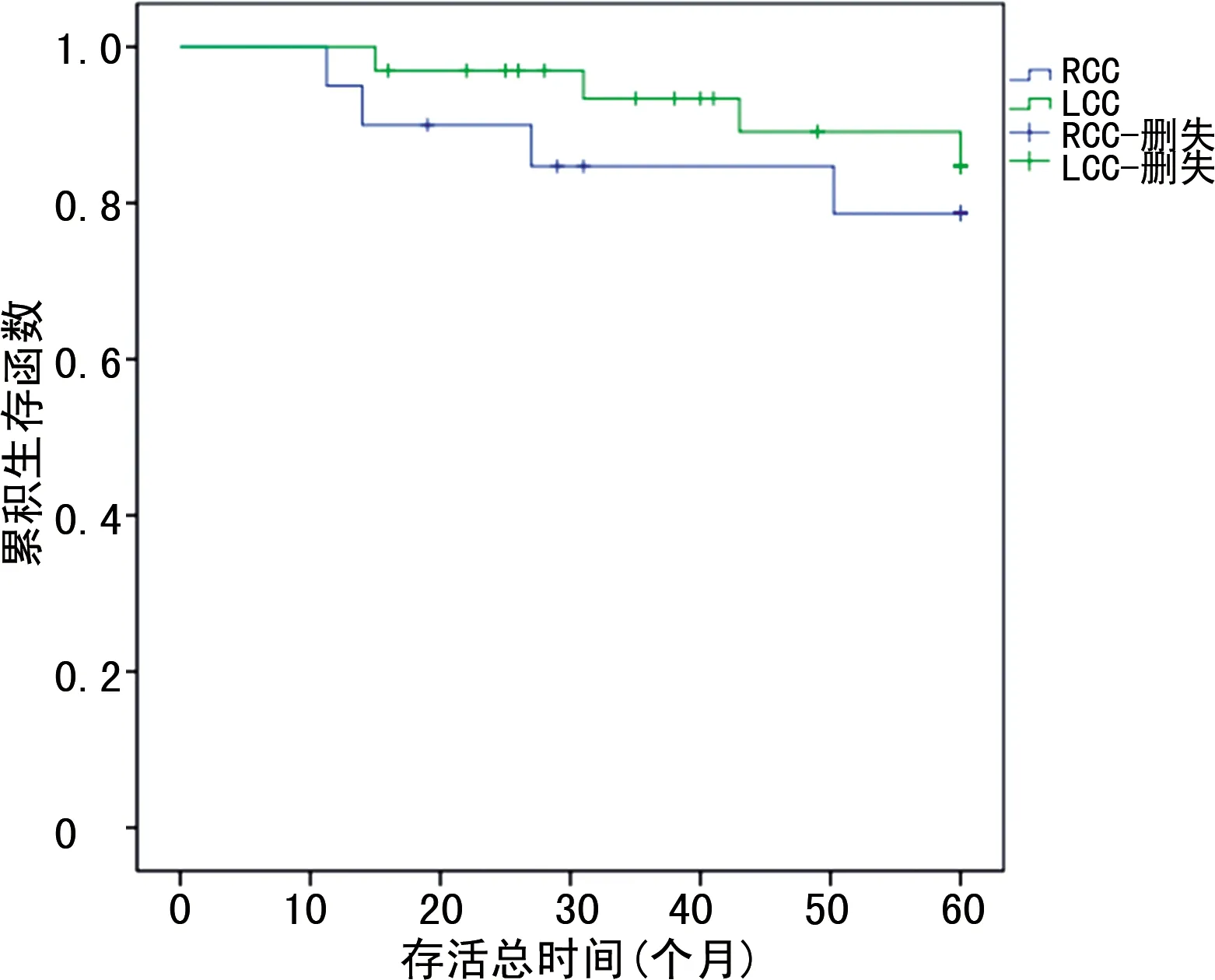
图2 Ⅰ期LCC、RCC生存曲线
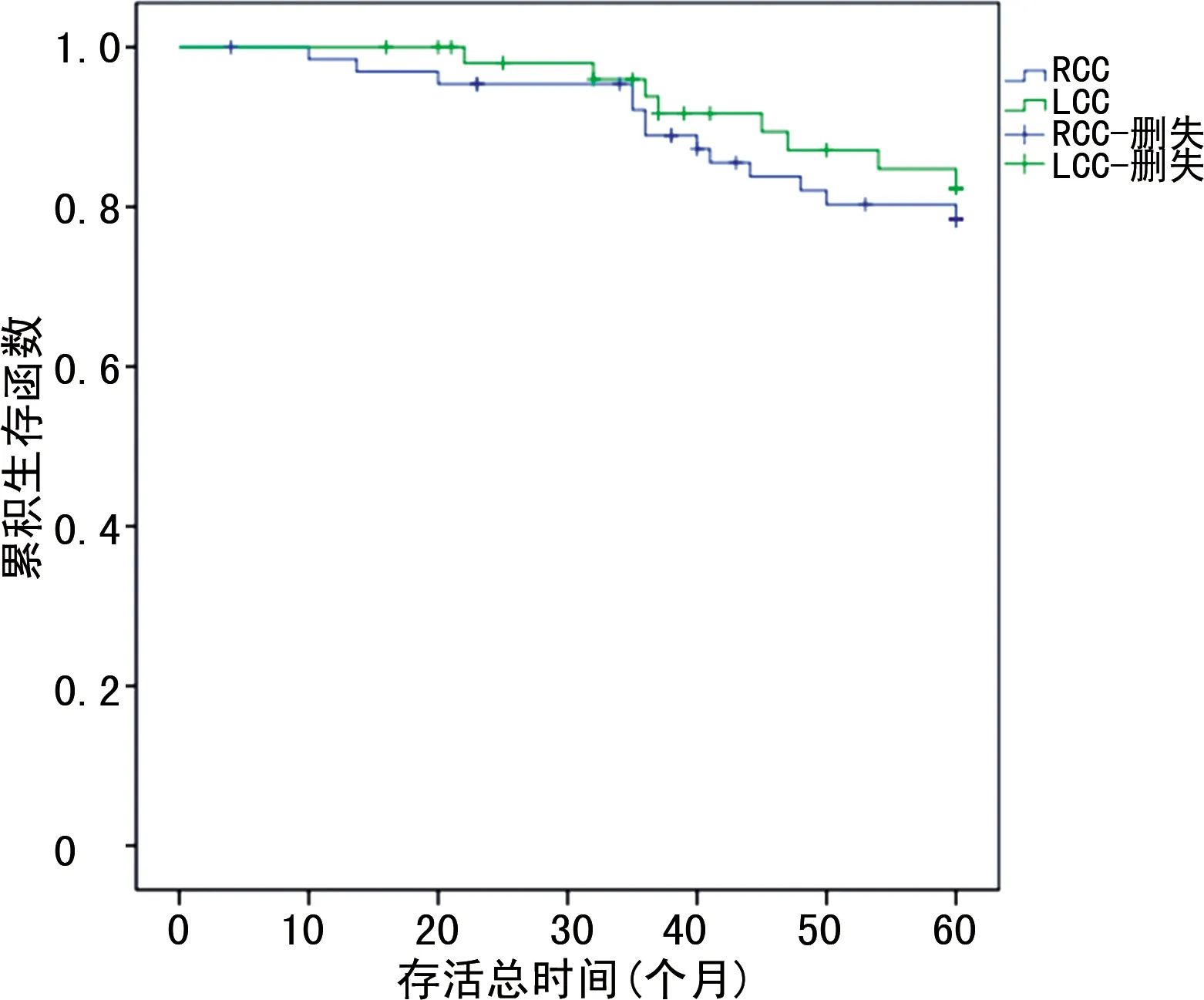
图3 Ⅱ期LCC、RCC生存曲线

图4 Ⅲ期LCC、RCC生存曲线
2.5 LCC、RCC生存预后影响因素分析
对于Ⅰ~Ⅲ期结肠癌,肿瘤分期晚、低分化、黏液腺癌、印戒细胞癌、手术前贫血、CEA、CA19-9水平升高预测出患者预后差。而肿瘤部位并不是独立的预后危险因素(P=0.865),见表5。
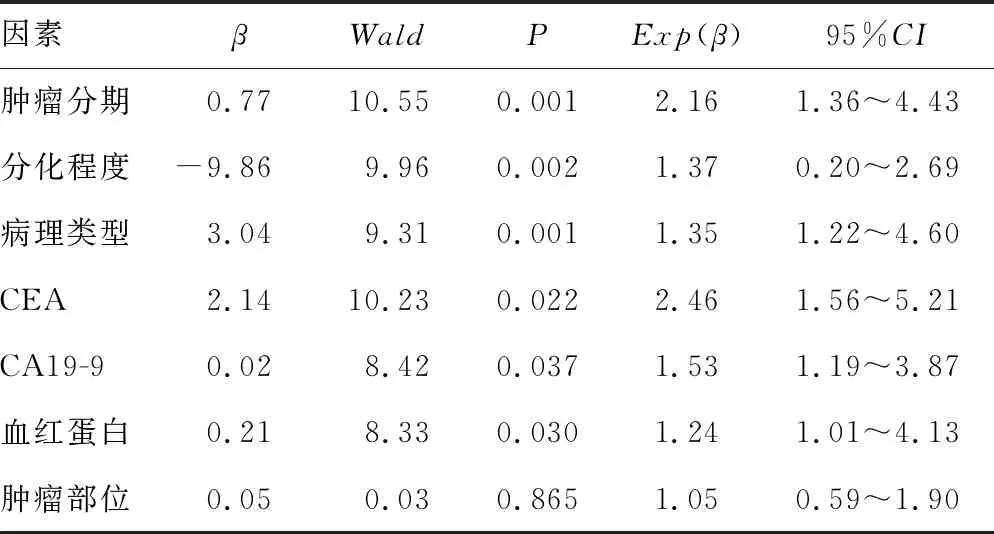
表5 Cox多因素回归分析
3 讨 论
结肠起源于中肠和后肠,随后又分化为左右结肠。越来越多的研究表明,LCC、RCC的临床症状、发病率、组织病理学和分子生物学特征存在差异,为两种不同的疾病,并有不同的结局。然而,这些差异并没有被完全接受。目前还缺乏预测LCC、RCC预后的特异性检测指标。
本研究结果表明,男性患结肠癌的比例明显高于女性(P<0.05)。男性的LCC比率较高,女性的RCC比率较高,二者比较差异有统计学意义(P<0.05)。有研究显示,年轻女性(18~44岁)的总体生存率优于同龄男性[8]。而这一结果可能与雌激素水平有关,激素替代疗法可使绝经后妇女的CRC发生率降低30%[9]。异常隐窝病变是人类大肠黏膜表面异常大的结肠黏膜窝簇。然而,增生性和腺瘤性息肉大多是由结肠黏膜的异常隐窝发展而来,然后发展成腺癌。细胞和动物研究表明,雌激素治疗可以减少小鼠异常隐窝病灶[10]。所有这些结果都表明雌激素可能是一种保护因素,可降低结肠癌的发生率。在年龄组中,60~<75岁是风险最大的年龄组,这可能与人口老龄化、风险因素增加等存在着紧密的关联性。有研究报道,RCC更好发于老年人及女性[11-12]。而本研究中LCC、RCC发病年龄比较,差异无统计学意义(P>0.05)。
临床首发症状对比分析发现,LCC多以血便、排便习惯改变为主要症状,这与左半结肠肠腔相对窄,肿瘤多为腔内生长型,容易发生肠梗阻、排便习惯改变有关,出现临床症状较早;而RCC多出现腹胀、腹痛、腹泻及腹部肿块。
本研究两组患者术前CEA、CA19-9阳性率比较,差异有统计学意义(P<0.05)。表明CEA和CA19-9的血清水平是预测结肠癌较好的肿瘤标志。CEA和CA19-9的增长与结肠癌患者的不良预后存在着紧密的关联性[13]。BECERRA等[14]研究结果表明,CEA高水平患者的存活率低于CEA正常水平患者(P<0.000 1)。本研究中两组患者术前血红蛋白水平比较,差异有统计学意义(P<0.05)。有研究发现,术前贫血差异与LCC、RCC分期、大体分型有关[15]。贫血是一个独立的危险因素,这与AN等[16]研究一致,该研究认为贫血是结肠癌的危险因素。由于RCC症状出现的时间比LCC晚,而且不易早发现,因此,通常是长期血液流失导致的贫血。贫血患者常合并营养不良、免疫功能低下,术后容易发生并发症等情况,这也可能一定程度上影响患者预后。
本研究结果显示,RCC患者比LCC患者预后更差。RCC多以中低分化腺癌,相对LCC黏液腺癌及印戒细胞癌的占比大,RCC肿瘤直径较大,溃疡型为主。因黏液腺癌及印戒细胞癌生物学行为较恶,可能导致肿瘤分期晚、容易远处转移、这与RCC预后差有关。BENEDIX等[11]对17 641例LCC、RCC进行对比分析,结果显示RCC低分化,非腺癌的比例高,肿瘤分期晚。从解剖上,结肠从盲肠至乙状结肠管腔逐渐变窄,故RCC出现梗阻症状较LCC晚。RCC出现临床症状较晚,早期不易发现,发现时肿瘤分期较晚,预后较差。该研究还发现,RCC总分期较晚,5年总生存率低于LCC(P<0.05)。因RCC分化差、早期不易发现、发现时肿瘤分期已较晚等原因,使RCC生存预后更差。LCC、RCC患者的预后差异可能对肿瘤分期有依赖性。本研究表明,LCC比RCC有更高的5年总生存率(P<0.05),亚组分析显示,LCC、RCC Ⅰ、Ⅱ期总体5年生存率无差异,Ⅲ期LCC总生存率明显高于RCC(P<0.05)。这一结果与文献[11,17]研究结果相同,LCC患者的5年总生存率高于RCC 患者。同时,LCC、RCC患者其他恶性肿瘤发生的可能性也很高(P<0.05),增加了第二原发肿瘤的病死率,尤其是Ⅲ期肿瘤[18]。有研究发现,RCC远处转移率明显高于LCC[19],这意味着更多的患者不能接受外科手术治疗。
综上所述,LCC、RCC的临床表现和病理特征存在差异,RCC多以腹痛、腹胀、腹泻及腹部包块为首发症状,易贫血,CEA、CA19-9阳性率高,肿瘤发现时病理分期较晚,以中低分化、溃疡型为主,5年生存率低于LCC。左、右半结肠生理解剖、胚胎起源不同,肿瘤发生机制不同[20],在今后临床工作中应该将LCC、RCC视为两种不同的肿瘤。

