四川地区猪源戊型肝炎病毒感染的分子流行病学调查
张毅,陈斌,梁璐琪,邵靓,周明忠,裴超信,陈弟诗,丁梦蝶,陈冬
(四川省动物疫病预防控制中心,四川 成都 610041)
戊型肝炎是一种人畜共患传染病,由戊型肝炎病毒(hepatitis E virus, HEV)引起,人的发病以青壮年为主,病程4~6 周,死亡率0.5%~3%,临床可表现从亚临床感染到重度肝炎,对妊娠、慢性肝病、免疫缺陷、器官移植等特殊人群威胁重大[1]。对人易感的HEV仅有1个血清型,4个基因型[2],其中基因1型、2型仅感染人,基因3型、4型则可感染人和猪、鼠等多种动物。猪是HEV主要的储存宿主和传染源,其感染HEV时不产生明显临床症状和病变,猪源HEV可能通过食用未煮熟的猪肉产品[3]、长期的职业暴露(屠宰场工人[4]、兽医[5])等途径传播给人,对于公共卫生安全是一种严重的潜在威胁。
HEV基因组全长约7.2 kb,目前已发现4个开放阅读框(open reading frame, ORF)。ORF1主要编码复制相关的非结构蛋白;ORF2和ORF3由病毒亚基因组的可选阅读框产生,分别编码衣壳蛋白和小免疫磷蛋白,ORF2编码的衣壳蛋白含有重要免疫表位,后者与细胞骨架相关;ORF4只在基因1型中发现,编码区位于ORF1内部,编码蛋白通过形成蛋白复合物参与病毒的复制[6]。
为了解四川猪源HEV流行特征,本研究对四川部分地区的屠宰场生猪进行HEV监测,并对HEV编码衣壳蛋白的ORF2部分序列进行同源性和系统进化分析,为HEV的防控策略提供参考依据。
1 材料与方法
1.1 样品来源
2019年在四川省13个地区屠宰场采集的猪组织样品(淋巴结、肝)358份,-20 ℃保存。
1.2 主要试剂
MagMAXTMPathogen RNA/DNA Kit总核酸提取试剂盒,购自Thermo Fisher Scientific 公司; One Step PrimeScriptTMRT-PCR Kit (Perfect Real Time)、PrimeScriptTMOne Step RT-PCR Kit Ver.2、Tks GflexTMDNA Polymerase、DL2000 DNA Marker等,购自宝日医生物技术有限公司。
1.3 引物、探针的设计与合成
荧光定量PCR(qRT-PCR)检测:参照文献[7]建立的方法进行。
套式RT-PCR(RT-nPCR):根据GenBank中3型与4型HEV基因组序列,进行核苷酸比对分析,在HEV ORF2的保守区设计2对套式PCR引物HEV-out-F和HEV-out-R、HEV-in-F和HEV-in-R,终产物为ORF2 5′端长度为1 020 nt的部分序列(去除两端引物后为977 nt)。引物、探针由生工生物工程(上海)股份有限公司合成,详见表1。

表1 HEV检测和序列扩增所用引物、探针
1.4 样品前处理
将每份样品的淋巴结、肝各剪取约0.01 g,混合后放入裂解介质管,加入800 μL PBS,使用组织匀浆仪匀浆1 min,8 000 r/min 离心2 min,取组织上清液200 μL进行总核酸提取。
1.5 核酸提取
使用MagMAXTMPathogen RNA/DNA Kit总核酸提取试剂盒,配合自动核酸提取仪提取组织上清液中的总核酸。总核酸置-70 ℃保存。
1.6 HEV的qRT-PCR检测
使用One Step PrimeScriptTMRT-PCR Kit (Perfect Real Time)进行qRT-PCR检测。反应体系为:10 μmol/L上游引物1 μL,10 μmol/L下游引物1 μL,10 μmol/L探针0.5 μL,2×buffer 10 μL,反转录酶0.4 μL,TaqDNA聚合酶0.4 μL,总核酸 2 μL,无核酸酶水4.7 μL。反应条件为:42 ℃,5 min;95 ℃ 10 s;95 ℃ 10 s,55 ℃ 20 s,72 ℃ 20 s,40个循环。出现特异性扩增曲线的样品判定为阳性。
1.7 HEV ORF2部分序列的扩增
选出qRT-PCR阳性样品的总核酸,使用设计的RT-nPCR方法分两步进行扩增。首先使用PrimeScriptTMOne Step RT-PCR Kit Ver.2进行一步法RT-PCR,反应体系为:10 μmol/L上游引物1 μL,10 μmol/L下游引物1 μL,RT-PCR反应液10 μL,酶混合物0.8 μL,总核酸 2 μL,无核酸酶水5.2 μL。反应条件为:50 ℃,30 min;94 ℃,2 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 75 s,35个循环。随后用无核酸酶水对扩增产物进行100倍稀释,作为第2轮扩增DNA模板。使用Tks Gflex DNA Polymerase进行第2轮PCR扩增,反应体系为:10 μmol/L上游引物2.5 μL,10 μmol/L下游引物2.5 μL,Gflex反应液25 μL,Gflex DNA聚合酶1 μL,DNA模板2 μL,无核酸酶水17 μL。反应条件为:94 ℃,1 min;98 ℃ 10 s,56 ℃ 15 s,68 ℃ 30 s,30个循环。取第2轮PCR扩增产物用琼脂糖凝胶电泳检测,成功获得目的片段的样品送生工生物工程(上海)股份有限公司克隆测序。
1.8 HEV ORF2部分序列分析
将获得的HEV ORF2部分序列提交GenBank,从GenBank中获取禽源HEV 1株,HEV基因1、2、3、4型代表株26株,BLAST相似率最高的HEV毒株11株,共计38条HEV ORF2部分序列作为参考,使用Lasergene 7.0 的 MegAlign 模块的Clustal W方法进行核苷酸比对分析(不包括禽源HEV),使用MEGA 7.0进行Neighbor-Joining法系统进化分析。
2 结果与分析
2.1 屠宰场HEV核酸检测
qRT-PCR检测结果显示,屠宰场猪组织样品HEV总阳性率为4.75%(17/358),61.54%(8/13)的地区有HEV阳性样品检出,不同地区阳性率为4.35%~44.44%。各地区检测结果见表2。
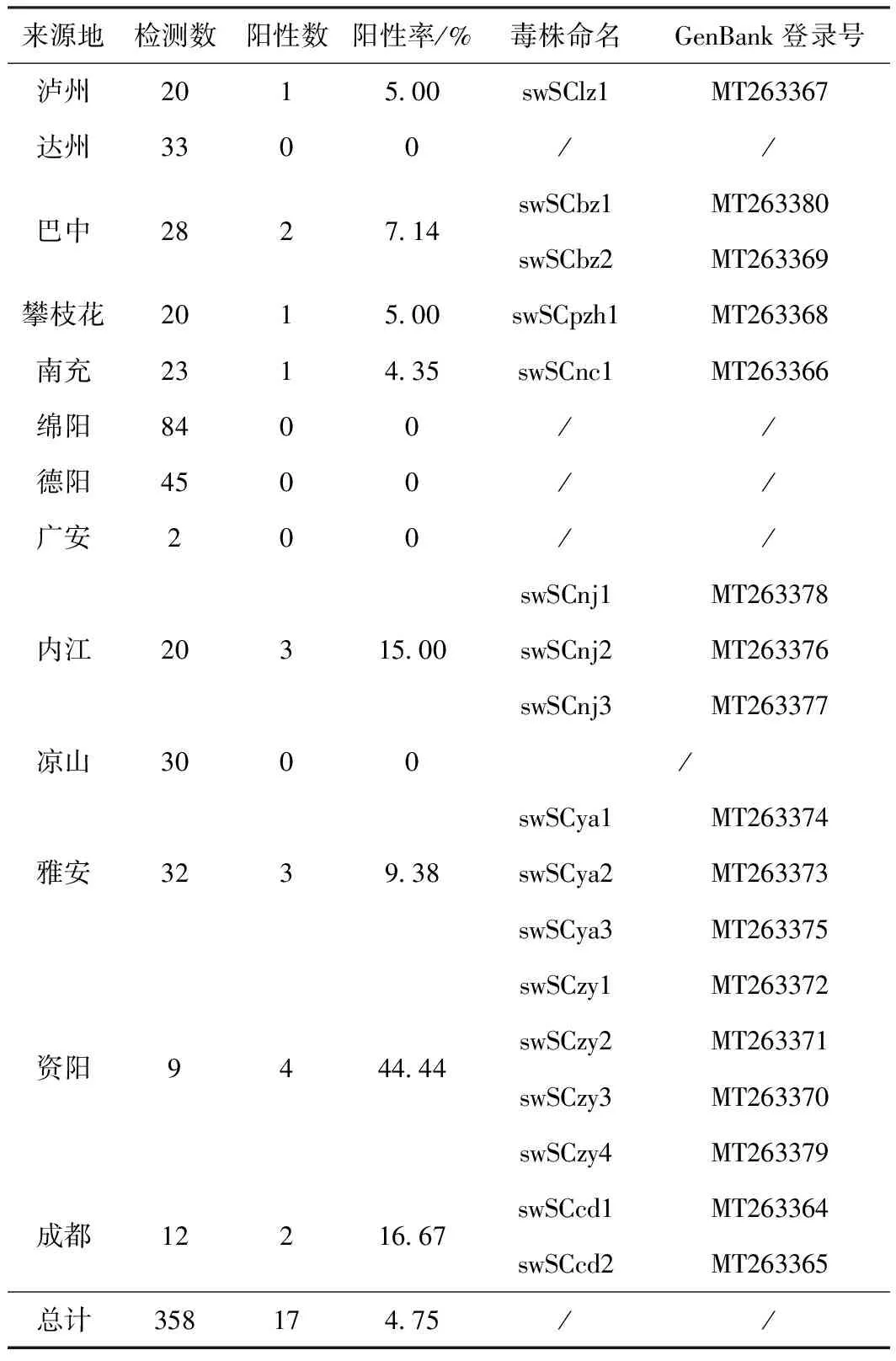
表2 HEV检测结果、阳性样品的毒株命名及GenBank登录号
2.2 ORF2部分序列RT-nPCR扩增
使用建立的RT-nPCR方法,17份阳性样品的ORF2部分序列均成功扩增,见图1。
2.3 HEV ORF2部分序列分析
2.3.1 同源性分析
17个四川HEV毒株的ORF2部分序列均长977 nt,与参考序列相比,未发生缺失和插入。提交GenBank,序列号为MT263364-MT263380。核苷酸比对分析发现,17个毒株序列之间同源率存在较大差异(85.4%~99.4%)。一些来自相同地区的毒株高度同源,如3个资阳株swSCzy2、swSCzy3、swSCzy4之间同源率高达99%~99.4%;但多数地区存在差异较大的毒株,如3个雅安株之间、资阳株swSCzy1和其他3个资阳株之间,同源性分别只有85.37%~87.5%和87.1%~87.4%。

M.DL2000 Marker;1~17.HEV阳性样品的ORF2产物
将17个四川毒株与37个参考序列比较,同源率为76.4%~97%,其中swSCcd1与基因4d型的中国猪源毒株CHN-SD-sHEV同源率最高为97%,swSCbz1、swSCnc1均与基因1型的印度人源毒株IND-HEV-AVH5-2010同源率最低为76.5%。swSCnj1等8个毒株与4a亚型代表株JKO-ChiSai98C同源率较高(91.6%~92.6%),swSCya2等3个毒株与4b亚型代表株CVS-Sie10同源率较高(94.6%~95.6%),swSCcd1等6个毒株与4d亚型代表株CH-YT-1同源率较高(94.7%~95.9%)。17个毒株中,有10株与人源毒株同源率超过95%,有6株与人源毒株同源率高于猪源毒株,同源率在94.6%~96%之间,与猪源毒株同源率更高的有11株,同源率在94%~97%之间,详见表3。
2.3.2 系统进化分析
如图2所示,HEV基因1~4型形成4个主要的进化分支,1型和2型由人源HEV毒株组成,3型和4型由人源、猴源、猪源、藏猪源等毒株组成,17个四川毒株的ORF2部分序列分别处于基因4型中的4a、4b和4d亚分支,3个亚分支均同时包含人源、猪源HEV毒株。其中swSCnj1、swSCnj2、swSCzy2、swSCzy3、swSCzy4、swSCya3、swSClz1、swSCnj3等8株,与4a亚型代表株JKO-ChiSai98C处于同一亚分支,划为4a亚型;swSCya2、swSCbz2、swSCzy1等3株与4b亚型代表株CVS-Sie10处于同一亚分支,划为4b亚型; swSCcd1、swSCnc1、swSCbz1、swSCpzh1、swSCcd2、swSCya1等6株与4d亚型代表株CH-YT-1处于同一亚分支,划为4d亚型。
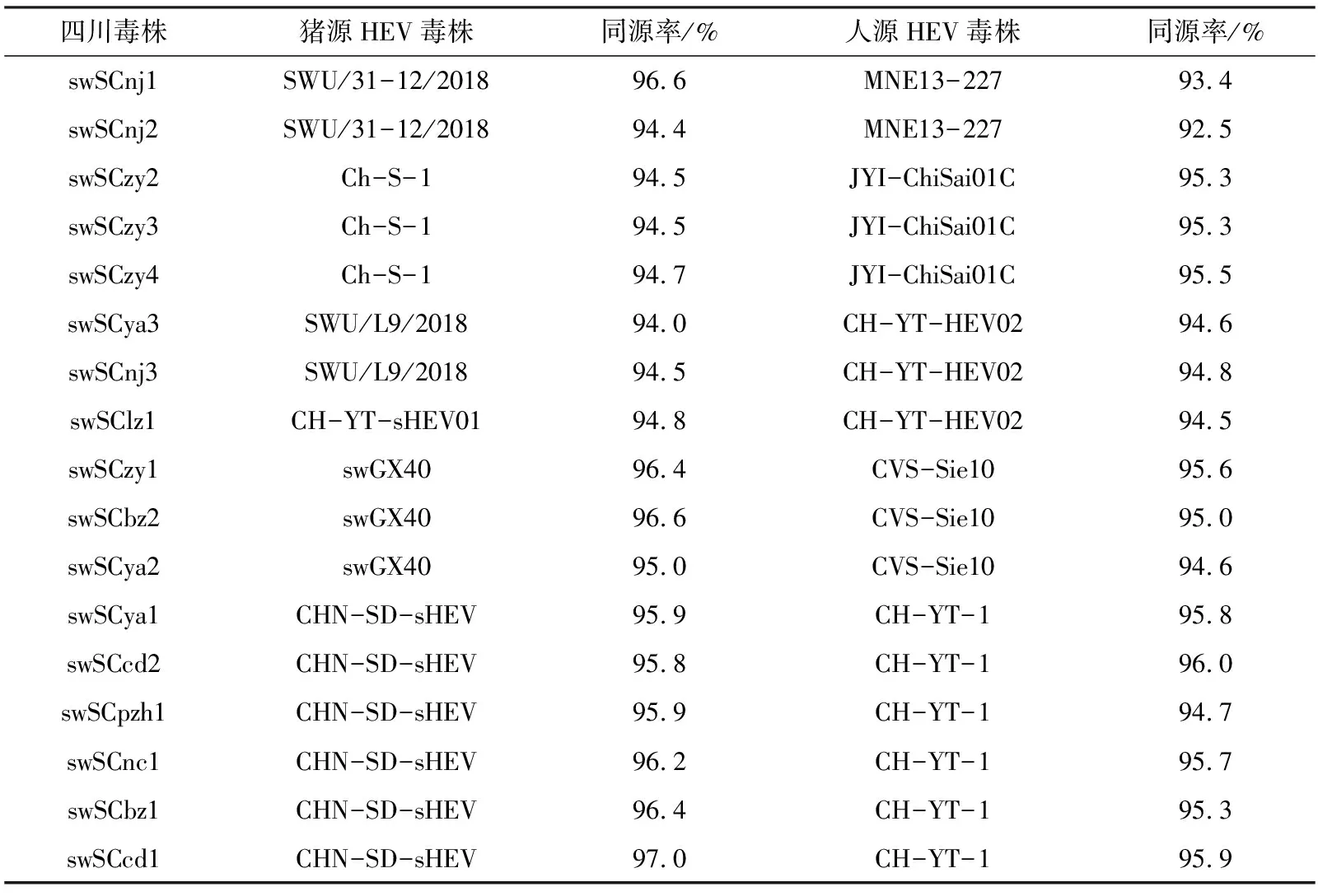
表3 四川猪源HEV毒株同源性最高的猪源及人源HEV毒株

▲为本研究测定的毒株序列
3 讨论
我国是戊型肝炎高发地区,自2001年以来,人感染戊型肝炎呈上升趋势[8]。生猪是HEV的主要动物宿主和传染源之一,四川地区一些屠宰场设施自动化程度、生物安全水平较低,人感染HEV的风险需要评估。因此,有必要对生猪的带毒情况进行监测。由于抗体水平无法实时反映带毒情况,本研究采用敏感性高的荧光RT-PCR方法进行检测,结果表明四川13个地区中有8个地区的猪群存在HEV感染,地区分布较广,总阳性率为4.21%。与中国不同地区猪群HEV阳性率差异较大(2.25%~46.7%)[9-13]的情况相似,四川省也表现出地区间阳性率差异大的特征,为0~44.44%。其中阳性率在前位的资阳市、成都市、内江市均是四川省生猪交易频繁的地区,HEV阳性率可能与生猪流动频率相关,但还需进一步收集证据。
我国猪群主要流行HEV基因4型,其中4a和4d占主导地位,基因3型和基因4型的其他亚型也有报道。对17株HEV ORF2部分序列进行分析,核苷酸同源性为85.4%~99.4%,均为基因4型,其中4a亚型8株,4b亚型3株,4d亚型6株,与中国现在流行趋势一致[14-15],而4b亚型也是四川[16]、广西[10]、广东[17]地区的优势基因亚型。本研究发现的4a和4d亚型毒株与四川甘孜藏猪源HEV毒株有较高同源性,表明猪源HEV遗传有较强的地域性特征。
目前已通过动物试验证实,猪源基因3型、4型HEV可感染非人灵长类,人源基因3型、4型HEV也可感染猪。从人医临床上看,欧洲、美国等国家主要流行基因1、3型[18];我国主要流行基因1、4型,其中4型又以4a、4d、4h亚型为主[19],四川猪源HEV优势亚型中的4a、4d与人源毒株亚型一致。本研究发现,17个四川猪源毒株中有10株与人源毒株同源率超过95%,有6株与人源HEV的同源率高于猪源,表明四川猪源HEV与我国主要流行的人源HEV遗传关系密切,具有较大的人畜共患风险,应提高防范意识,有针对性、系统性地进行预防和控制。

