非洲猪瘟病毒感染猪胃肝淋巴结病理组织学变化特征
陈畅,何希君,汪昊,伍靖贤,吴睿智,丁佰韬,步志高,陈秋生*
(1. 南京农业大学动物医学院,江苏 南京 210095;2. 中国农业科学院哈尔滨兽医研究所,黑龙江 哈尔滨 150069;3. 江苏省滨海县农业农村局,江苏 盐城 224523)
非洲猪瘟(African swine fever,ASF)自2018年在我国首次暴发以来备受关注,由于该病目前缺乏有效的商品化疫苗,一旦发生疫情,只能通过扑杀感染猪来控制疫情,给我国生猪养殖业带来巨大经济损失。ASF由非洲猪瘟病毒(African swine fever virus,ASFV)引起,该病毒是非洲猪瘟科非洲猪瘟病毒属的唯一成员[1]。病毒颗粒的直径为175~215 nm,呈20面体对称,有囊膜,基因组为双股线状DNA,大小170~190 kb[2]。ASFV主要在网状内皮细胞和单核巨噬细胞中复制[3-4]。病毒主要分布于病猪的各组织器官、体液、分泌物和排泄物中,以淋巴结、脾脏和肾脏中含量最高。病毒主要通过猪的消化道和呼吸道感染,吸血昆虫叮咬也可机械传播本病[5]。该病感染率高,发病快,致死率高,在世界范围内流行,严重威胁全球的生猪养殖业。
淋巴结是机体重要的免疫器官,当机体某器官或部位发生病变或被病毒、细菌等异物入侵时,病原体可随淋巴管扩散到附近相应的淋巴结,淋巴结具有拦截和清除这些病毒和细菌等异物的作用,防止病原体扩散。临床上ASFV感染猪出现脾肿大,肾脏皮质和肾盂出血,膀胱黏膜、心外膜、心内膜和胸膜有瘀点出血等[6]。除此之外,淋巴结更是该病发生病理变化的重要器官,有文献指出,感染ASFV后淋巴结广泛性出血,呈大理石花纹状[7]。之前的文献多是从器官水平上对该病的病理变化做了宏观研究,而关于该病对淋巴结组织的具体损伤和病理变化研究,以及从细胞水平和微观水平上对该病的研究极少。本研究系统地观察并分析了感染ASFV的各种淋巴结,发现不同淋巴结感染ASFV后均出现不同程度的病理学变化,其中,胃肝淋巴结相较于其他淋巴结病理变化最为显著。因此,本研究选取感染ASFV的胃肝淋巴结作为研究对象,通过光镜和电镜技术对ASFV引起的胃肝淋巴结病理组织学变化以及病理变化和病毒剂量的关系进行详细比较,为后续ASF病理组织学的深入研究提供参考。
1 材料与方法
1.1 实验动物及试验设计
本试验选择12周龄健康的SPF猪(由哈尔滨兽医研究所SPF实验动物中心提供),并分为3组,每组3头猪,其中1组作为健康对照组,另外2组作为感染组,肌肉注射ASFV HLJ/18株(由哈尔滨兽医研究所提供)。本研究注射的病毒滴度为107.2HAD50/mL(HAD50:半数红细胞吸附量),2感染组注射病毒剂量分别为103HAD50和104HAD50。感染104HAD50剂量的猪第6天死亡并剖检取材,作为高剂量组;感染103HAD50剂量的猪第8天死亡并剖检取材,作为低剂量组。病毒感染试验与样品采集和处理,均在哈尔滨兽医研究所P4实验室进行。
1.2 HE染色
采集的胃肝淋巴结样品保存在4%多聚甲醛(P6148,Sigma-Aldrich)中,石蜡包埋,用切片机(RM2015,德国Leica)制成石蜡切片,HE染色(苏木精1 min 40 s,伊红8 s)。奥林巴斯显微镜(DP73,日本Olympas)观察分析。
1.3 网状纤维染色
用Gordon and Sweets方法对胃肝淋巴结网状纤维进行染色。切片用1%高锰酸钾(441244,Sigma-Aldrich)氧化3 min,草酸溶液(247537,Sigma-Aldrich)漂白2.5 min,2.5%的铁铵明矾(A9750,北京阳光生物技术有限公司)处理15 min使嗜银染色效果更好,氨水银盐溶液(R20376,源叶生物技术有限公司)镀银,10%甲醛(Sigma-Aldrich F8775)处理切片1.5 min还原银盐,0.2%的氯化金(S30172,源叶生物技术有限公司)调整颜色2 min,最后用5%的硫代硫酸钠(S24159,源叶生物技术有限公司)去除银盐2.5 min。显微镜观察。
1.4 透射电子显微镜
1 mm3的胃肝淋巴结组织块在2.5%戊二醛溶液中固定9 h,0.1 mol/L磷酸缓存液(pH=7.4)清洗3次,15 min/次。丙酮梯度脱水(30%、50%、70%、80%、90%各1次,15 min/次,100%丙酮3次,20 min/次)。包埋剂浸渍、修块、切片、染色(3%醋酸双氧铀25 min,3%柠檬酸铅15 min)。观察切片并用透射电子显微镜(日立H-7650)拍照。
1.5 数据统计与分析
采用IBM SPSS Statistics软件进行统计分析,进行单因素方差分析和邓肯检验。GraphPad Prism 5.0软件绘制相应的直方图。数据以“平均值±标准误”表示。
2 结果与分析
2.1 HE染色
胃肝淋巴结被膜下、小梁周围以及皮质区淋巴小结等处严重淤血、出血,严重者正常结构被破坏,可见炎性细胞增多(图1)。低剂量感染猪淋巴小结结构变化不明显(图1a、1c),病理变化主要发生在被膜下,充满大量红细胞,但红细胞未破损(图2a)。高剂量感染猪相较低剂量感染猪病理变化更严重,淋巴小结结构模糊,与周围组织界限不清,不形成规则的圆形或椭圆形结构,淋巴小结区域也严重淤血(图1b、1d)。高剂量感染猪被膜下和小梁周围都严重出血,淋巴窦间隙增大,分布在其中的红细胞破裂并发生溶血现象(图2b)。关于淋巴细胞的变化情况,正常组淋巴细胞呈规则的圆形,淋巴细胞之间网状细胞均匀分布其间(图3a);低剂量感染猪淋巴细胞分布无规则,有少量红细胞从血管渗出分布于淋巴细胞之间(图3b);高剂量感染猪淋巴细胞形状发生变化,呈不规则的“括号状”或“逗点状”,可见大量红细胞破裂,发生溶血现象(图3c)。本研究中未发现淋巴结中淋巴细胞缺失,与正常组相比,103HAD50剂量组和104HAD50剂量组淋巴细胞甚至有增多的趋势。
2.2 网状纤维染色
对照猪网状纤维分布稀疏,纤维不发达,网状纤维的分支细而疏松,染色较浅(图4a、4d、4g);感染猪网状纤维变粗,分布杂乱不规则,围绕淋巴小结周围的和小梁周围的网状纤维数量增多,纤维增粗,颜色深染,且ASFV剂量越高,网状纤维直径越大,数量越多(图4b、4c、4e、4f、4h、4i)。与对照猪相比,低剂量感染猪和高剂量感染猪胃肝淋巴结网状纤维面积百分占比均增加,差异极显著(P<0.01)。且剂量越高,网状纤维面积百分占比越大(图5)。
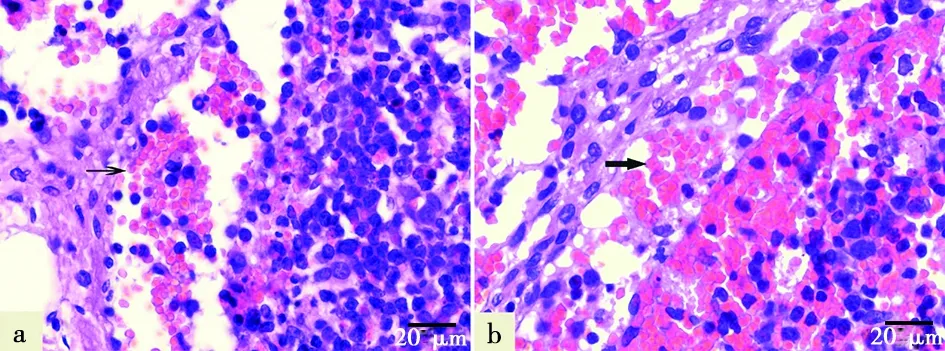
a. 103HAD50剂量组:结构完整的红细胞(→);b. 104HAD50剂量组:破裂的红细胞()
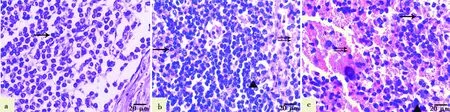
a. 对照组:淋巴细胞呈椭圆形或圆形(→);b. 103HAD50剂量组:淋巴细胞呈不规则的多边形(→),淋巴细胞间散在分布的红细胞巨噬细胞();c. 104HAD50剂量组:变形呈“逗点状”的淋巴细胞(→),淋巴细胞间大量分布的红细胞巨噬细胞()
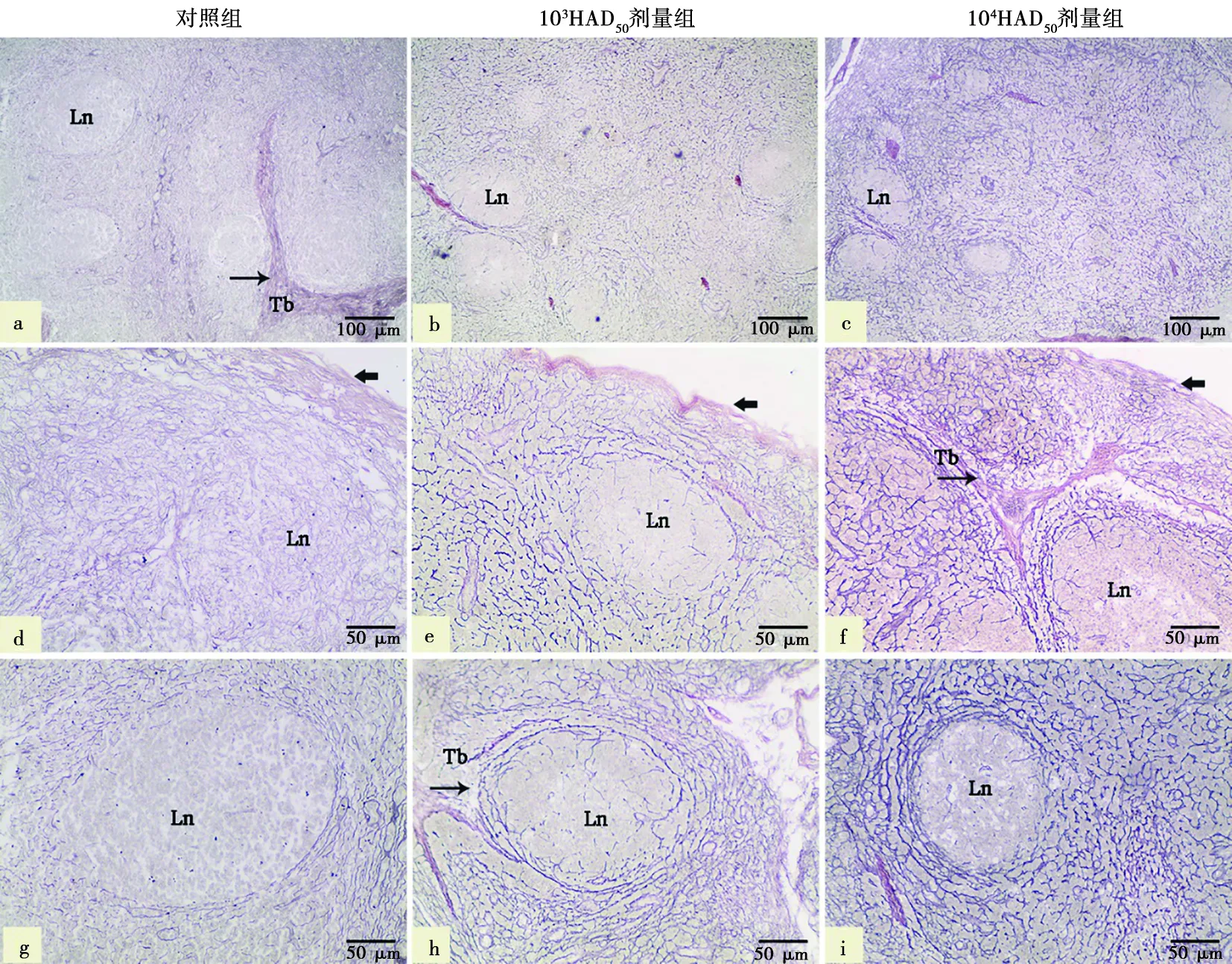
a、b、c.低倍镜下淋巴小结周围网状纤维;d、e、f.被膜下网状纤维;g、h、i.高倍镜下淋巴小结周围网状纤维。Ln.淋巴小结;Tb.淋巴小梁(→);.被膜
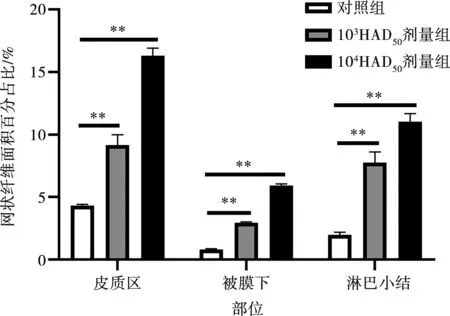
*表示差异显著(P<0.05),**表示差异极显著(P<0.01)
2.3 透射电子显微镜
电镜下,ASFV病毒颗粒的复制主要在巨噬细胞细胞质中(图6),也有部分病毒颗粒在淋巴细胞胞核中复制(图7a)。ASFV感染胃肝淋巴结后,淋巴细胞和巨噬细胞都出现显著的病理组织学变化,ASFV颗粒在淋巴细胞核内复制,破坏淋巴细胞的完整结构,核膜破裂,细胞核变形皱缩,核染色质边集或聚集成团,核中可见大量未成熟的ASFV颗粒(图7a)。病毒颗粒结构清晰完整,呈典型的正六边形,核呈致密圆形。巨噬细胞和淋巴细胞间,淋巴细胞和淋巴细胞间充满大量不成型的红细胞,溶血现象严重(图7b)。有些细胞发生凋亡,细胞核变形呈新月形和镰刀形(图7c)。被ASFV感染的淋巴细胞和巨噬细胞中含有大量线粒体,为ASFV复制提供能量,有的线粒体发生肿胀,完整双层膜结构被破坏,缺损严重(图8a),有些线粒体甚至出现空泡化的现象(图8b),有的靠近ASFV颗粒的线粒体膜消失,线粒体嵴模糊不清(图8c)。
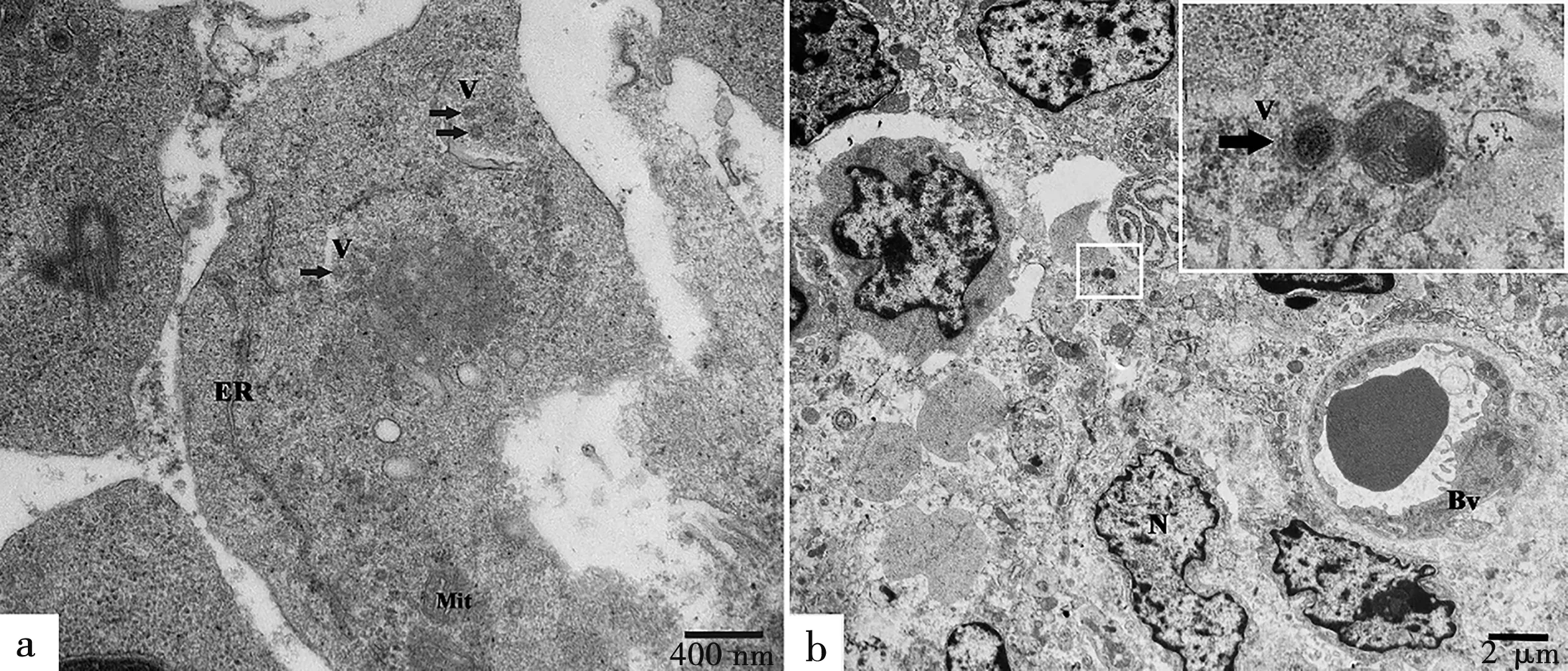
a.104HAD50剂量ASFV感染的巨噬细胞细胞质中含大量未成熟的病毒颗粒();b.103HAD50剂量ASFV感染的巨噬细胞细胞质中发现病毒颗粒()。V.ASFV颗粒;ER.内质网;Mit.线粒体;Bv.血管
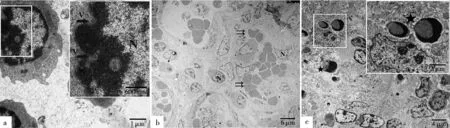
a.被ASFV感染的淋巴细胞胞核,核中可见未成熟ASFV颗粒();b.ASFV感染后细胞间出血严重,大量红细胞聚集发生细胞凋亡的细胞核,细胞核呈镰刀形或新月形(★)。V.ASFV颗粒;N.细胞核
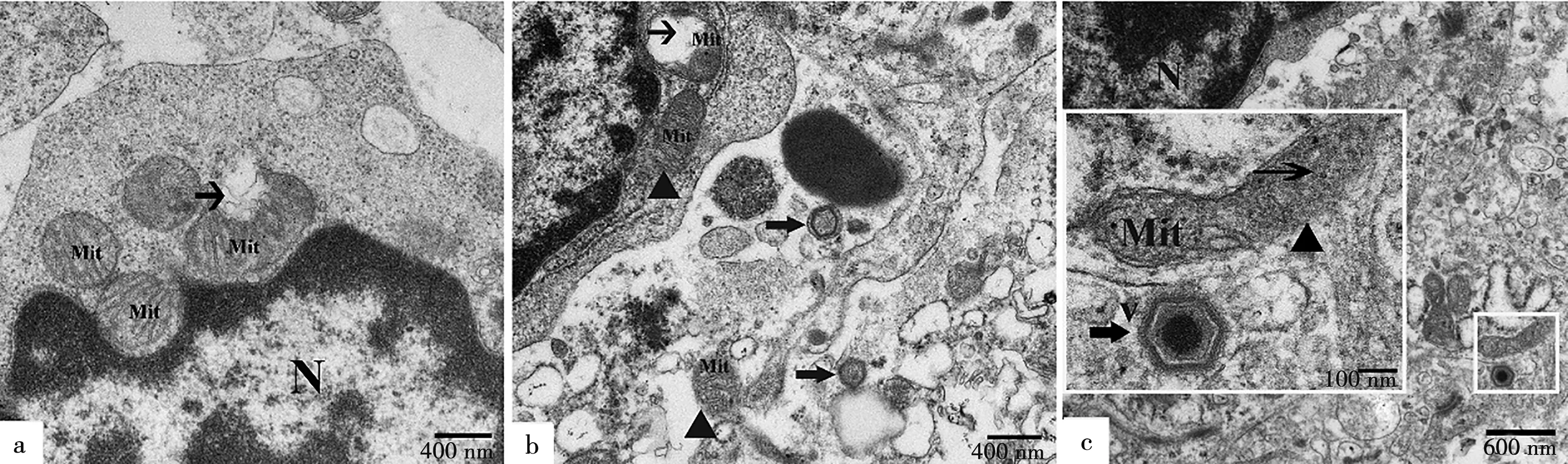
a.104HAD50剂量ASFV感染的淋巴细胞胞核,核中线粒体结构破坏();b.104HAD50剂量ASFV感染巨噬细胞中线粒体肿胀,发生空泡化(),线粒体膜溶解消失(),胞外可见空心ASFV颗粒();c.103HAD50剂量ASFV感染巨噬细胞中存在结构完整的ASFV颗粒(),ASFV周围线粒体的线粒体嵴不明显(→),膜溶解消失()。V.ASFV颗粒;Mit.线粒体;N.细胞核
3 讨论
本试验采用的毒株HLJ/18是由哈尔滨兽医研究所在暴发非洲猪瘟的猪原代肺泡巨噬细胞中所分离,该病毒基因型为II型,与东欧流行的ASFVs基因相近。研究表明HLJ/18接种猪在接种后9 d内死亡,接触猪在与接种猪接触后2周内死亡,在猪中毒性很强,属于高毒力毒株[8]。猪接种病毒后3~5 d均出现疾病症状,包括发烧(超过41 ℃)、食欲不振、嗜睡、皮肤发红、耳朵边缘和尾巴及腿末端发绀、呼吸困难和呕吐等,6~9 d内均死亡,表明攻毒建模成功。本研究用HE染色法、网状纤维染色法和透射电镜观察了ASFV感染猪胃肝淋巴结的病理组织学变化。胃肝淋巴结病理组织学变化明显,淤血、出血现象严重,且存在ASFV剂量的差异性。有文献报道,ASFV感染后淋巴结广泛性出血,其中胃、肝、肾、腹部淋巴结尤其肠系膜淋巴结受影响最大,下颌淋巴结、咽淋巴结、腹股沟淋巴结出血频率较低[5]。本研究发现猪淋巴结病理组织学变化以胃肝淋巴结变化显著,相较于其他淋巴结出血更明显。网状纤维由Ⅲ型胶原蛋白构成,纤维细小、分支多,交织成网,嗜银染色呈黑色。主要分布在结缔组织与其他组织交界处,在造血器官和内分泌腺中构成支架。猪胃肝淋巴结网状纤维主要密集分布在淋巴结髓质部、小梁处、血管壁和淋巴小结外周等处,在淋巴小结的生发中心处分布较少。本研究发现感染猪网状纤维变粗,纤维数量明显增加,且ASFV剂量增加,网状纤维数量增多,差异显著。可能是淋巴结在受到ASFV入侵后结构发生破坏,正常生理功能受到影响,为了减少ASFV对淋巴结组织造成的损伤,机体自身发生代偿性增生以维持正常生理功能。
电镜下发现大量未成熟ASFV颗粒存在于淋巴细胞和巨噬细胞核中,核皱缩和碎裂,正常结构被破坏。ASFV复制主要发生在细胞质中被称为“病毒工厂”的区域,但早期阶段是在细胞核中进行[9]。ASFV在核中复制早期阶段的作用目前尚不清楚,但却对细胞核有较大影响,包括几种核蛋白质的重新分布,以及RNA聚合酶Ⅱ的去磷酸化和随后的降解等[10]。也有文献报道在细胞核中合成的ASFV DNA小片段,可能是较大的细胞质序列的前体,以及全长成熟基因组的多联体中间体[9]。ASFV在核中进行早期复制,可能对ASFV之后在胞质中进一步加工有重要意义,为后续大量ASFV颗粒的合成提供数量保障,有利于ASFV感染。
ASFV感染后,电镜下可见组织细胞间充满大量红细胞,且红细胞破裂溶血,与HE染色结果一致。有研究提出假说:淋巴结毛细血管内缺少定植的巨噬细胞,使得感染激活毛细血管内皮细胞吞噬作用,血管内溶酶体大量增生,吞噬细胞碎片增加,导致血管内皮细胞过度增大,引起毛细血管腔阻塞,血管内压力增大,最终导致内皮细胞破裂,使得细胞碎片和红细胞暴露而引起出血[11]。
感染ASFV后有些细胞发生凋亡导致细胞核呈月牙形和镰刀形。ASFV大量的增殖会诱发感染细胞坏死、凋亡,随后大量ASFV游离于血液、淋巴、间质组织中,造成各组织器官的感染[12]。有文献认为,单核细胞-巨噬细胞的破坏被归因于凋亡[13]或坏死[14]。ASFV在淋巴细胞和巨噬细胞中复制,当ASFV数量达到一定水平后,ASFV主要通过对细胞核和线粒体产生破坏作用,使宿主细胞不能很好地接受细胞核“细胞代谢活动控制中心”的指令。线粒体损伤后对宿主细胞的能量供应也会受到影响,加上线粒体也参与细胞凋亡,ASFV诱导细胞凋亡等,使得宿主细胞不能正常发挥生理功能而裂解死亡,大量ASFV颗粒从细胞中释放出来有利于病毒的后续感染。

