纳米硒对氟化钠诱导小鼠肝组织细胞凋亡的影响
刘冰贤,曾绮雯,陈汉明,庞聪颖,刘莹炜,杨必婧,易江南,黎远亮,黎扬威,唐兆新,李 英,张 辉
(华南农业大学兽医学院,广州 510642)
氟是存在于人和动物体内的一种重要微量元素,主要分布于骨骼和牙齿[1]。长期接触暴露在空气、食物、水中的氟会导致氟中毒[1-2],引起氟斑牙和氟斑骨症[3],甚至肾、肝、肠、脑、肺的炎症和变性[4]。肝毒性是氟化物主要的毒性作用之一,可导致肝广泛的退行性病变,最终降低肝的解毒功能。Wang等[5]发现NaF诱导了线粒体损伤,体内活性氧(reactive oxygen species,ROS)急剧升高进一步促进了肝毒性和细胞损伤。
氧化应激(oxidative stress,OS)所致的氧化-抗氧化状态失衡,是氟化物诱导肝毒性的首要因素[6]。细胞氧化还原状态的异常失衡会产生过氧化物和自由基,进而导致细胞的蛋白质、脂质和核酸被破坏。氟化物可以直接干扰氧代谢,导致细胞活性氧增加。ROS蓄积导致线粒体中的细胞色素C(cytochrome C,Cytc)释放到细胞质,Cytc激活凋亡通路相关蛋白的表达[7-8]。
抗氧化系统的存在维持着ROS的平衡,谷胱甘肽过氧化物酶(GSH-Px)是体内重要的抗自由基的酶,保护生物膜免受氧化损伤[9-10],硒是GSH-Px的重要组成成分和活性中心,决定着该酶的活性,即清除自由基的能力。氟化物进入体内会抑制GSH-Px的活性,硒可通过纠正自由基平衡、脂质代谢紊乱以及抑制氟诱导的脂质过氧化,拮抗氟中毒引起的细胞损伤。纳米硒颗粒由于其独特的生物活性和低毒性,在不同的小鼠试验模型中被用作保护剂。但关于纳米硒减轻氟毒性作用的研究相对较少,其与自噬和凋亡相关的机制和生物学功能也有待进一步研究。因此,本研究旨在探讨肝细胞凋亡以及纳米硒对氟致肝细胞损伤的作用,以阐明硒抑制慢性氟中毒致肝细胞凋亡机制。
1 材料与方法
1.1 试验动物
本研究所使用的40只28日龄健康昆明小鼠(雌雄各半,25 g±2 g),由南方医科大学(广州)实验动物中心提供。
1.2 主要试剂与仪器
纳米硒(Nano-Se)购自上海Macklin生化有限公司(纯度≥99%,平均粒径40 nm)。氟化钠(NaF)(麦克林,上海,AR,99%)。小鼠单克隆抗体Active Caspase-3(RLM3431,睿瀛生物)、Cyt-C(382867,正能生物)和多克隆抗体GAPDH购自正能生物,2×ChamQ SYBR qPCR Master Mix和BCA蛋白检测试剂盒购自南京诺唯赞生物科技有限公司;PAGE凝胶快速制备试剂盒(12.5%)购自上海雅酶生物科技有限公司。
LightCycler480型荧光定量PCR仪,购自美国Bio-Rad公司;DM1000型光学显微镜,购自广州德真科学仪器有限公司。
1.3 试验设计与动物饲养管理
40只昆明小鼠适应性饲养7 d后,被随机分为4组(n=10),对照组(Control),氟化钠组(NaF),纳米硒组(Nano-Se),纳米硒治疗组(NaF+Nano-Se)。通过灌胃的方式每天每组分别给予24 mg·kg-1氟化钠,1 mg·kg-1纳米硒以及 24 mg·kg-1氟化钠和1 mg·kg-1纳米硒。此外,对照组小鼠灌胃等量的生理盐水。
动物试验在华南农业大学实验动物中心进行,动物房温度为23 ℃±2 ℃,相对湿度50%~60%,每天光照12 h。整个试验周期为28 d,期间所有小鼠均自由采食、饮水。每天记录小鼠的精神状态,精神沉郁、死亡等现象均判定为非正常现象。
1.4 病理切片
试验进行的第28天,将所有小鼠脱颈致死并取其肝。将一部分肝组织置于4%多聚甲醛中固定48 h,乙醇梯度脱水,石蜡包埋,切片,进行HE染色。37 ℃干燥12 h,苏木精/伊红染色,封片后在光镜下观察。其余肝样本-80 ℃保存,用于后续分析。
1.5 TUNEL染色检测肝细胞凋亡
石蜡切片用二甲苯和乙醇脱蜡,37 ℃下用蛋白酶K(20 μg·mL-1)消化15~30 min。37 ℃下用TdT和dUTP(1∶9)孵育1 h,PBS洗涤3次。DAPI(4’,6-二脒基-2-苯基吲哚)染色,荧光显微镜下观察。使用Image-Pro®Plus 6.0计算阳性细胞核的值。
1.6 RT-PCR检测凋亡相关基因表达水平
提取肝组织总RNA并测定其纯度与浓度,再根据PrimeScript®RT试剂盒说明将RNA反转录成cDNA,最后参考SYBR®PrimeScriptTMRT-PCR试剂盒说明测定凋亡相关基因mRNA表达量。引物序列见表1。

表1 引物序列Table 1 Reference sequences
1.7 Western blot检测凋亡相关蛋白表达水平
提取肝组织蛋白,BCA试剂盒测定总蛋白浓度,用SDS-PAGE(聚丙烯酰胺凝胶电泳) Loading Buffer将其稀释至同一浓度,并煮沸。SDS-PAGE电泳分离蛋白样品,转膜,5%脱脂奶粉封闭。一抗于4 ℃摇床孵育过夜,用TBST洗涤3次后,二抗孵育1 h,TBST洗净二抗,ECL显色。用Image J (National Institutes of Health,America)计算蛋白条带的灰度值。
1.8 免疫荧光
肝组织石蜡切片脱蜡至水,再将切片置于盛满柠檬酸抗原修复液的修复盒中,于微波炉内进行抗原修复。BSA封闭后,一抗4 ℃孵育过夜、二抗孵育1 h,DAPI避光孵育,PBS洗涤3次后,树脂封片,荧光显微镜观察。
1.9 数据分析
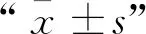
2 结 果
2.1 纳米硒改善氟化钠的毒性作用及其诱导的细胞凋亡
氟化钠处理7 d 后,小鼠临床表现为精神沉郁,食欲不佳,饮水量减少,不喜活动。纳米硒处理组小鼠精神状态良好,部分表现活跃。结果表明,纳米硒在一定程度上能改善氟化钠引起的临床症状。
如图1A所示,对照组和纳米硒组小鼠肝细胞排列紧密而整齐,无明显结构损伤。相比之下,氟化钠处理组小鼠肝细胞排列紊乱并且出现肿胀、颗粒变性、空泡变性,甚至核碎裂、溶解的现象。然而,经过纳米硒治疗后,氟化钠诱导的肝细胞凋亡现象有所改善。
如图1B、D所示,对照组和纳米硒组肝细胞未见明显凋亡,Tunel阳性细胞极少。相反,氟化钠处理组肝细胞凋亡明显增加。由图1C可知,氟化钠处理后小鼠肝细胞Tunel阳性比例显著高于对照组(P<0.01),而添加纳米硒后细胞凋亡率降低,并且可以看出纳米硒处理对氟化钠诱导的细胞凋亡有一定的缓解作用,两组之间具有差异显著性(P<0.05)。

A.小鼠肝组织病理切片(HE染色);B.TUNEL染色观察凋亡细胞(400×),使用Image Pro plus 6.0计算TUNEL阳性值,TUNEL阳性(绿色,见OSID开放科学数据与内容),DAPI核染色(蓝色,见OSID开放科学数据与内容);C.TUNEL阳性的百分比,对照组(Control),氟化钠组(NaF,纳米硒组(Nano-Se),纳米硒治疗组(NaF+Nano-Se),*.P ≤ 0.05,**.P ≤ 0.01;D.高倍镜下的凋亡细胞,40×A.Histopathological sections of mouse liver (HE staining);B.liver apoptosis was done by TUNEL assay(400×),TUNEL positive (green,see color pictures in open scientific data by scaning OSID code) and DAPI core staining (blue,see color pictures in open scientific data by scaning OSID code);C.Percentage of TUNEL positive calculated by Image Pro plus 6.0,*.P ≤ 0.05,**.P ≤ 0.01;D.Apoptotic cells under high magnification,40×图1 纳米硒改善氟化钠诱导的细胞凋亡Fig.1 Nano selenium improves sodium fluoride induced apoptosis
2.2 细胞凋亡线粒体途径的关键因子Cyt-C的表达
如图2A、B免疫染色显示,氟化钠组Cyt-C蛋白表达显著高于对照组和纳米硒处理组(P<0.01),且纳米硒治疗组抑制了Cyt-C表达的升高。此外,RT-qPCR和Western blot 结果显示,与对照组相比氟化钠组Cyt-C表达升高,而纳米硒治疗组肝细胞Cyt-C表达量低于氟化钠组(图2C、D)。
A、B.免疫荧光评估Cyt-C的表达量(400×);C.Western blot定量蛋白Cyt-C的表达量;D.RT-qPCR评估凋亡相关基因的转录情况A,B.Cyt-C expression evaluated by immunofluorescence was evaluated (400×);C.Cyt-C protein expression evaluated Western blot;D.Transcription of apoptosis-related genes evaluated by RT-qPCR图2 免疫荧光、Western blot及RT-qPCR方法评估Cyt-C的表达情况Fig.2 Cyt-C expression evaluated by immunofluorescence,Western blot and RT-qPCR
2.3 凋亡相关蛋白、基因的表达情况
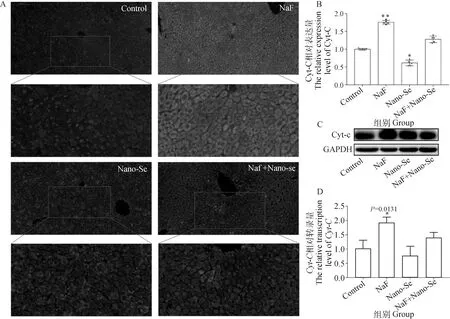
凋亡相关基因的表达情况如图3所示,与对照组相比,氟化钠处理组Caspase-3、Caspase-9以及P53基因的表达上调,但差异不显著(P>0.05),加入纳米硒治疗后,其表达量下降。如图4所示,P53蛋白和Caspase-3在氟化钠处理组中表达量较高,加入纳米硒治疗后其表达量减少。Bcl-2和Bax分别是Bcl-2家族中最主要的抑制凋亡和促凋亡蛋白,Bcl-2/Bax表达比例与凋亡发生发展密切相关。氟化钠处理组Bcl-2/Bax的表达水平较对照组下降,说明氟化钠可以诱导肝细胞凋亡的增加,而加入纳米硒治疗后,其比值有所回升。

图3 凋亡相关基因的相对转录水平Fig.3 Relative transcription levels of apoptosis-related genes
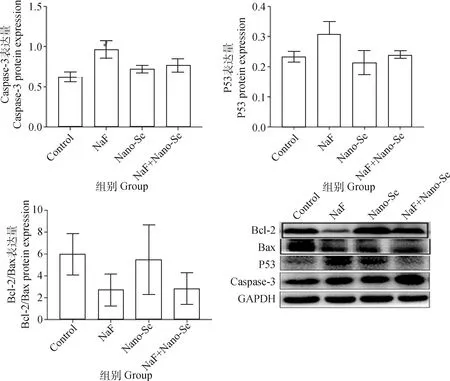
图4 凋亡相关蛋白的表达水平Fig.4 Expression levels of apoptosis-related proteins
3 讨 论
氟化物在自然环境中广泛存在,长期暴露于氟环境下会对机体产生一定的毒性作用,表现为慢性氟化骨症和氟化牙[11]以及非骨相器官的损伤[12],并可引起明显的肝病理损伤[13]并伴随细胞凋亡现象[14]。本研究结果表明,氟化钠处理1周后小鼠的精神状态明显下降,精神萎靡,不喜活动,而纳米硒则有效改善了小鼠的精神状态。同时,作者通过肝病理切片发现氟化钠处理小鼠的肝细胞排列紊乱,并出现肿胀、空泡变性,甚至核碎裂、溶解的现象,而纳米硒治疗能在一定程度上缓解氟化钠所致的肝损伤。为了进一步探究氟化钠的肝毒性作用,作者利用TUNEL染色评估肝细胞凋亡水平,发现氟化钠处理组小鼠肝细胞TUNEL阳性率相较于对照组显著升高(P<0.01),而添加纳米硒治疗后凋亡阳性率呈现下降趋势。
氟诱导的病理损伤机制与自由基水平升高有关,主要表现为自由基代谢紊乱、抗氧化能力下降和氧化应激水平升高[15]。氟不仅可以直接攻击氧,产生氧自由基,还可以攻击抗氧化酶,抑制其活性,增加氧自由基的含量,进一步导致脂质过氧化和细胞死亡[16-17]。线粒体是ROS产生的主要场所,也是氧化应激诱导损伤的重要靶点[18];ROS积累会导致线粒体呼吸链受损[19],主要表现为DNA损伤和ATP生成减少[20]。除此之外,线粒体功能的维持也取决于Bcl-2/Bax的比例,它在保持线粒体膜的完整性方面起着重要作用[21-22],调控线粒体外膜各种通道的开放程度,是细胞凋亡调控的中心[23]。作者发现氟化钠处理后Bcl-2/Bax的比值较对照组下降,这暗示凋亡的发生以及线粒体功能受损,线粒体膜的完整性遭到破坏,膜电位下降,线粒体外膜通透性改变使得Cyt-C释放至细胞质[24-25]。作者通过免疫荧光、Western blot以及RT-qPCR均检测到Cyt-C的表达水平显著升高。Cyt-C是细胞凋亡线粒体调控途径的关键因子,与细胞凋亡激活因子Apaf-1结合激活Caspase-9前体并激活Caspase-3引起级联反应最终发生细胞凋亡。从作者的研究结果来看,氟化钠处理后Caspase-9及Casepase-3基因的表达水平显著升高,Western blot结果也表明其蛋白水平也在氟化钠处理后上调。以上结果表明氟化钠诱导的肝损伤作用是通过线粒体途径调控肝细胞的凋亡实现。
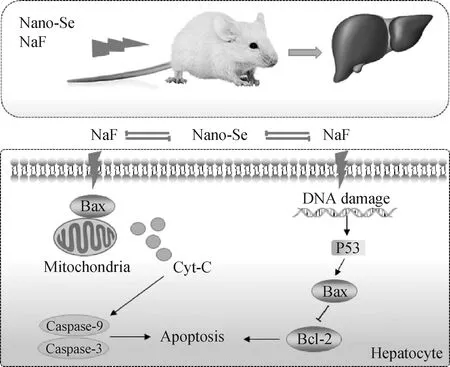
图5 纳米硒调控NaF诱导肝细胞凋亡模型Fig.5 Nano-selenium regulates NaF induced hepatocyte apoptosis model
硒是一种抗氧化剂,是谷胱甘肽过氧化物酶(GSH-PX)的重要组成部分,而纳米硒由于其独特的生物活性被广泛用于临床试验。硒可以缓解氟中毒引起的抗氧化能力下降并且通过清除氧自由基缓解氟暴露引起的细胞损伤[26]。氟中毒引起的肝损伤以抗氧化能力异常导致的肝细胞凋亡为特征,这可能是由于氟暴露增加了氧自由基水平,导致脂质过氧化,抗氧化酶的活性下降,促进肝细胞凋亡。
细胞凋亡和氧化途径是氟致肝、肾损伤的重要细胞分子机制。硒缓解氟诱导的细胞损伤与其抗氧化能力密切相关[5,27-28]。作者发现,纳米硒处理提高了肝细胞的抗氧化能力,减轻氟诱导的氧化应激,抑制细胞凋亡信号通路转导以及调控凋亡相关基因的表达,如Caspase-3、Caspase-9等,减轻了细胞凋亡的程度。此外,作者比较Cyt-C在不同处理组的表达情况发现纳米硒处理组小鼠Cyt-C的表达水平下降,且凋亡通路相关蛋白的表达也呈下降趋势。因此,推测纳米硒通过调控线粒体凋亡途径关键因子Cyt-C来调节细胞凋亡进程从而保护肝细胞免受氟化钠诱导的细胞损伤。硒通过促进氟化物的去除、修复脂质过氧化和增强自氧化作用来诱发氟中毒的拮抗作用[5]。特别是硒对氟化物产生抗氧化作用,减轻氟化物对肝的毒性作用,以此来抑制细胞凋亡[29]。
4 结 论
氟化钠通过调控线粒体途径诱导细胞凋亡所致的小鼠肝细胞损伤,1 mg·kg-1纳米硒则通过调控Cyt-C缓解细胞凋亡进程,减轻氟化钠的毒性作用,提示线粒体途径可能是纳米硒对氟中毒干预作用的方式之一。

