2种方法收集3种豆科植物挥发物的成分分析
白泽珍,杨美红,赵祥
(1.山西农业大学化学生态研究所,山西 太谷 030801;2.山西农业大学草业学院,山西 太谷 030801)
植物挥发性物质是植物在不同的生长发育时期,由表面或器官内部贮存点散发出来的化学物质。它的相对分子量一般在100~200,沸点低于340℃,主要包括醇类、醛类、酮类、酯类、有机酸类、萜烯类和芳香族类化合物等,并以一定的比例组成不同植物种的化学指纹图[1-3]。近年来,随着对植物挥发物研究的深入,人们发现它们在生态系统中的作用越来越突出,已经引起了极大的关注[4-5],例如研究证明植食性昆虫都可以通过感受植物挥发物来寻找和选择寄主植物,植物则通过释放挥发物来干扰害虫定位和抵御昆虫取食[6]。目前,国内外已报道了多种豆科植物的挥发性成分[7-9],刘健等[10]借助固相微萃取和气质联用技术,对健康、蚜虫为害和机械损伤的大豆(Glycinemax)的挥发物进行了提取和组分分析,共检测出31种挥发性化学物质;李存满等[11]采用水蒸气蒸馏法提取得到了紫花苜蓿(Medicagosativa)挥发油的43种挥发物,并找到5种主要化学成分;郭淑政等[12]采用炭阱吸附装置对利马豆(Phaseoluslunatus)的挥发物进行了收集,并采用内标法对其挥发性有机物进行了初步的定量。但目前尚未见对扁蓿豆(Medicagoruthenica)、黑豆(black soybean)、野大豆(Glycinesoja)的挥发物成分及其相对含量的相关研究报道。因此,本研究以上述3种豆科植物为试材,采用目前最常用的动态顶空吸附法(dynamic headspace adsorption,DHA)和固相微萃取法(solid-phase microextraction,SPME),对这3种植物挥发物进行收集,并利用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术进行挥发物的鉴定,对比分析不同收集方法对相同植物挥发物种类和相对含量的影响,探索豆科植物挥发物的化学组成,进而筛选豆科植物中引诱昆虫的活性物质,为进一步开发豆科植物防治害虫的植物源引诱剂提供理论依据。
1 材料和方法
1.1 供试植物
供试的扁蓿豆采自山西农业大学草业学院试验田,黑豆和野大豆采自山西农业大学农学院实验站。
1.2 仪器设备
试验所用仪器设备有大气采样仪(KDY-1.5A,盐城市科源电子仪器有限公司);吸附管(一端尖口的玻璃吸附管,外径0.8 cm,内径0.6 cm,长14.7 cm);热风筒(BKL-4160,贝克洛1600 W数显);气体流量计(LZM-6T,广州永城机电设备);气相色谱-质谱联用仪(Thermo Scientific TRACE 1300-TRACE ISQ);全自动固相微萃取装置(85 μm聚丙烯酸酯PA固相微萃取萃取头,美国Supelco公司);美国烤鸡袋(Oven Bags,482 mm×596 mm);Porapak Q 80-100目吸附剂(美国Waters公司);聚四氟乙烯管(50 mm× 80 mm);硅胶连接管(65 mm× 80 mm)。
1.3 挥发物的采集方法
1.3.1 动态顶空吸附法 于2019年7月10-25日,选择晴朗无风的天气,对扁蓿豆、黑豆和野大豆3种豆科植物根部以上茎叶进行挥发物采集。采样时间统一在8∶00~12∶00,以避免环境日变化引起的干扰。每种植物都随机采集3次作为平行样,以采样袋内不套入植物做对照。
试验前首先对吸附剂和硅胶进行活化[13],然后在试验大田中使用自制的动态循环吸附装置,按大气采样仪(出气口)→硅胶→活性炭→套袋植物→吸附管→气体流量计→大气采样仪(进气口)的顺序用无味的聚四氟乙烯管和硅胶连接管连成密闭系统[14]。具体试验步骤为:(1)抽气:选取长势良好的植株用美国烤鸡袋罩住并绑紧,在短时间内使用大气采样仪将袋内空气抽出;(2)充气:经过硅胶和活性炭双重过滤的洁净空气充入袋中(大气采样仪泵入气体流量为1 L/min),待收集袋中充满干净空气后,保持30 min;(3)采气:在袋的另一端按装置连接顺序连接吸附管和大气采样仪(大气采样仪泵出气体流量为500 mL/min),开始循环采样。4 h后拔出吸附管,使用3 mL色谱级正己烷洗脱至2 mL棕色进样瓶中(为减少样品成分的损失,洗脱时间控制在2 min),氮气吹扫浓缩至0.5 mL,密封保存于4℃冰箱备用[15]。
1.3.2 固相微萃取法 分别选择长势良好的3种植物采集株,蒸馏水冲洗干净后用大滤纸吸干水分并剪碎,分别称取各植物样品2 g放入20 mL顶空进样瓶中,然后置于GC-MS联用仪中进行分析,各植物均在相同条件下进行3次重复测定[16]。
1.3.3 挥发物成分的鉴定 用GC-MS对上述收集到的植物挥发物进行分析和鉴定。GC条件:毛细管柱为TG-5MS(30 m×0.25 mm×0.25 μm,5% Phenyl Methylpolysiloxane);进样口温度250℃;程序升温:开始温度40℃保持3 min,以6℃/min增温至160℃保持1 min,再以20℃/min的速率升至250℃,保持5 min。载气:高纯氮气,流速1.0 mL/min;不分流进样,进样量为1 μL。MS条件:传输线温度280℃,四级杆温度150℃,离子源温度280℃,;电离方式为EI;离子化能量70 eV;数据获得通过全扫描,扫描范围45~550 amu。化合物鉴定通过NIST 2.0质谱库自动检索分析组分的质谱数据,兼顾色谱保留时间并参考标准图谱对全部检索结果进行核对补充;定量分析采用峰面积归一化法确定各成分的相对含量。
单一组分百分含量(%)=(单一组分的峰面积/挥发物总面积)×100%
1.4 数据分析
采用Excel 2010和统计软件SPSS 20.0进行分析,用单因素ANOVA检验,并用Duncan氏多重比较分析差异显著性,使用Origin 8.5进行绘图。
2 结果与分析
2.1 3种豆科植物挥发物成分及相对含量
利用GC-MS对2种方法(DHA和SPME法)收集的扁蓿豆、黑豆、野大豆3种豆科植物挥发物成分进行分析,并获得相应的色谱图(图1)。扣除本底空气杂质、乙醇及其他干扰成分。因动态顶空吸附法采用溶剂洗脱后液体进样,故扣除保留时间位于前3 min以溶剂为主的干扰成分。工作站数据处理系统对数据进行面积归一化法处理,确定3种植物挥发物的化合物成分及其相对百分含量。
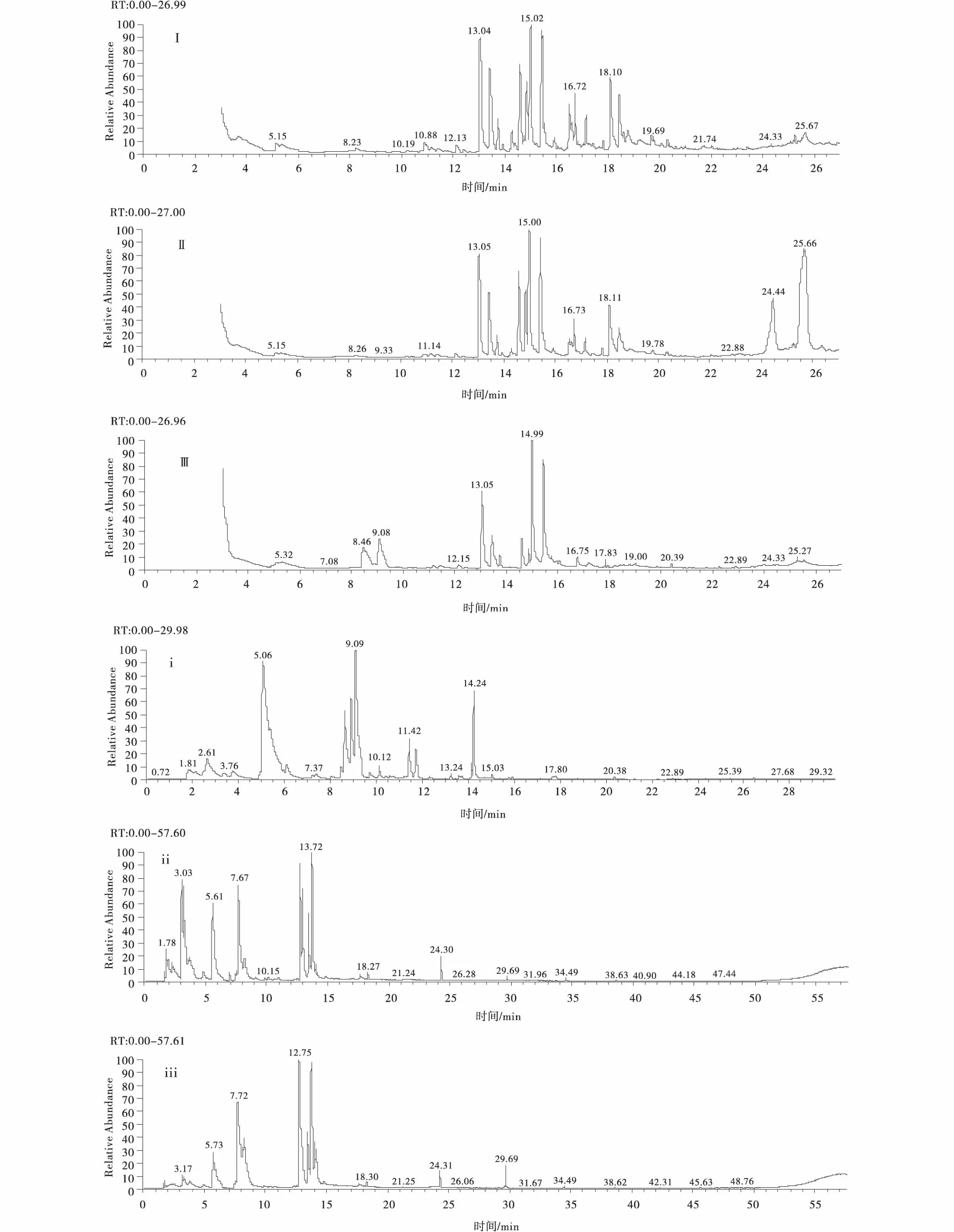
图1 3种豆科植物挥发物成分总离子流色谱Fig.1 TIC of VOCs from three legume species注:Ⅰ、ⅰ :扁蓿豆; Ⅱ、 ⅱ :黑豆; Ⅲ、 ⅲ :野大豆;Ⅰ、Ⅱ、Ⅲ:动态顶空吸附法;ⅰ、ⅱ、ⅲ:固相微萃取法,下同
2.1.1 动态顶空吸附法(DHA)收集的挥发物成分分析 经GC-MS分析,DHA法收集的3种豆科植物挥发物共有45种,其中,扁蓿豆33种,黑豆18种,野大豆16种(表1)。扁蓿豆中主要成分为3,4-二甲基苯乙酮(19.17%)、4-乙基苯甲醛(18.61%)、4-异丙基苯甲醇(9.55%)等;黑豆中主要成分为四十四烷(25.84%)、3,4-二甲基苯乙酮(22.14%)、4-乙基苯甲醛(13.96%)等;野大豆中主要成分为3,4-二甲基苯乙酮(40.54%)、4-乙基苯甲醛(19.84%)、1-辛烯-3-醇(7.63%)等。DHA法收集到3种豆科植物的6种共有组分为:4-乙基苯甲醛、乙酸叶醇酯、4-异丙基苯甲醇、3,4-二甲基苯乙酮、4-乙基苯丙酮和1,4-二乙酰苯。
2.1.2 固相微萃取法收集的挥发物成分及相对含量 经GC-MS分析,SPME法收集的3种豆科植物挥发物共有44种,其中,扁蓿豆24种,黑豆24种,野大豆22种(表2)。扁蓿豆中主要成分为叶醇(22.77%)、乙酸叶醇酯(15.48%)、2-乙基己醇(14.60%)等;野大豆中主要成分为1-辛烯-3-醇(21.28%)、乙酸叶醇酯(17.77%)、2-已烯醛(13.35%)等。SPME法收集到3种豆科植物的6种共有组分,其在各植物中均有较高含量,分别为1-辛烯-3-醇、3-辛酮、辛醇、芳樟醇、4-乙基苯甲醛和乙酸叶醇酯。

表2 固相微萃取法收集的3种豆科植物挥发物成分及相对含量
2.1.3 2种方法收集的3种植物挥发物成分比较 用2种方法收集3种豆科植物挥发物,每种植物中均存在相同成分(表3)。其中,2种方法收集的扁蓿豆挥发物中包括6种相同成分;黑豆挥发物中包括3种相同成分;野大豆挥发物中包括4种相同成分。用DHA和SPME法收集的3种豆科植物挥发物中均检测到乙酸叶醇酯和4-乙基苯甲醛这2种化合物。在3种植物中,采用DHA法收集的4-乙基苯甲醛相对含量均高于SPME法的收集结果。
2.2 2种方法收集的3种植物挥发物种类
在扁蓿豆中,2种方法收集的挥发物主要包括醇类12种、醛类6种、酸类1种、酯类5种、酮类6种、萜类3种、烃类17种。其中,DHA法收集的挥发物中酮类挥发物相对含量最高(25.41%),其次为醛类(20.10%)和醇类(19.20%);SPME法收集的挥发物中醇类相对含量极高,占总相对含量的54.96%,酯类次之(18.56%),酮类挥发物的相对含量(9.36%)约为酯类的1/2。DHA法收集的扁蓿豆挥发物中不存在任何酸类物质,SPME法收集结果中有1种酸类化合物,且含量最少,仅占总相对含量的0.29%。
在黑豆中,2种方法收集的挥发物主要包括醇类13种、醛类8种、酸类1种、酯类4种、酮类6种、萜类1种、烃类6种。其中,DHA法收集的黑豆挥发物中没有酸类和萜类物质,烃类相对含量最高(31.24%),其次为醛类(30.00%)和酮类(27.15%)。SPME法的收集结果中相对含量较高的两类物质为醇类(34.80%)和醛类(23.67%),其余5类物质相对含量较低。

表3 2种方法收集的扁蓿豆、黑豆和野大豆的共有成分
在野大豆中,2种方法收集的挥发物包括醇类12种、醛类4种、酸类2种、酯类3种、酮类3种、萜类1种、烃类9种。其中,DHA法收集的野大豆挥发物中,酮类物质(42.97%)相对含量最高,醇类(20.34%)和醛类(20.28%)次之,该方法未收集到酸类和萜类成分。在SPME法收集结果中,野大豆醇类挥发物(35.47%)含量最高,其次为酯类(25.97%)和醛类(21.50%);酮类物质含量较少,仅占2.04%。该方法收集到2种酸类(0.92%)和1种萜类(0.12%)化合物,但是含量均不足1%。
综合分析,扁蓿豆挥发物的主要成分为酮类和醇类物质,黑豆挥发物的主要成分为醛类物质,野大豆挥发物以醇类和醛类为主要成分(图2)。

图2 DHA 和SPME法收集3种豆科植物挥发物的相对含量Fig.2 Relative content of VOCs in three legume species by DHA and SPME
3 讨论
植物种类、年龄、生理状态、空间分布、季节、温度、湿度、光照,以及生物胁迫(昆虫、致病菌等)都可影响植物挥发物的组成[17],且不同的挥发物收集方法也会影响试验结果。本研究通过动态顶空吸附法和固相微萃取法收集扁蓿豆、黑豆、野大豆3种豆科植物的挥发物成分,分别检测出扁蓿豆挥发物51种(DHA法:33种,SPME法:24种,有6种相同化合物);黑豆挥发物39种(DHA法:18种,SPME法:24种,有3种相同化合物);野大豆挥发物34种(DHA法:16种,SPME法:24种,有4种相同化合物)。其中,仅乙酸叶醇酯和4-乙基苯甲醛为3种豆科植物的共有化合物,使用2种方法均可在3种豆科植物中检测到。张静静等[16]采用固相微萃取法对豆科牧草紫花苜蓿不同部位进行挥发物收集,乙酸叶醇酯为其叶、茎、花三个部位挥发物中的一种共有化合物;4-乙基苯甲醛仅存在于紫花苜蓿叶片挥发物中,与本试验结果基本相符。王蕾等[15]采用动态顶空吸附收集法对5种豆科植物挥发物进行收集,鉴定结果中均有乙酸叶醇酯的存在,与本试验结果一致。乙酸叶醇酯极可能为豆科植物中的一种特征组分,4-乙基苯甲醛是否为豆科植物的特征组分则有待进一步研究。
朱玉永[7]通过动态顶空吸附法收集蚕豆健康和受蚜虫害植株的挥发性成分,鉴定出健康和虫害后的22种挥发物主要有醛类、醇类和酯类等化合物;张静静等[16]采用固相微萃取法收集分析紫花苜蓿不同部位(茎、叶片、花)的挥发性成分,挥发物都以醇、酮、酯类化合物为主。本研究用这2种方法收集的3种豆科植物挥发物主要以醇类、醛类和酮类化合物为主,与二者的研究结果基本一致。本研究还发现,动态顶空吸附法收集的3种豆科植物挥发物以酮类为主,而固相微萃取法收集的酮类物质含量却相对较少,其挥发物主要为醇类物质。魏明等[18]使用固相微萃取法萃取豇豆与菜豆的刺孔叶片,结果同样以醇类物质为主,这可能与固相微萃取法对不同挥发物的萃取能力及其萃取纤维头的性质有关,萃取纤维的极性和膜厚度决定了能够萃取到的挥发物的种类[19],本试验中选用85 μm聚丙烯酸酯(PA)固相微萃取萃取头,极性较大,因此萃取结果以醇类为主。要想全面了解植物挥发物的种类、组成和比例,还需要用多种萃取头对目标植物进行分析。
植物挥发物的组成和含量的分析检测会受到植物的生长条件、收集手段及检测方法等多种因素的影响,其中不同的收集方法对不同挥发物的捕集效率不同,因而对检测结果影响较大[20]。固相微萃取法几乎克服了以往传统样品处理技术的所有缺点,集采样、萃取、浓缩和进样于一体,不使用溶剂,避免了溶剂对样品的污染;但是不同的萃取头对所需平衡萃取时间、分析速度及分析结果存在差异[21];且进样前对植物进行剪切处理,机械损伤已然造成了植物挥发物成分的改变,并不能完全准确反映自然状态下的植物挥发物组分,且一次采样只能进行一次分析[22-23]。动态顶空吸附法具备活体植株取样、操作便捷、对色谱柱的伤害较小等优点[24],但是该法使用有机溶剂洗脱环节增加了样品污染的危险性,导致空白值增高,溶剂峰常常掩盖保留时间短的痕量组分形成干扰[25]。为了更好地解析豆科植物挥发物成分并更准确地筛选对昆虫具有引诱作用的活性组分,还需结合多种采集方法,并进行昆虫对豆科寄主植物的电生理和生物行为试验,以确定昆虫识别豆科寄主植物的信号物质。
4 结论
采用2种动态顶空吸附法和固相微萃取法(目前广泛使用的收集方法)收集扁蓿豆、黑豆和野大豆3种豆科植物的挥发性成分,结合气质联用技术对其进行分析。结果发现,2种收集方法得到的组分有差异,但种类相似,初步确定3种豆科植物的挥发物主要以醇类、醛类和酮类为主,酸类和萜类化合物种类和相对含量极少;豆科植物重要特征组分为乙酸叶醇酯。动态顶空吸附法收集的挥发物以酯类为主,固相微萃取法的收集结果以醇类物质为主。动态顶空吸附法能够反映近自然状态下植物挥发物的变化情况,适宜收集活体植株挥发性成分。

