从真题看高考对守恒定律的考查——以2020年高考试题为例
宁夏
(作者单位:宁夏六盘山高级中学)
守恒原理是化学反应发生的基础,也是化学变化必须遵循的重要原理之一。化学反应中的守恒关系包括质量守恒、能量守恒、得失电子守恒、电荷守恒、物料守恒、质子守恒等。从物质变化的表象中梳理化学反应中的守恒关系既是对学生分析问题和解决问题能力的考查,更是对学生化学学科核心素养水平的考查。纵观历年高考真题,对守恒关系的考查往往伴随着离子反应、氧化还原反应、原电池和电解池、化学方程式(或离子方程式)书写、弱电解质的电离、盐类的水解、物质的量计算等,就上述考查内容自身而言,已是中学化学中的重难点,又在其中融入守恒定律的考查,其综合性增强,难度增大。鉴于守恒定律的考查能准确、客观地反映学生的化学素养水平,因此,该类试题备受命题者青睐。
一、守恒定律在2020年高考题中的考查形式

表1 2020年高考题中守恒定律知识点的考查汇总

续表
由表1可知,2020年高考对守恒定律的考查有如下特点:
1.高考试题对守恒关系的考查不是单一的,而是交叉综合考查多种守恒关系。如氧化还原反应类型的离子方程式书写,包括得失电子守恒和电荷守恒两种关系。电解质溶液的考查往往涉及电荷守恒、物料守恒和质子守恒。这就要求考生对物质变化的认识更加立体、全面,避免只从单一守恒角度看待问题。
2.特定的守恒关系用于特定的考查点。物质的量的计算考查质量守恒,离子反应方程式书写主要考查电荷守恒。原电池和电解池工作原理分析主要考查得失电子守恒。电解质溶液则主要考查电荷守恒、物料守恒和质子守恒。
3.得失电子守恒的考查频次最多,集中在化学方程式书写、电化学装置分析和物质的量计算等题型中。
二、2020年守恒定律的考查与“四层四翼”的关系


三、典型例题及解析

其中元素X、Y的最外层电子数之和为8。下列叙述正确的是
( )

B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
【答案】B

【例2】(2020·全国卷Ⅱ·26节选)化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为________________________。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为________mol。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是________________________(用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1 000 kg该溶液需消耗氯气的质量为________kg(保留整数)。

(4)1.25


(4)题目考查质量守恒关系和得失电子守恒关系。NaClO2转变为ClO2为氧化过程,根据质量守恒关系可知,每生成1 mol ClO2,需要消耗1 mol NaClO2,同时根据得失电子守恒关系知该过程转移1 mol电子。物质和电子转化关系可表示为NaClO2~ClO2~1e-。由歧化反应的定义可知,NaClO2还会发生所含氯元素化合价降低的还原反应,同样按照质量守恒关系和得失电子守恒关系知,NaClO2发生还原反应对应产物为NaCl,且每生成1 mol NaCl需要NaClO2的物质的量为1 mol,转移电子的物质的量为4 mol。物质和电子转化关系可表示为NaClO2~NaCl~4e-。根据氧化反应和还原反应得失电子数相同,得到关系式5NaClO2~4ClO2~4e-,即每生成1 mol ClO2需要NaClO2的物质的量为1.25 mol。

【例3】(2020·全国卷Ⅰ·12)科学家近年发明了一种新型Zn-CO2水介质电池。电池示意图如图1所示,电极为金属锌和选择性催化材料。放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。

图1
下列说法错误的是
( )
B.放电时,1 mol CO2转化为HCOOH,转移的电子数为2 mol
D.充电时,正极溶液中OH-浓度升高
【答案】D
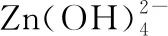
【例4】(2020·浙江七月选考·23)常温下,用0.1 mol·L-1氨水滴定10 mL浓度均为0.1 mol·L-1的HCl和CH3COOH的混合液,下列说法不正确的是
( )
A.在氨水滴定前,HCl和CH3COOH的混合液中c(Cl-)>c(CH3COO-)
C.当滴入氨水20 mL时,c(CH3COOH)+c(H+)=c(NH3·H2O)+c(OH-)
【答案】D

四、总结


