根际促生菌的生防机理及用作生防制剂的潜能
姬彦飞,董欣欣,田 野,张 杰,杨洪一
(东北林业大学生命科学学院/东北盐碱植被恢复与重建教育部重点实验室,哈尔滨 150040)
0 引言
植物根际促生菌(Plant Growth Promoting Rhizobacteria,PGPR)是指存在于植物根际土壤中的一些可以经由各种机制来促进植物生长、提高植株生活力、提高植物对于病害或环境胁迫的抵抗能力的天然土壤细菌[1]。PGPR已被证实可以通过调节植物代谢、改善根际营养环境、降解土壤污染物等多种途径促进植物生长,提高植物在不利环境条件下的生活力,并已作为微生物肥料而在农业生产中加以应用。除已被证实的促生长能力外[2],一些PGPR在实际生产与相关研究中展现出了广泛的拮抗病原菌的能力,这种能力使其具有抑制病原菌生长、防治植物病害的潜在可能。
植物病害的发生已成为影响农林业发展的一个重要难题[3],因而不断探索新的防治手段就变得尤为重要。植物病害大多为侵染性微生物(真菌、细菌等)通过植株表面伤口或其他部位进入植物组织中,经由侵染微生物的生命活动或分泌毒素对植物生长发育或代谢过程造成不利影响,甚至造成植株死亡[4]。利用PGPR对植物病原菌的拮抗活性,可以借由PGPR的生长来对植物病原菌的侵染加以限制或阻滞,从而可以在促进植物生长的同时,提高植物的抗病性能,减少植物病害的发病率或病害严重程度,从而对农林业生产提供助益。
与传统化学药剂防治相比,这种利用特定生物的活动或分泌产物而对另一生物种群的生长产生抑制或杀灭作用的生物防治(biological control,biocontrol)方法具有诸多优良特性,如具有作用范围的广谱性、持效时间的长效性、不易产生抗药性的稳定性、对生态环境的安全性等特点[5],因而具有十分广泛的应用前景。且PGPR还具备一定的促生长机能,能在发挥生物防治性能之余对植物的生长产生促进,这不仅可以提高植物的产量,对于染病植株的恢复也尤为重要。
1 PGPR的生防机理
PGPR的生物防治活性依赖于其在植物根际的稳定定殖,并经由特定生防活性物质的产生,及对植物系统抗性的诱导来加以实现。
1.1 PGPR在植物根际的定殖是生防作用发挥的基础
植物根际是植物从外界获取营养的重要部位,根际土壤中的微生物数量与类群对植物的生长有着极为重要的作用[6]。植物病原菌在根际土壤的大量存在往往导致病害侵染的出现,而PGPR的稳定定殖则可带来植物生长参数与生长活性的显著提升[7]。PGPR生物防治活性的发挥也高度依赖其在植物根际土壤的稳定定殖。
植物根际土壤营养极其丰富,因而植物根际也是微生物种类与数量极为繁多的区域。对根际营养物质及生态位的竞争是PGPR保护植物免受病原菌侵染的基本机制[8]。除PGPR自身的运动能力外,对植物特定产物的趋化作用也是PGPR定殖的一个关键因素。氨基酸及特定糖类都是引起PGPR趋化的常见化学诱导剂[9]。PGPR的趋化作用经由趋化受体蛋白(Methylaccepting Chemotaxis Proteins,MCP)对特定化学诱导剂的识别而产生。经由这一途径,一些利于植物生长的菌种被迅速、大量地富集在植物根际,植物根部通过分泌有机物供给PGPR生存并利用这些PGPR的活动来对植物的生长加以促进,从而形成一个共生系统[10]。植物分泌趋化物质的特异性与PGPR对特定趋化物质的选择性皆由遗传因素决定[11],这表明植物往往只能对特定的PGPR产生吸引,同时也意味着可利用多种趋化物质的PGPR更容易在多种植物的根际稳定定殖[12]。除普遍的趋化作用外,特定PGPR表面的特殊结构如胞外基质、表面多糖、菌毛等也与其根际定植能力息息相关[13]。
PGPR通过根际趋化在植物根表大量聚集,随后形成生物膜并实现稳定定殖[14]。这一过程的实现是PGPR产生生防作用的重要基础。通过PGPR在根际的稳定定殖与特定生理活性物质在根际圈的积累,土壤病原菌被隔离在植物根际圈之外,PGPR的生防活性得以产生,从而可在根际生态位进行防御性保持,这对于植物的抗病能力至关重要(图1)。

图1 PGPR在植物根际的定殖
1.2 生防活性物质的产生是PGPR生防性能的重要来源
除根际定殖所带来的生态位占据及营养物质竞争外,PGPR所分泌产生的一些特定活性物质也可对病原菌的生长产生抑制,从而减少病原菌在根际土壤的聚集,或对已存在的植物病原菌起到杀灭作用。PGPR可分泌产生的生防活性物质有铁载体、降解酶类、抑菌物质、解毒因子等多种类型。
1.2.1 铁载体 土壤中许多营养物质溶解度极低,如铁元素即以溶解度极低的氧化物形式存在。对于PGPR与植物病原菌而言,铁元素都是其生长所不可或缺的微量元素。许多PGPR可产生一种称为铁载体(Siderophore)的小分子有机物,并经由这种物质鳌合土壤中溶解的铁离子Fe3+加以吸收。不同菌种产生的铁载体成分不同,大体分为羧酸型、异羟肟酸型、儿茶酚盐型等3种[15]。
由PGPR产生的铁载体可以有效限制土壤中可溶性铁的供应,导致土壤中的病原菌产生铁缺乏,从而停止生长甚而死亡。有研究指出细菌所产生铁载体对Fe3+的亲和力要高于真菌铁载体,这表明主要为真菌的植物病原菌难以在铁供给上与PGPR产生有效竞争,此外,许多PGPR被证实具有利用异源铁载体的能力,这一能力更是加剧了PGPR对土壤铁供给的限制能力[16]。铁元素对微生物细胞结构极为重要。铁载体所造成的病原菌铁缺乏还会引发麦角甾醇合成途径受阻,而麦角甾醇是真菌细胞膜的重要组成成分[17]。因而PGPR可经由铁载体的分泌来抑制病原菌细胞的膜合成,并由此造成其膜功能异常,引起物质渗漏,甚而导致病原菌死亡[18]。此外,铁载体在特定条件下对于其他金属离子也具有螯合作用,因此对病原菌还可形成其他微量元素的争夺[19]。
PGPR对土壤微量元素的争夺可以极大减少病原菌所能获得的营养供给,从而减轻土壤病原菌对植物的威胁作用,降低植物病害的发病率,对农业生产产生积极作用。
1.2.2 降解酶类 PGPR还可在生长过程中产生各种降解酶类,这些酶类可以对病原菌的生理结构与生理机能造成损伤与破坏,从而对其侵染能力产生限制,甚至造成病原菌菌体死亡。
解淀粉芽孢杆菌Bacillusamyloliquefaciens可在其生长过程中产生葡聚糖酶与蛋白酶,而葡聚糖与蛋白质正是某些侵染性真菌细胞壁的主要成分。土壤中解淀粉芽孢杆菌的活动可对尖孢镰刀菌Fusarium oxysporum、胶孢炭疽菌Colletotrichumgloeosporioides等病原菌的生长产生抑制,甚至是杀灭作用,从而对某些植物土传病害起到有效防控的作用[20]。
PGPR还展现出了寄生活性,可以在侵染植物的真菌菌丝上生长,并经由分泌胞壁水解酶对菌丝结构造成破坏。李梦婕等[21]在其研究中发现了石楠锈孢锈菌Aecidiumpourthiaea上的重寄生现象,这些重寄生菌的活动破坏了侵染真菌的孢子产生机制与菌丝结构,对于植物锈病的防控有着积极的意义。Dutta[22]通过构建转座子文库对荧光假单胞菌Pseudomonas fluorescens的抗灰霉活性进行了研究,认为几丁质结合蛋白(chitin-binding protein)等物质的合成可能是其生物防治能力的关键。胡小加等[23]利用实时荧光定量PCR技术分析了菌核病病原菌核盘菌Sclerotinia sclerotiorum拮抗菌的生防机制,发现该过程中伴随着一些特定蛋白的产生,这些特定蛋白与核盘菌菌丝结构的破坏有关。菌核病是一种较难进行化学防治的植物侵染性真菌病害,而利用PGPR进行生物防治可对该病害起到较好的效果。
1.2.3 抑菌物质 一些抑菌性化学物质的产生也是PGPR生防机制的重要一环。如假单胞菌属PGPR,被证实具有广谱的生防活性[24],其生防活性的发挥与生长过程中CN-的分泌有很大关联[25]。除氰化物的产生外,PGPR还可产生一些特定的代谢物,这些物质的分泌可以对病原菌的生长与侵染造成阻滞与抑制,从而在一定程度上避免植物病害对植株生长所造成的不利影响。
挥发性有机物(Volatile Organic Compounds,VOCs)是一类被广泛证实的抑菌物质。许多PGPR均具有产生醛类、醇类、酯类、羧酸类、酮类、吡嗪类等VOCs的能力[26]。VOCs易于扩散进入病原菌细胞,并对病原菌细胞的菌丝结构与细胞形态造成损伤,使得病原菌出现细胞肿胀、空泡沉积、结构损伤等异常改变,从而显著降低其生活力与致病力[27]。VOCs的抑菌作用主要表现在其对病原菌菌丝及分生孢子膜结构的破坏,在该作用下,膜通透性发生变化,引起胞质溶出,并最终导致细胞的死亡。此外VOCs也被证实可在胞内引发活性氧等自由基的产生,从而对病原菌造成进一步损伤[28]。胞内活性氧的产生不仅会对细胞膜造成氧化损伤,还会对核内DNA分子及相关蛋白造成不可逆破坏[29]。此外,VOCs还可对植物根系发育与植株生长产生促进,这有利于植株抗病力的提高与染病后的恢复[30]。
除挥发性有机物外,一些PGPR还可在生长过程中产生一些特定的抗真菌代谢物如脂肽(Lipopeptides)、聚酮(Polyketides)等,这些物质的存在会抑制植物病原菌的生长[31],对于多种植物病原菌均具有较强的拮抗能力。
脂肽是一类由微生物细胞合成的由脂质与氨基酸复合而成的抑菌物质。该物质具有广谱抑菌性能,其抑菌性能的发挥依赖其对膜结构的破坏[32]。脂肽可经由破坏膜脂结构、引发膜脂过氧化来造成细胞膜渗漏,从而破坏质膜通透性并引发胞质溶出,可以显著抑制病原菌生长、破坏菌体结构并抑制孢子萌发[33]。脂肽可破坏膜脂中的磷脂双分子层,在膜上形成孔洞,并经由自身表面活性剂的性质来加速细胞膜的溶解[34]。
聚酮类化合物是由微生物细胞合成的由低级脂肪酸聚合形成的具有长碳链结构的天然抑菌物质,其抑菌性能的发挥依赖于其对菌体物质合成途径的抑制[35]。聚酮被病原菌细胞吸收后,可与葡萄糖胺合酶等特异结合,对病原菌的细胞壁形成造成阻断,从而对其生长产生抑制。聚酮类物质也可抑制病原菌的蛋白质合成,这对于病原菌的生长、侵染、毒素分泌等十分不利,甚至可以造成病原菌细胞的死亡[36]。
1.2.4 解毒因子 许多植物病原菌通过特定毒素的产生来对植物正常生长造成抑制或引发植株结构与功能异常。植物毒素可通过抑制植物酶活性、干扰膜结构正常功能、破坏植物信号传导等多种途径来对植物的正常生理功能造成破坏[37]。PGPR可以对植物毒素进行灭活,或通过阻止其产生来保护植物免受植物病原菌伤害[38]。
多粘类芽孢杆菌Paenibacilluspolymyxa可经由减轻尖孢镰刀菌毒素对黄瓜代谢产生的抑制来减轻黄瓜病害[39]。伯克氏菌Burkholderiaambifaria也可对镰刀菌产生的真菌毒素进行降解,从而避免其侵染对植物造成的损伤[40]。此外伯克氏菌也被报道可以减少核盘菌对油菜的侵染,并可降解黄曲霉素等多种真菌毒素[41]。节杆菌Arthrobactersp.则可经由对酚酸的降解来抑制镰刀菌的生长,从而减少镰刀菌毒素的分泌[42]。这对于镰刀菌所致的各种植物病害的防治具有极为重要的意义。PGPR的降解真菌毒素的作用多借由酯酶、漆酶等解毒蛋白的活动来进行[43],通过该过程,真菌毒素被降解为低毒或无毒的小分子,从而可以避免植物病原菌毒素对植株造成的不利影响。
病原菌的侵染与毒素形成受特定基因的表达与调控[44],且与菌体间的群体感应息息相关。群体感应是微生物的一种胞间通讯,经由自身诱导信号等小分子的释放来进行相互感知[45]。PGPR可通过降解自身诱导信号,从而降低病原菌的群体感应能力[46-47],阻止病原菌毒力基因的表达。不动杆菌Acinetobacter lactucae即可通过对信号分子的降解来抑制黄单胞菌对植物的侵染,并减轻其引起的植株枯萎[48],假单胞菌Pseudomonassegetis可降解N-酰基高丝氨酸内酯信号分子,从而阻断植物病原细菌的群体感应,对于软腐病等植物病害的防治具有较好的效果[49]。
此外,毒素的分泌高度依赖于病原菌细胞结构与功能的完整性[50],而PGPR可经由其他机制对病原菌的细胞结构造成损伤,这也可间接阻止毒素的产生,从而避免植物病原菌对植株造成的损伤[51]。
1.3 植物系统抗性的诱导是PGPR发挥生防作用的又一手段
系统抗性(Systemic Resistance)是植物在遭受侵染性病害时产生的防御机制,经由一些特定基因的激活与代谢途径的产生,致使植物体内一些特定基因表达量或特定物质的含量发生变化[52],整体表现为植物对外界侵染的抵抗性能的提高。根据产生机制的不同,系统抗性可分为获得性系统抗性(Systemic Acquired Resistance,SAR)与诱导性系统抗性(Induced Systemic Resistance,ISR)(图2)。
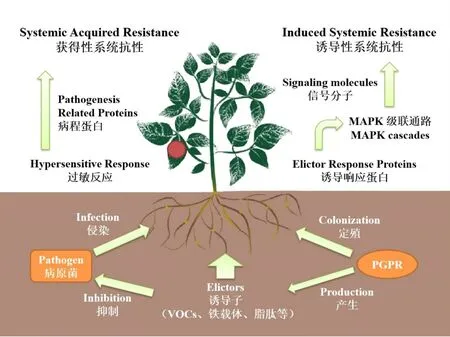
图2 植物系统抗性的产生机制
SAR是植物在遭受病原微生物侵染或发病后所产生的防御机制,经由特定蛋白对病原菌分泌产生的毒素的感应而激活,经由水杨酸来传递并调控信号[53],伴随着病程蛋白的产生及特定酶类的积累。SAR的激活往往伴随着植物过敏反应的出现,植株生理代谢发生显著改变,植株酚性物质积累大幅提升,导致患处胞壁强度提高,诱使感染组织木质化坏死[54],从而与健康组织形成隔断,阻止病原菌的进一步侵染。
与SAR不同,ISR的引发不需要病害的实际侵染,其显著特征是不会在植株上产生病变部位,也即诱发ISR的PGPR不会对植物造成损伤[55]。ISR的产生也是多基因协调的结果,通常可由PGPR代谢产物(如铁载体、VOCs等)或特定结构(如鞭毛等)诱发,伴随激素水平改变、抗氧化酶活性的提高或非酶类抗氧化剂含量的提升等。这些变化不但提高了植物对于侵染病害的抵御能力,更提高了植物对于环境胁迫的承受能力[56]。
近年来分子与组学研究的发展使得ISR的产生机制被进一步阐明。Abbasi[57]在其研究中指出,接种PGPR后,植物WRKY70、ERF1等抗性基因被激活,多种抗氧化酶类分泌水平不同程度提高,一些特定基因在植株不同部位差异表达,这些物质水平的变化有助于提高植物对于侵染病害应对能力。Yuan[58]在其研究中做出了进一步阐述,PGPR接种后,植株中的诱导子响应蛋白LRRs、CDPKs等用以传递信号,经由丝裂原活化蛋白激酶MAPK级联通路激活植物激素合成基因,引发茉莉酸、乙烯含量提升,从而引发次级通路,系统抗性发生,相关应激反应蛋白与次生代谢产物表达量提升,与清除活性氧自由基相关的抗氧化酶活性提高,从而导致植物抗逆能力的提升。
系统抗性的诱导是PGPR生防能力的又一重要机制。该机制不依赖于PGPR的直接拮抗,而是通过引发或增强植物的自然抗病能力,从而对侵染的病原菌产生阻断或杀灭的效果[59]。ISR的诱导可以时刻激活植物的防御基因,与其他生防机制一同组成PGPR-植物共生体系的抗病屏障。
2 PGPR在生物防治中的应用
植物病害对农业生产造成很大影响,植物病害的防范与控制是一个世界性的难题。生防菌株的使用为植物病害防治提供了一个新的道路,不仅可以有效取代化学药剂的滥用,还可经由PGPR的促生长作用更好的促进农林生产[60]。表1列出了近年来使用PGPR进行植物病害防治的研究。

表1 使用PGPR进行生物防治的相关研究
使用PGPR进行植物病害的生物防治具有化学药剂无法取代的诸多特点,如持效期长,PGPR在根际形成定殖后即可长效地发挥生防能力[65];无污染,菌种及代谢产物均为可被生物降解的物质,在土壤中不会产生化学残留;作用范围广泛,对于多种植物病害病原菌具有广谱的拮抗性能[64],特别是对于化学药剂较难防治的病害(如菌核病)或暂无有效化学药剂的病害(如甘薯黑斑病[66])具有无可匹敌的防治效果。
近年来随着组学技术的发展,通过对基因组进行整体分析,可在不依赖培养的情况下评判菌种的生理特性,这为PGPR的发掘与研究开辟了一条不同以往的道路[67]。借助基因组技术,人们更易于发掘潜在的PGPR菌株或已有菌株的潜在生防特性[68],这对于菌剂的开发极为关键。且组学技术的应用也有利于各PGPR菌株种间关系的研究,利于人们针对各菌株特性而进行复合菌剂开发或探寻最佳施用条件[69]。
目前PGPR在实验室中与各种植物均进行了相关实验模型的构建,并取得了较好的成果,但这些实验室成果仍需经过大量的实地实验才能对其在真实田地中的作用效果加以检验[61-62]。有研究将油菜假单胞菌(一种证实的PGPR)与一些植物病害病原菌的基因组进行了比对研究,发现有益菌与病原菌间存在许多共同的基因特征[70]。这项研究启示人们植物与微生物间的作用远比想象的复杂,它们间相互作用的结果与植物基因型及生理状态、外界胁迫的存在与否、细菌对植物免疫系统的影响能力等均有较大关联。
3 PGPR生防制剂前景展望
PGPR生防能力的发挥高度依赖于其在植物根际的稳定定殖,而PGPR的定殖依赖于对特定化学物质的趋化作用,这意味着某种PGPR菌剂可能无法在所有植物中进行广泛应用。Polcyn[71]的研究也证实,植物品种不同时菌株接种的结果可能会有较大差异,因而需要进行复合菌剂的配伍来提高PGPR菌剂的稳定性及有效性。PGPR对植物病害的防治效果与菌株数量、质量、生活力息息相关,也即只有定殖的PGPR达到一定规模才可起到稳定的病害防控效果。因而在施用时需保证菌剂中含有足够的活菌数。活菌制剂相较于化学药剂更难储存,在维持相近药效时需要更高的储藏成本,这在一定程度上制约了PGPR生防菌剂的应用,这有待于新剂型的开发来加以解决[63]。
利用分子生物学手段对菌株进行改良可能在PGPR生防菌剂的研制中发挥作用。在明确PGPR的定殖与生防机制后,可利用基因工程技术定向改造或改良PGPR菌株从而提高其稳定性或生防物质产量,从而使其在病害防治中发挥更大的作用[72-74]。对于PGPR生防产物的研究提出了一条新的道路,即不依赖活菌制剂,而是利用PGPR发酵生产特定生防活性物质用以病害防治,也可取得不错的防治效果[75],并可打破活菌制剂不易保藏难于利用的限制。此外也有针对铁载体进行的研究,通过改造其结构或利用铁载体作为药物负载,也可以在植物病害的防治中发挥效果[76]。
PGPR菌剂的使用可以在发挥有效病害防治效果的同时对植物的生长产生促进,不仅可提高作物产量还有利于染病植株的恢复,在农林业生产中具有广泛的应用前景。PGPR菌剂的推广不仅可减少化学药剂的使用,还可减少药剂生产或施用所造成的环境污染与威胁。目前仍有一些有待解决的问题制约了PGPR的开发与应用,但随着相关机理的进一步阐明与应用手段的不断拓展,可以肯定,PGPR菌剂必将深深改变农林生产的格局,开启生态种植业的新篇章。

