硅对NaCl胁迫下垂穗披碱草种子萌发及幼苗生长的影响
吴召林,祁娟,刘文辉,金鑫,杨航,宿敬龙,李明
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;2.青海省畜牧兽医科学院/青海省青藏高原优良牧草种质资源利用重点实验室,青海 西宁 810016)
近年来,日益加重的土壤沙化和盐渍化问题对世界范围内的植物生长造成了巨大的影响,全球盐渍化土地面积约10亿 hm2,而中国盐渍化土地面积占比高达10%[1]。盐胁迫导致植物种子萌发率下降,生长发育缓慢等一系列问题,严重时会导致天然草地大面积退化。因此,盐渍化已经成为限制我国农牧业发展的重要因素[3]。垂穗披碱草(Elymusnutans)作为一种优质多年生禾本科牧草,具有丰富的营养价值和较高的经济利用价值,同时也是高寒草甸的优势种之一[4]。由于该牧草具有较强的种子繁殖能力及能充分利用临时生境的特性,已成为高寒地区草地恢复、生态治理以及人工草地建植的首选草种[5]。
目前,大多数垂穗披碱草的研究工作局限于逆境胁迫对其种子萌发及幼苗生理生化的影响等方面,而Si添加对逆境胁迫条件下垂穗披碱草种子萌发及幼苗生长的影响鲜见报道。硅作为一种环境友好型元素,在一定程度上能够有效缓解逆境胁迫对植物生长和发育的抑制作用[7-9]。研究发现,外源硅能促进NaCl胁迫下种子吸水和α-淀粉酶活性来促进种子萌发,通过提高NaCl胁迫下幼苗叶绿素含量,维持较高的光合能力促进幼苗生长,进而缓解盐胁迫对种子和幼苗的伤害[10]。余群等[11]在硅对草地早熟禾种子萌发及幼苗生长影响研究中发现,硅可以在一定程度上促进草地早熟禾胚根生长,提高根系总长、根系总表面积及根系平均直径等,从而提高植物根系对土壤水分及养分的吸收能力。
尽管上述诸多研究表明Si添加可以有效缓解逆境胁迫对植物造成的伤害,促进其生长发育,但此作用因物种、胁迫程度及Si添加水平而异[12-13]。鉴于此,本研究以垂穗披碱草为试验材料,研究不同水平Si添加对盐胁迫下垂穗披碱草种子萌发及幼苗生长的影响,同时也为垂穗披碱草在盐渍化土壤改良及环境治理中的运用提供理论依据。
1 材料和方法
1.1 试验材料
供试材料为天然草地野生垂穗披碱草种子。种质采集地为天祝藏族自治县抓喜秀龙乡代乾村,海拔3 300 m,年均温-0.1℃,≥0℃的年积温为1 380℃,水热同期,全年无绝对无霜期。采集的种子在室温下晾干后保存于4℃冰箱中。
1.2 试验方法
挑选大小均一且无霉变的种子,用20%的双氧水溶液消毒15 min,然后用去离子水反复冲洗,将残余过氧化氢冲洗干净,最后用滤纸将种子表面水分吸干备用。
分别取50粒消毒处理的种子均匀放置于铺有双层滤纸的培养皿内,按照表1向各皿中添加相应浓度配比的盐溶液。为平衡由K2SiO3添加导致的K+浓度差异,加入相应量的K2SO4以保持各处理间离子浓度一致,防止因K+浓度差异导致种子渗透压出现差异,使滤纸浸透并完全浸润种子,以去离子水培养为对照,每个处理6次重复。将培养皿置于恒温培养箱内进行发芽试验,试验条件为光照/黑暗(12 h/12 h,25℃/15℃),每天称重补充蒸发散失的水分以保持盐溶液浓度,并定时观察记录每日发芽数,以芽长达到种子长度1/2为发芽标准,连续记录12 d。试验第5 d计算发芽势,第12 d计算发芽指标以及幼苗根长,苗高,并且测定种苗丙二醛(MDA)和脯氨酸含量。
1.3 测定指标及方法
1.3.1 发芽指标测定
发芽势(GV)=(发芽试验5 d内供试种子的发芽数/供试种子数)×100%
发芽率(GR)=(发芽试验12 d内供试种子的发芽数/供试种子数)×100%
重案组37号注意到,2017年9月5日,汉河派出所对黄宇做出《不予行政处罚决定书》。同年11月12日,扬州市政府做出撤销决定,责令邗江分局重新调查处理,后者经调查,决定给予黄宇行政拘留五日的处罚决定。
发芽指数(GI)= ∑(Gt/Dt)
式中,Dt,发芽日数,Gt,与Dt相对应的每天发芽种子数[14]。

表1 试验中各处理的离子浓度
1.3.2 形态、生理指标 萌发实验结束后在各处理培养皿中随机选取5株幼苗用直尺测量幼苗株高,游标卡尺测量根长。
丙二醛含量测定(硫代巴比妥酸比色法):称取0.25 g新鲜种苗置于预冷的研钵加入4 mL 10% TCA溶液冰浴研磨,然后将匀浆在8 000 g下4℃离心10 min,之后取2 mL上清液与2 mL 0.6%的TBA混合沸水浴反应15 min,冷却后3 000 g离心10 min。取上清液分别在532,600和450 nm下测吸光值并计算丙二醛含量[15]。
脯氨酸含量测定(酸性茚三酮比色法):称取0.5 g幼苗加入4 mL 3%的磺基水杨酸溶液冰浴研磨,匀浆转移至离心管中沸水浴中提取10 min,冷却后4℃ 5 000 r/min离心10 min。取上清液加入水合茚三酮和冰醋酸及蒸馏水后沸水浴显色30 min。冷却后加甲苯萃取,取上层有机相测定520 nm吸光值计算脯氨酸含量[15]。
1.4 数据处理
试验数据用SPSS 19.0软件进行统计分析,对各处理进行单因素方差分析,并用Duncan法对各测定数据进行多重比较用,利用Microsoft Excel 2016绘图。
2 结果与分析
2.1 硅对NaCl胁迫下垂穗披碱草种子萌发的影响
2.1.1 硅对NaCl胁迫下垂穗披碱草种子发芽势的影响 仅NaCl胁迫处理时,随着NaCl胁迫浓度升高,垂穗披碱草发芽势呈不同程度下降趋势,其中NaCl浓度为40 mmol/L时发芽势最低,较清水对照降低了62.31%(图1)。除15 mmol/L处理发芽势高于清水对照,其余处理均低于对照,但各处理间差异不显著。NaCl胁迫浓度为40 mmol/L时,随着Si添加浓度的升高各处理发芽势呈先升高后下降趋势,3个Si浓度添加处理均可显著提高种子发芽势,其中添加Si浓度为1.5 mmol/L时发芽势最高,为37.67%,较单一40 mmol/L NaCl胁迫处理提高了114.20%。60、80 mmol/L NaCl胁迫条件下,随着Si添加浓度的升高各处理发芽势均呈先升高后下降趋势,2种NaCl胁迫水平下添加1.5 mmol/L Si时均可有效提高垂穗披碱草种子发芽势,60、80 mmol/L NaCl胁迫条件下发芽势分别提高了34.43%和55.23%。

图1 硅对NaCl胁迫下垂穗披碱草种子发芽势的影响Fig.1 Effect of Si on germination energy of Elymus nutans seeds under NaCl stress注:不同小写字母表示同一NaCl浓度条件下不同Si浓度处理间差异显著(P<0.05),下同
2.1.2 硅对NaCl胁迫下垂穗披碱草种子发芽率的影响 仅进行NaCl胁迫处理时,随着NaCl浓度升高,垂穗披碱草种子发芽率呈不同程度降低趋势,NaCl浓度为40 mmol/L时发芽率最低,为72.80%,较清水对照降低了22.55%(图2)。单独Si元素添加时,垂穗披碱草发芽率随Si浓度升高呈逐渐下降趋势,且在硅浓度为60、80mmol/L时发芽率分别为85.67%和80.67%,分别较清水对照降低8.86%和14.18%(P<0.05)。NaCl胁迫浓度为40mmol/L时添加Si后对垂穗披碱草发芽率均表现出不同程度促进作用,其中以2.5 mmol/L Si添加促进作用最强,1.5、2.0 mmol/L次之,三者分别较单一40 mmol/L NaCl处理增长了17.68%、14.93%和12.18%(P<0.05)。60 mmol/L NaCl胁迫条件下添加Si浓度为2.5 mmol/L时对种子发芽率促进作用最强,该处理发芽率较单一60 mmol/L NaCl胁迫处理提高6.49%。NaCl胁迫浓度为80 mmol/L时随Si浓度升高垂穗披碱草发芽率呈先升高后降低趋势。其中添加1.5 mmol/L Si时垂穗披碱草发芽率最高,为87.33%,较单一80 mmol/L NaCl胁迫下发芽率提高7.38%。

图2 硅对NaCl胁迫下垂穗披碱草种子发芽率的影响Fig.2 Effect of Si on germination percentage of Elymus nutans seeds under NaCl stress

图3 硅对NaCl胁迫下垂穗披碱草种子发芽指数的影响Fig.3 Effect of Si on germination index of Elymus nutans seeds under NaCl stress
2.2 硅对NaCl胁迫下垂穗披碱草幼苗形态和生理的影响
2.2.1 硅对NaCl胁迫下垂穗披碱草种子根长的影响 仅NaCl胁迫处理下随NaCl浓度升高垂穗披碱草幼苗根长呈逐渐降低趋势,以80 mmol/L NaCl胁迫为最小,根长为1.9 cm,较清水对照减小42.63%(图4)。仅硅处理下根长呈显著降低趋势,其中以单一添加1.5 mmol/L Si处理的根长最小,为1.79cm,较清水对照减少54.24%。NaCl胁迫条件下随Si元素添加浓度升高垂穗披碱草根长均呈先升高后下降趋势。40 mmol/L NaCl胁迫处理下添加1.5 mmol/L和2 mmol/L Si均可促进根系伸长,但与单一40 mmol/L NaCl胁迫处理差异不显著。60 mmol/L NaCl胁迫下Si添加浓度为1.5 mmol/L时对根系伸长有一定促进作用,该处理下根长为2.42 cm,较相应单一NaCl胁迫下根长增加了14.86%。80 mmol/L NaCl胁迫下Si添加浓度为1.5 mmol/L和2.0 mmol/L时均可显著促进垂穗披碱草根系伸长生长,其中Si浓度为2.0 mmol/L时促进作用最强,1.5 mmol/L次之,2种处理下根长分别较相应单一NaCl胁迫处理显著增长29.63%和20.63%(P<0.05)。
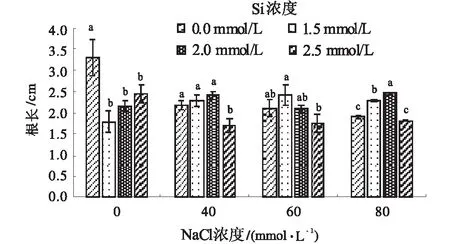
图4 硅对NaCl胁迫下垂穗披碱草幼苗根长的影响Fig.4 Effect of Si on root length of Elymus nutans seedlings under NaCl stress
2.2.2 硅对NaCl胁迫下垂穗披碱草幼苗株高的影响 NaCl胁迫对垂穗披碱草的株高表现出抑制作用(图5)。单独Si处理下垂穗披碱草幼苗株高随Si浓度升高呈逐渐增高趋势,其中以2.5 mmol/L Si处理时最高,为16.35 cm,较清水对照CK增长10.77%。NaCl胁迫条件下添加Si时,垂穗披碱草株高随Si浓度升高呈先升高后降低趋势。40 mmol/LNaCl胁迫下添加Si均可显著促进垂穗披碱草幼苗生长,其中以Si添加浓度为2.0 mmol/L处理下株高最高,为15.97 cm,较相应单一NaCl胁迫增长26.55%。60 mmol/L NaCl胁迫下添加Si浓度为2.0 mmol/L和2.5 mmol/L时可显著提高垂穗披碱草幼苗株高,2.0 mmol/L Si添加处理下株高最高,为15.59 cm,2.0 mmol/L次之,为14.65 cm,二者分别较60 mmol/L NaCl胁迫处理株高增长18.47%和13.12%。80 mmol/L NaCl胁迫下添加Si均可显著提高垂穗披碱草幼苗株高,其中Si添加浓度为1.5 mmol/L时株高最高,为15.38cm,较相应单一NaCl胁迫增长29.57%.

图5 硅对NaCl胁迫下垂穗披碱草幼苗株高的影响Fig.5 Effect of Si on plant height of Elymus nutans seedlings under NaCl stress
2.2.3 硅对NaCl胁迫下垂穗披碱草幼苗脯氨酸含量的影响 NaCl胁迫条件下垂穗披碱草幼苗体内游离脯氨酸含量均高于清水对照,且随着NaCl浓度升高脯氨酸含量呈先升高后下降趋势(图6)。单独添加Si时幼苗体内脯氨酸含量随Si浓度升高呈先降低后上升趋势,其中以1.5 mmol/L Si处理最低,2.0 mmol/L处理次之,二者分别为90.70 μmol/g和129.07 μmol/g,分别较清水对照降低46.20%和23.44%。2.5 mmol/L Si添加处理下脯氨酸含量较清水对照升高42.87%。NaCl胁迫条件下添加Si时垂穗披碱草幼苗脯氨酸含量显著低于相应单一NaCl胁迫处理。40 mmol/L NaCl胁迫下Si添加浓度为1.5、2.0和2.5 mmol/L时脯氨酸相对含量分别较NaCl胁迫对照降低81.80%、60.68%和63.79%,60 mmol/LNaCl胁迫处理下分别降低53.94%、83.36%和57.25%(P<0.05),80 mmol/L NaCl胁迫处理下分别降低72.55%、45.05%和60.22%(P<0.05)。

图6 硅对NaCl胁迫下垂穗披碱草幼苗脯氨酸含量的影响Fig.6 Effect of Si on proline content in Elymus nutans seedlings under NaCl stress
2.2.4 硅对NaCl胁迫下垂穗披碱草幼苗丙二醛含量的影响 NaCl胁迫条件下幼苗丙二醛含量随NaCl浓度升高呈先升高后降低趋势。仅添加Si时幼苗体内丙二醛含量随Si浓度升高呈先降低后上升趋势,其中以1.5 mmol/L Si处理最低,2.0 mmol/L处理次之,分别为2.13、2.89 μmol/g,较清水对照分别降低36.5%和13.66%。2.5 mmol/L Si处理下脯氨酸含量较清水对照升高42.87%,说明添加一定浓度的Si可以显著降低幼苗丙二醛含量。40 mmol/L NaCl胁迫下幼苗丙二醛含量随Si添加浓度升高呈先升高后降低趋势,Si添加浓度为2.5 mmol/L时丙二醛含量为3.40 μmol/g,较相应对照NaCl处理降低50.36%(P<0.05)。60 mmol/L NaCl胁迫下硅添加处理均可降低幼苗体内丙二醛含量,其中以2.0 mmol/L Si添加处理最低,2.5 mmol/L次之,丙二醛含量分别为2.25、4.22 μmol/g,较相应NaCl对照分别降低68.73%和41.49%(P<0.05)。80 mmol/L NaCl胁迫下丙二醛含量随NaCl浓度升高呈先降低后升高趋势,其中以1.5 mmol/L Si添加处理最低,但各处理间差异不显著。

图7 硅对NaCl胁迫下垂穗披碱草幼苗丙二醛含量的影响Fig.7 Effect of Si on MDA content in Elymus nutans seedlings under NaCl stress
3 讨论
3.1 硅对NaCl胁迫下垂穗披碱草种子萌发的影响
种子萌发是植物生活史中的重要阶段。NaCl胁迫会打破种子萌发过程中的代谢平衡,最终造成种子发芽率和发芽势降低[16]。适量Si能促使种子内部因贮藏而损伤的膜系统得到恢复和活化,透性增强,α-淀粉酶、蛋白酶、脂肪酶活性增大,各种生理生化适应机制得以启动,促进种子呼吸代谢从而提高了种子的活力,缓解NaCl胁迫对种子萌发的抑制作用从而提高种子萌发率[17]。本研究结果表明,单独NaCl胁迫及Si添加降低了垂穗披碱草种子的发芽率、发芽势和发芽指数,而NaCl胁迫下添加一定量的Si可有效提高上述萌发指标,说明Si添加在一定程度上可以缓解NaCl胁迫对垂穗披碱草种子萌发的抑制作用,但随着NaCl胁迫程度加深,硅对盐胁迫的缓解作用减弱。种子在吸胀萌发的过程中,NaCl胁迫会对细胞膜系统修复和重建形成抑制,进而导致细胞膜的选择吸收能力遭到破坏,引起大量离子涌入,对细胞造成伤害,但是硅能保护种子胶体结构和内部一些酶的活性,阻止NaCl胁迫对膜的损伤,使种子在一定NaCl浓度下能够萌发生长[18]。张新慧等的研究发现,硅添加对NaCl胁迫下甘草种子萌发和幼苗生长的影响效应因NaCl胁迫程度和植物物种而异[19]。本研究发现,NaCl浓度为40、60 mmol/L时,随添加Si浓度升高,种子发芽率呈逐渐升高趋势,Si添加浓度为2.5 mmol/L时发芽率均达到最高,而80 mmol/LNaCl胁迫条件下仅在Si浓度为1.5 mmol/L时表现出促进作用。这可能是由于高浓度盐溶液产生渗透胁迫和离子胁迫,抑制种子内部生理生化反应的重建以及膜透性增加等而抑制种子萌发[20]。发芽率,发芽势和种子发芽指数常作为评价种子发芽的指标,可以反映种子的发芽速度,种子发芽的整齐度和幼苗健壮的程度。本研究中,3种NaCl胁迫水平下添加Si浓度为1.5 mmol/L时对垂穗披碱草发芽率、发芽势和发芽指数均有促进作用。
3.2 硅对NaCl胁迫下垂穗披碱草幼苗形态和生理的影响
株高和根长是研究植物生长常用的指标,可以反映植物生长的好坏和幼苗健壮的潜能[21]。牛菊兰等[22]人在早熟禾品种特性与耐NaCl性关系的研究中发现NaCl胁迫会显著减小早熟禾幼苗的根长,并且这种抑制作用因胁迫程度而异。崔佳佳等[23]在外源Si对NaCl胁迫下甘草幼苗生长的影响研究中发现,外源Si添加可以促进NaCl胁迫下甘草幼苗的生长发育,这种促进作用也因胁迫程度和Si添加水平而异。本研究结果表明,40~80 mmol/LNaCl胁迫会明显抑制幼苗株高和根长的增长,添加1.5~2.5 mmol/L Si时对NaCl胁迫下幼苗的株高表现出促进作用,对根长则为显著抑制作用,这种抑制作用随Si浓度升高逐渐减弱,说明添加Si在一定程度上可以促进垂穗披碱草地上部分生长而抑制其根系生长,这与牛菊兰等的结果相似。添加Si可有效促进NaCl胁迫下垂穗披碱草幼苗的生长,说明Si在一定程度上可以有效缓解NaCl胁迫对垂穗披碱草幼苗生长的抑制作用并促进其生长发育。
脯氨酸可以在水分胁迫时降低植物自身渗透势以从外界吸收水分保持相对稳定的膨压。但关于脯氨酸的合成和积累在植物抵御逆境胁迫时的功能目前尚未明确。一些学者认为,脯氨酸的积累是植物受到逆境胁迫的表现特征,不能作为植物耐NaCl性的评价指标[24]。然而另一些观点认为,脯氨酸的合成和积累可以提高细胞的渗透调节能力,进而提高植物的抗逆性[25-28]。本研究结果表明,NaCl胁迫处理下垂穗披碱草脯氨酸含量高于清水对照,NaCl胁迫下添加Si时脯氨酸含量均显著降低,说明本研究中脯氨酸积累是垂穗披碱草在遇到NaCl胁迫后应对胁迫的反应,添加Si可以降低NaCl胁迫下垂穗披碱草幼苗的脯氨酸含量,进而说明添加Si可以有效缓解NaCl对垂穗披碱草造成的胁迫效应,这与王耀晶,刘大林等的研究结果一致[28-29]。丙二醛是植物膜脂过氧化的最终产物,是检测植物膜伤害的一个重要指标,其含量可以用来表示植物质膜过氧化的程度[30]。本研究结果显示,NaCl胁迫下垂穗披碱草体内MDA含量明显高于清水对照,添加Si在一定程度上可以显著降低垂穗披碱草体内MDA含量,说明Si添加可以有效提高垂穗披碱草活性氧清除系统的活性,降低NaCl胁迫产生的活性氧对植物膜系统造成的伤害。
4 结论
1)NaCl胁迫明显抑制垂穗披碱草种子萌发和幼苗生长,外源Si添加可显著缓解NaCl胁迫对种子萌发和幼苗生长的抑制作用,其中NaCl浓度为40 mmol/L和60 mmol/L时,随添加Si浓度升高种子发芽率呈逐渐升高趋势,Si浓度为2.5 mmol/L时发芽率均达到最高,Si浓度为2.0 mmol/L时幼苗株高达到最高。
2)NaCl胁迫处理下垂穗披碱草体内脯氨酸含量高于清水对照,添加Si时脯氨酸含量均显著降低,说明Si添加可以有效缓解NaCl对垂穗披碱草造成的胁迫效应。
3)综合各处理对垂穗披碱草种子和幼苗的影响发现,硅添加可以有效缓解NaCl胁迫对垂穗披碱草种子萌发及幼苗生长的抑制作用,但这种缓解作用因胁迫程度和Si添加浓度而异。

