PEG引发对小冠花种子萌发及幼苗生理特性的影响
富波年,马乐元,马慧霞,何仁元,杨晓燕
(甘肃农业大学 资源与环境学院,甘肃 兰州 730070)
种子萌发及幼苗建成是植物生命周期的关键时期。种子在贮藏过程中,会受自身或外界环境的影响而发生劣变,从而导致种子萌发及幼苗生长能力下降,甚至死亡[1]。种子引发是通过控制种子吸水速率和吸水量,并逐步回干使其处于预发芽代谢状态的一项技术[2]。有研究表明,引发处理使种子达到胚根即将突破种皮时的早期萌发状态,可提高种子活力,促进种子萌发和幼芽生长[3-5]。聚乙二醇(polyethylene glycol,PEG)是一种高分子渗压剂,其本身不能渗入种子细胞中。用PEG浸种处理可使种子处于低水势的介质中,从而降低种子萌发过程中水分进入的速度,提高种子的出苗率及整齐度,缩短出苗期[6],尤其对于不易萌发的种子(硬实度高、未成熟及老化种子)的促进效果显著[7-8]。
小冠花(Coronillavaria)为豆科多年生草本植物,是优良的饲用、水土保持、公路护坡、观赏及绿肥植物,主要种植在我国西北干旱区域[9-10]。其种子硬实率高,发芽率低,发芽时间长,出苗率低且参差不齐[11-12],已成为限制小冠花推广种植的主要因素[13]。目前PEG引发处理提高种子活力,促进种子萌发和幼芽生长已在小麦[14]、燕麦[7]、穿心莲[15]以及油菜[16]等多种植物种子的研究中得到证实。本研究用不同浓度PEG引发处理小冠花种子,从种子萌发、幼芽生长,渗透调节物质含量及抗氧化酶活性等角度,研究PEG引发处理对小冠花种子萌发及幼芽生长的影响,为PEG引发技术在小冠花栽培种植上提供基础数据,也为种子引发技术应用于农业生产提供实践依据。
1 材料和方法
1.1 供试材料
供试小冠花品种为绿宝石(LBS)和西辐(CY),由甘肃创绿草业科技有限公司提供。本试验在甘肃农业大学资源与环境学院旱区生态研究所进行。
1.2 试验设计
(1)供试小冠花种子,先用10%NaClO消毒10 min,用蒸馏水冲洗数次,再用吸水纸吸干待用[17]。在预试验的基础上,共设10个处理,每个处理6个重复。以没有处理的原始种子作为对照(CK),将小冠花种子分别置于0%(蒸馏水)和10%、20%、30%的PEG溶液中,种子重量与溶液体积比为1∶5 [(W(g)∶V(mL)],在25℃的发芽箱内培养12 h,用蒸馏水将种子上的PEG溶液洗净、滤纸吸干,摊在发芽纸上移入25℃的鼓风干燥箱,回干至原种子质量,密封于常温下待用。

表1 实验处理方案
(2)采用培养皿滤纸法进行种子萌发实验。挑选两个品种饱满、大小一致的引发和对照(CK)处理小冠花种子,置于底部垫有两层发芽纸的标准发芽培养皿,每个培养皿放入60粒种子,加入10 mL蒸馏水,加盖,置于种子发芽箱,8 h光照、16 h黑暗,光子量照度300 μmol/(m2·s),温度为25℃,相对湿度为70%,进行发芽试验[18]。每2 d定量补加蒸馏水,使其保持湿润。每天统计发芽率,共统计10 d(根据预实验此时种子已经停止萌发),并测定种子萌发指标。选引发处理后萌发效果最佳的处理(10%PEG引发)测定幼芽生理指标。
1.3 测定指标及方法
1.3.1 种子萌发指标和幼苗生长指标 种子萌发以胚根0.2 cm作为发芽标准,处理第4 d统计发芽势(GE),第9 d统计发芽率(GP),并计算发芽指数(GI)和活力指数(VI)。其中:发芽率(GP)=9 d发芽种子数/测试种子总数×100%,发芽势(GE)=前4 d发芽种子数/种子总数×100%,发芽指数(GI)=∑(Gt/Dt),活力指数(VI)=GI×S[19](Gt为第t天的发芽数,Dt为相应发芽的天数,S为第9 d幼芽鲜重)。萌发9 d时,测量幼芽的生长指标,每处理随机抽取20株幼芽,用精度0.01 mm的游标卡尺测量胚根尖到子叶端的长度。
1.3.2 幼芽生理指标测定 取发芽试验第10 d的CK处理和用10%PEG处理的幼芽进行生理指标测定。
渗透调节物质含量测定:可溶性蛋白含量采用考马斯亮蓝G-250比色法测定;脯氨酸含量采用酸性茚三酮法测定[20];可溶性糖含量采用蒽酮比色法测定[21]。
电解质渗透率(电导率)用DDS-11A型电导仪测定幼芽外渗液电导率值[22]。
超氧化物歧化酶(SOD)活性采用氮蓝四唑法测定;过氧化氢酶(CAT)活性采用紫外分光光度法测定;过氧化物酶(POD)活性采用愈创木酚比色法测定[22]。
1.4 数据分析
采用SPSS 19.0软件进行数据分析,采用单因素法进行差异显著性分析,使用最小显著差异法(least significant difference,LSD)在0.05显著性水平进行差异显著性分析,利用Excel 2016软件作图。
2 结果与分析
2.1 PEG引发对小冠花种子萌发的影响
PEG处理下2个小冠花品种的种子发芽势、发芽率和发芽指数较CK显著增高(图1~3),随着PEG浓度的增加,两个品种的各萌发指标呈现先升高后降低的趋势,其中10%PEG处理效果最佳。10%PEG处理下,绿宝石(LBS)和西辐(CY)小冠花的发芽势、发芽率、发芽指数分别比CK高550.06%、29.31%、74.54%和229.52%、25.42%、50.23%,且差异显著(P<0.05)。30%PEG处理下,绿宝石(LBS)和西辐(CY)小冠花种子发芽势较10%PEG处理显著降低了55.03%和25.51%(P<0.05),发芽率和发芽指数有所降低但未达到差异显著水平。PEG处理下,绿宝石(LBS)小冠花种子活力指数较CK显著提高了88.09%、75.07%和95.38%(图4),西辐(CY)小冠花种子活力指数也有提高但差异不显著(P<0.05)。

图1 PEG处理下小冠花种子的发芽势Fig.1 Effects of PEG treatments on the germination vigour of Coronilla varia注:不同小写字母表示差异显著(P<0.05),下同

图2 PEG处理下小冠花种子的发芽率Fig.2 Effects of PEG treatments on the germination percentage of Coronilla varia

图3 PEG处理下小冠花种子的发芽指数Fig.3 Effects of PEG treatments on the germination index of Coronilla varia

图4 PEG处理下小冠花种子活力指数Fig.4 Effects of PEG treatments on the vitality index of Coronilla varia
2.2 PEG引发对小冠花幼芽生长的影响
不同浓度PEG处理,小冠花幼芽的生长指标与对照相比呈先增加后降低的趋势(图5~7)。0%和10%PEG引发处理下,绿宝石(LBS)胚根长比CK增加18.45%、2.77%。胚芽长比CK增加20.30%、11.87%,但两个品种与CK均未达到显著水平。30%PEG引发处理时,与CK相比,绿宝石(LBS)和西辐(CY)胚根长分别降低32.19%、40.73%,胚芽长降低22.66%、22.96%,差异达到显著水平(P<0.05)。随PEG引发浓度增加,2个品种小冠花幼芽鲜重先增加后降低,10%PEG引发处理高于其他处理,其中西辐(CY)幼芽鲜重达到36.80 mg,显著高于对照26.80 mg(P<0.05)。说明低浓度PEG处理对促进小冠花幼芽生长有积极作用,且品种间有差异。

图5 PEG处理下小冠花幼苗的胚根长,胚芽长和鲜重Fig.5 Effects of PEG treatments on the hypocotyl length,epicotyl length and seedling fresh weight of Coronilla varia
2.3 PEG引发对小冠花幼苗渗透调节物质含量和电解质渗透率的影响
可溶性蛋白、可溶性糖和脯氨酸是植物体内参与渗透调节的主要有机溶质。10% PEG处理后,绿宝石(LBS)和西辐(CY)幼芽可溶性蛋白含量较CK增加了137%和226%;脯氨酸含量高于CK 82.92 μg/g FW和82.04 μg/g FW,且均达到显著水平(P<0.05);可溶性糖含量有所增加,但差异不显著。电解质渗透率均显著降低(P<0.05),其中绿宝石(LBS)降低5.03%,西辐(CY)降低10.59%(表2)。说明适宜浓度PEG引发处理提升了幼芽渗透调节物质含量,降低了细胞膜电解质渗透率。2个品种渗透调节物质含量和电解质渗透率有差异,说明引发效果品种间存在差异。
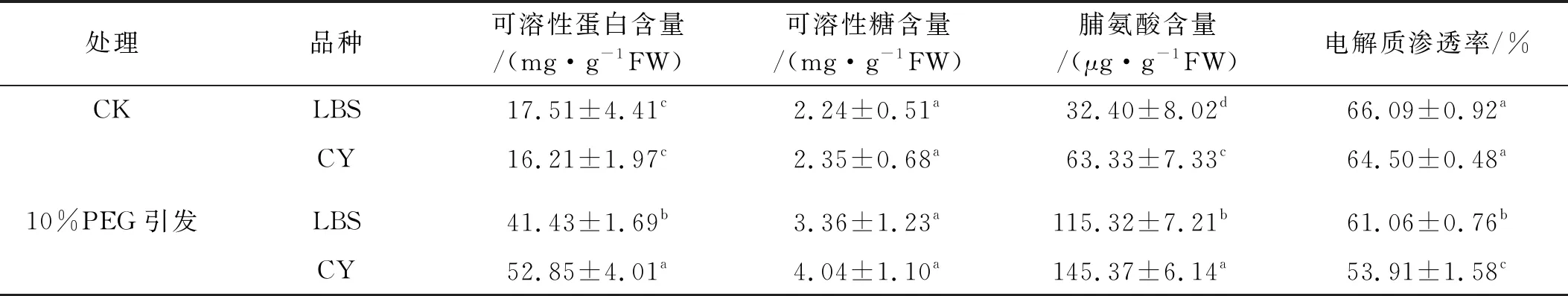
表2 10%PEG引发处理下小冠花幼苗渗透调节物质含量和电解质渗透率
2.4 PEG引发对小冠花幼苗CAT、POD和SOD活性的影响
与CK相比,10% PEG处理下2个品种幼苗CAT、POD和SOD活性均显著增加(表3)。PEG处理的绿宝石(LBS)和西辐(CY)幼苗CAT活性较CK分别增加了97.48%、39.82%;POD酶活性分别增加了71.69%、97.86%;SOD活性分别增加了88.28%、39.68%。说明PEG引发处理可以帮助小冠花幼芽抗氧化酶维持在更高的活性水平。

表3 10%PEG引发处理下小冠花幼芽CAT、POD和SOD活性
3 讨论
种子引发由Heydecker W提出[2],在一些发达国家已作为部分蔬菜、花卉作物种子的播前处理技术,旨在控制条件使种子前期缓慢吸水但不发生可见萌发。其原理是控制种子吸水,使种子处于DNA修复、酶活化准备和萌发所需物质代谢提前启动的发芽代谢状态[3-4]。PEG引发可提高多种植物种子发芽率和出苗率一致性,同时增加幼苗株高、鲜重等[5-8,23]。本研究中,0%~20%PEG引发处理均显著提高了2个品种小冠花种子发芽势、发芽率和发芽指数,显著提高绿宝石(LBS)小冠花种子活力指数,20%PEG引发处理则无明显促进作用。这与前人研究15%PEG引发可显著提高甘蓝种子活力[24]、40%PEG引发可显著提高甜菜种子发芽势、发芽率、发芽指数、活力指数的结果类似[25]。表明适宜浓度PEG引发处理可以促进植物种子萌发,但不同植物品种对PEG引发浓度响应不同。在本研究中,10%PEG处理能显著促进小冠花幼芽的生长,30%PEG处理下小冠花幼芽生长和鲜重均降低,说明高浓度的PEG引发对小冠花幼苗生长抑制。
植物积累脯氨酸、可溶性蛋白和可溶性糖等渗透调节物质,可以提高细胞内渗透势,维持细胞内膨压,防止细胞过度失水[26-27],稳定细胞器结构,维持细胞内正常的新陈代谢[28]。PEG可以减缓种子在萌发初期吸收水分的速率,减少种子在吸收水分的过程中膜系统受到的损伤和对受损膜系统的修复[29]。本研究中,10%PEG引发处理下,小冠花幼芽脯氨酸、可溶性蛋白含量显著升高,与王彦荣等[30]对紫花苜蓿的研究结果类似。膜结构的完整性是维持种子活力的基础,干燥的种子快速吸水会造成膜损伤,引起其功能的异常,物质外渗量增加,种子活力下降[31]。经PEG引发处理,2个品种小冠花幼芽的电解质渗透率均低于对照。这与PEG引发对芹菜种子幼芽影响的研究结果一致[32]。表明PEG引发能够提高小冠花幼芽渗透物质的积累能力,维持细胞继续生长,保护了细胞膜结构。
引发会引起抗氧化酶系统(CAT、POD和SOD酶)的增强,使自由基的清除能力得到提高,膜脂过氧化降低[33]。本试验在PEG引发处理下小冠花幼芽CAT、SOD和POD活性较CK处理显著升高。这在蔡春菊等对毛竹[34]和孙园园等对水稻[4]的研究结果相似。表明PEG能够通过提升小冠花抗氧化酶活性,减少膜脂过氧化,保护膜结构的完整性,增强幼芽应对外界环境的适应能力。
4 结论
适宜浓度的PEG引发处理对小冠花种子萌发和幼芽生长具有明显的促进作用,表现为提升了种子的发芽势、发芽率、发芽指数和活力指数,并增加了幼芽的重量以及根长和芽长。但超出最高PEG 引发浓度的阈值(20%PEG引发),会影响种子正常萌发和幼芽生长。PEG引发可诱导小冠花通过增加脯氨酸和可溶性蛋白等渗透调节物质含量,提升幼芽渗透调节能力。并通过提高CAT、POD、SOD等抗氧化酶活性,降低细胞膜脂过氧化和电解质外渗,保护细胞结构完整性。建议在小冠花的培育种植前用10%PEG引发处理,以促进种子萌发和幼芽生长,增强小冠花的适应能力。

