潜在转化生长因子结合蛋白2在老年宫颈癌病人血清中的表达及临床意义
唐固平李昭会陈丽融何红梅郭进喜
宫颈癌是妇科临床常见的恶性肿瘤之一, 我国宫颈癌的发病率和死亡率一直居高不下,目前,宫颈癌已成为严重危害女性健康的重要危险因素之一。据报道,恶性肿瘤的发生与细胞微环境紊乱密切相关,而细胞外基质是细胞微环境的重要组分,有助于维持细胞的正常功能[1]。潜在转化生长因子结合蛋白2(latent transforming growth factor binding protein 2, LTBP2)是LTBP纤维蛋白家族的重要成员,也是细胞外基质的重要组分之一[2]。最近有文献报道,LTBP2在多种恶性肿瘤组织中表达异常,且与病人的不良预后有关[3]。然而,目前国内有关LTBP2在宫颈癌中的表达及与宫颈癌关系的研究较少。因此,本研究旨在探讨LTBP2在老年宫颈癌病人血清中的表达,并分析血清表达水平与老年宫颈癌病人临床病理特征间的关系。
1 资料与方法
1.1 一般资料 研究对象为2017年7月至2019年7月达州市中西医结合医院收治的78例老年宫颈癌病人。纳入标准:(1)均经病理检查首次确诊为宫颈癌;(2)入组前未接受过化疗及放疗;(3)确诊后均接受手术切除治疗;(4)年龄≥60岁。排除标准:(1)临床分期为Ⅳ期,不能接受手术治疗;(2)合并急性感染性疾病;(3)重要脏器功能障碍;(4)既往有肿瘤病史。78例病人中,年龄60~75岁,平均(69.72±8.55)岁,临床分期:Ⅰ~Ⅱ期26例,Ⅲ期52例,分化程度:低分化23例、中分化34例、高分化21例。另纳入同期确诊为慢性宫颈炎的老年病人31例为慢性宫颈炎组,平均年龄为(67.39±9.42)岁,体检的健康人群37例为正常对照组,平均年龄为(65.71±10.07)岁,3组年龄差异无统计学意义(P>0.05)。
1.2 样本采集 采集所有入组者的晨起空腹外周静脉血4 mL,另采集老年宫颈癌病人手术后1、3、6个月时的外周静脉血各4 mL,EDTA抗凝处理,室温静置30 min,3000 r/min离心20 min,抽取上层血清,于2 h内检测完毕,整个过程避免溶血。
1.3 检测方法 严格参照人组织LTBP2酶联免疫吸附检测试剂盒(上海润裕生物科技有限公司)说明书进行操作,首先设置空白孔、标准孔和样本孔,空白孔不加,标准孔加按一定比例稀释好的标准品50μL,样本孔加待测样本50μL,然后除空白孔外,其余每孔均加辣根过氧化物酶(HRP)标记的检测抗体100μL,附上封板膜,37 ℃温育60 min,弃去孔内液体,甩干,洗板3次,每孔加洗涤液300μL,浸泡1 min,甩干,再向每孔加入底物溶液A、B各50μL,37 ℃避光温育15 min,最后每孔加入终止液50μL,15 min内,使用Synergy 2型多功能酶标仪(美国BioTek公司)在450 nm波长处测定各孔的光密度(optical density, OD)值。

2 结果
2.1 3组血清LTBP2水平比较 3组血清LTBP2水平差异具有统计学意义(F=11.264,P<0.001),其中宫颈癌组血清LTBP2水平显著高于慢性宫颈炎组和正常对照组,差异有统计学意义(P<0.05)。慢性宫颈炎组和正常对照组血清LTBP2水平相比,差异无统计学意义(P<0.05),见表1。
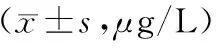
表1 3组血清LTBP2水平比较
2.2 血清LTBP2水平与宫颈癌病人临床病理特征的关系 不同临床分期、分化程度的病人血清LTBP2水平差异有统计学意义(P<0.05),有淋巴结转移的病人血清LTBP2水平显著高于未转移者(P<0.05),但不同年龄、肿瘤直径、肌层浸润深度、脉管癌栓病人的血清LTBP2水平差异无统计学意义(P>0.05),见表2。
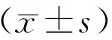
表2 血清LTBP2水平与病人临床病理特征的关系
2.3 手术前后宫颈癌病人血清LTBP2水平及阳性率比较 与术前相比,宫颈癌病人术后1、3、6个月血清LTBP2水平逐渐降低,各时间点血清LTBP2水平差异有统计学意义(P<0.05)。以术前血清LTBP2水平平均值为界限,将病人血清LTBP2水平>平均值(36.72μg/L)定义为阳性[4],78例病人中,术前血清LTBP2阳性率为46.15%,术后血清LTBP2阳性率显著下降,各时间点血清LTBP2阳性率比较,差异有统计学意义(P<0.05),但术后3个月与术后6个月血清LTBP2阳性率比较,差异无统计学意义(P>0.05),术后6个月病人血清LTBP2阳性率仅为2.56%(2/78),这2例病人的病情较重,预后较差,见表3。

表3 手术前后宫颈癌病人血清LTBP2水平及阳性率比较(n=78)
3 讨论
宫颈癌是继乳腺癌之后,威胁女性健康的“二号杀手”。尽管近年来通过早期筛查手段可以早期发现宫颈癌或癌前病变,甚至宫颈癌高危人群,但由于宫颈癌病人早期也容易发生淋巴结转移,导致病人的远期预后仍不理想[5]。因此,深入探究宫颈癌的发生发展过程中相关的分子机制,对于提高宫颈癌的精准靶向治疗具有积极意义,有助于提高病人的远期预后。
肿瘤的发生发展与肿瘤微环境关系密切。肿瘤细胞可通过释放细胞因子调控肿瘤微环境,而肿瘤微环境也影响着肿瘤细胞的各种生物学特性[6-7]。近年来研究发现,对维持细胞功能具有重要作用的细胞外基质可能与恶性肿瘤的发生发展有关[8]。LTBP2是一种参与细胞外基质组成的胞外分泌蛋白,其在细胞黏附、弹性纤维聚集等生理过程中发挥重要作用[9]。既往有文献报道,LTBP2与肝癌、乳腺癌、子宫内膜癌等多种实体恶性肿瘤关系密切[10]。LTBP2在肝癌病人血清中呈高表达,在胃癌组织中呈阳性表达,且可促进胃癌细胞的迁移和侵袭[11]。然而,目前国内有关LTBP2在宫颈癌中的表达及意义的研究较少。由于老年宫颈癌病人机体免疫力普遍降低、多合并基础疾病、更易发生转移,而LTBP2又与恶性肿瘤细胞转移关系密切,因此,本研究将老年宫颈癌病人作为研究对象,分析了LTBP2在老年宫颈癌病人血清中的表达及意义。本研究结果显示,宫颈癌组血清LTBP2水平显著高于慢性宫颈炎组和正常对照组,但慢性宫颈炎组和正常对照组间差异无统计学意义,表明宫颈癌病人血清中LTBP2表达增加,其表达增加可能与宫颈癌的发病有关。
本研究进一步分析了血清LTBP2水平与宫颈癌病人临床病理特征的关系,结果显示,不同临床分期、分化程度、有无淋巴结转移的病人血清LTBP2水平差异有统计学意义(P<0.05),表明LTBP2表达与病人的临床分期、分化程度及淋巴结转移有一定关系。据以往的文献报道,血清LTBP2的表达与肝癌病人的肿瘤直径有关[12],但本研究未发现血清LTBP2表达与肿瘤直径存在明显关系,这可能与肿瘤类型不同有关。
手术后,由于肿瘤切除后肿瘤细胞大量减少,导致LTBP2分泌到外周循环中的量减少,从而导致血清LTBP2水平显著下降。本研究结果显示,术后1、3、6个月血清LTBP2水平逐渐降低,术后6个月仅2例仍呈阳性表达,这2例病人的病情严重,预后较差。研究显示,LTBP2可促进肝癌、乳腺癌、黑色素瘤细胞的增殖和转移[13],与恶性肿瘤的发生发展关系密切,因此本研究结果提示血清LTBP2水平可作为宫颈癌病人病情观察的辅助检测指标,对于评估临床治疗效果有一定的参考价值。
综上所述,老年宫颈癌病人血清中LTBP2表达增加,并与临床分期、分化程度及淋巴结转移有一定关系,监测血清LTBP2水平对于老年宫颈癌病人手术前后的病情评估具有一定的临床价值。但仍需在今后进行更多的实验加以探究LTBP2在宫颈癌中的具体作用机制,以期为靶向宫颈癌微环境的治疗奠定一定的基础。

