复配菌剂强化高分子质量聚丙烯酰胺的矿化研究
刘志伟,李 欣,张慧超,孙艳瑞,安众一
(烟台大学土木工程学院,山东 烟台 264005)
随着全球能源需求的增加,石油勘探与开发加速发展,催生了以聚合物驱油为代表的第3代驱采油技术[1-2],但同时产生了大量含高分子聚丙烯酰胺(PAM)的废水[3]。由于PAM加入水中可以提高溶液的黏度从而强化油田的采收率[4],因此被广泛应用于石油开采行业[5-7]。虽然PAM毒性较低不会对环境造成巨大污染[8-11],但PAM降解过程中会产生较多中间体,特别是具有累积性神经毒性并被归类为“可能对人类致癌的物质”的丙烯酰胺单体(AM),若不能将其妥善处置,这类含聚废水将直接威胁受纳水体周边。因此,如何将含聚废水彻底无害化处理变得紧迫而重要[12]。
含聚废水的高黏度和强乳化性是处理过程中需要面对的难题[13-14]。目前可用来处理含聚废水的方法包括物理法、化学法[15-20]、生物法[21-23]以及耦合处理手段[24]。尽管物化处理具有较高的降解效率,但处理过程中很容易产生有毒的AM,而且需要能源供应或药剂投加,增加了其处理成本。生物法降解PAM已显示出低成本、环保且不产生有毒底物的优势[25-26]。
先前的研究表明,PAM是微生物碳或氮的来源,并且PAM生物降解的代谢途径在厌氧和好氧条件下均可发生。如果碳源充足,土壤微生物可将PAM作为唯一氮源,这表明此类微生物可以分解PAM上的酰胺基支链,但不能降解碳碳长链[27-28]。厌氧菌包括硫酸盐还原菌[29-30]和产甲烷菌[31]都可以使用PAM作为氮源。有研究表明,从油田驱采废水中获得的微生物在培养时可以利用PAM作为氮源或碳源[32]。WEN等[33]从活性污泥和油污土壤中分离出了2种可以利用PAM作为唯一碳源的菌株,发现酰胺基可被微生物水解。同时,BAO等[32]推导了生物降解酶的作用机理:特种微生物分泌酰胺酶将氨基水解为羧基,然后通过酶的作用切断侧链末端的甲基[33,34]。最后,甲基被单一加氧酶催化氧化为酸,PAM链骨架断裂,从不同位置形成乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸等小分子有机物[35]。
目前所有针对PAM的生物强化手段均采用PAM作为底物直接筛选降解菌,未考虑针对PAM代谢途径中不同步骤的产物进行微生物筛选,所以现有的研究论文中获得的复配菌剂能够提高PAM的降解率,但总有机碳(TOC)下降率较低。现今使用的淀粉-碘化镉测定PAM浓度的方法,其原理是检测PAM溶液中酰胺基的含量,酰胺基脱落、测得数值降低,则认为PAM浓度降低[36]。然而,酰胺基脱落后形成的聚丙烯酸、长碳链聚合物等,则被忽视掉了。而TOC的降低,才能够代表溶液中有机碳类物质被矿化、转变为CO2和H2O。ZHANG等[26]将以PAM为底物分离到的3株菌应用于反应器中,发现这3种菌均具有稳定的强化效果,但处理后的TOC去除率最高只能达到40%。SANG等[12]将以PAM为底物获得的2株菌PAM-2和PAM-F1混合投加到厌氧折流板反应器中,以蔗糖作为共代谢底物,通过变性梯度凝胶电泳(DGGE)的分析发现,2株菌能够很好的存在于反应器中,对PAM和黏度的降解率分别可达89.8%和75.8%,而TOC降解率仅为32.9%。
目前所有的报道中,PAM降解菌的筛选全部以PAM作为底物,而并未针对PAM脱酰胺基后形成的长碳链降解菌进行筛选。针对于上述问题,本研究的2组试验中,分别以PAM作为氮源,液体石蜡作为碳源;聚丙烯酸(PAM脱酰胺基后形成的主要长碳链聚合物)作为碳源,氯化铵作为氮源,筛选不同功能的降解菌群。并将两者复配获得功能相辅的复合菌剂,用以提高PAM的矿化率。
1 实验材料和方法
1.1 实验材料
实验中使用的PAM种类为阴离子型,其相对分子质量为1600×104,由胜利油田相关公司提供;聚丙烯酸钠(SPA)购自天津科密欧化学试剂有限公司;实验室模拟含聚废水成分参照胜利油田出水水质成分配制而成。
1.2 培养基成分
培养基Ⅰ成分组成(以1 L计):2 mL液体石蜡,0.3 g PAM,0.2 g KH2PO4,0.1 g CaCl2,0.1 g MgCl2,1 g NaCl,0.1 g FeCl3,0.1 g MgSO4及微量元素液(各类微量元素痕量配制成溶液)1 mL[33]。
培养基Ⅱ成分组成(以1 L计):1 g SPA,0.1 g NH4Cl,0.2 g KH2PO4,0.1 g CaCl2,0.1 g MgCl2,1 g NaCl,0.1 g FeCl3,0.1 g MgSO4,及微量元素液(各类微量元素痕量配制成溶液)1 mL,加入去离子水定容至1 L。
上述2种培养基可通过添加1.5%~2.0%琼脂,制备成固体培养基。文中所述浓度均为质量浓度。
1.3 菌种的筛选及鉴定
PAM酰胺基降解菌种的筛选:以胜利油田长期接触PAM的土壤作为筛种来源,首先以PAM为唯一氮源的液体培养基作为筛选及富集培养基Ⅰ,将土壤称取5~10 g,加入到100 mL无菌水中,加入玻璃珠1 g,120~150 r/min摇床震荡1 h。取1 mL上清液加入到上述培养基Ⅰ内,30 ℃培养5 d;再取培养后的菌液1 mL,加入到新的100 mL培养基Ⅰ内,30 ℃培养48 h。取上述培养液1 mL,加入到9 mL无菌水中,采用梯度稀释法,最终稀释质量浓度至10-6。取稀释后的菌液,涂布在固体培养基Ⅰ表面,30 ℃培养48 h,获得单菌落。分别挑取单菌落,在新的固体培养基表面划线分离5次后,获得纯菌种。
PAM长碳链降解菌种的筛选:以长期处理含聚废水的生物接触氧化反应器中填料表面的生物膜作为微生物筛选的来源,首先以培养基Ⅱ(SPA为唯一碳源)的液体培养基作为筛选及富集培养基。将生物接触氧化反应器内的生物膜称取5 g,加入到100 mL无菌水中,加入玻璃珠1 g,120 rpm摇床震荡1 h。取上述培养液1 mL,加入到9 mL无菌水中,采用梯度稀释法,最终稀释质量浓度至10-6。取稀释后的菌液,涂布在固体培养基Ⅱ表面,30 ℃培养48 h,获得单菌落。分别挑取单菌落,在新的固体培养基表面划线分离5次后,获得纯菌种。
利用E.Z.N.A.SQ Tissue DNA Kit基因组DNA提取试剂盒提取功能菌株的DNA,以细菌的通用引物Primer A-27F(Primer A-27F: 5'-AGAGTTTGATCCTGGCTCAG-3')和Primer B-1492R(5'-AAGGAGGTGATCCAG CCGCA-3')扩增16S rDNA片段进行测序比较分析。PCR反应体系:总DNA 1 μL,Primer A-27F 1 μL,Primer B-1492R 1 μL,10×Buffer 5 μL,dNTP 4 μL,Taq DNA聚合酶 0.25 μL,ddH2O 32.5 μL;以及扩增程序:94 ℃预变性5 min,94 ℃变1 min,55 ℃退火30 s,72 ℃延伸1 min,循环35次后将PCR产物送至上海生工生物工程公司进行测序,之后将测序得到的16S rDNA进行Blast序列分析比对。
1.4 菌种的驯化
将筛选到的PAM酰胺基降解菌及长碳链降解菌分别加入到表1和表2的特异性驯化培养基中,放置于30 ℃的摇床中震荡培养。每隔3 d移取5 mL前一个培养基溶液加入到下一个驯化培养基中,依次进行,直到降解菌在④ 号驯化培养基中稳定生长后停止驯化。将经过驯化的菌种进行富集培养以进行下一步实验。

表1 酰胺基降解菌特异性驯化培养基
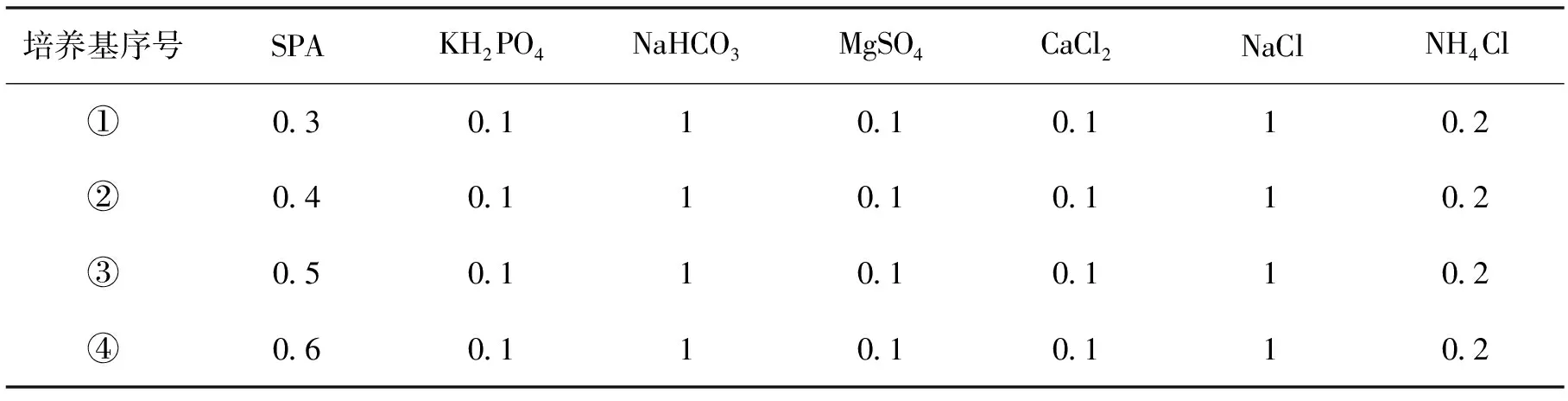
表2 碳链降解菌特异性驯化培养基
1.5 菌种性能及降解效果测定
配制500 mg/L的模拟PAM溶液并进行高温高压灭菌,在PAM溶液中接种经深度驯化的酰胺基降解菌、C—C长链降解菌以及2种菌进行组合的混合菌作为菌液。将菌液放置于摇床中进行恒温培养,观察细菌的生长情况,并采用淀粉-碘化镉法测定PAM的浓度。
1.6 功能菌复配方法
将驯化完成的单株菌按照S组与G组两两组合、三三组合和全部混合的方式进行复配,共9组。每种菌液离心浓缩至OD600=1,分别取1 mL加入到500 mg/L的PAM溶液中,其他营养成分还包括(g/L):0.1 KH2PO4,1 NaHCO3,0.1 MgSO4,0.1 CaCl2,1 NaCl,微量元素母液1 mL。
1.7 FT-IR图谱分析
采用红外图谱法检测PAM及其生物降解产物的结构,考察不同时期的基团变化。样品分析前需均先经过24 h真空冷冻干燥处理,用光谱纯KBr制作压片测定,采用傅里叶-红外光谱仪进行分析。
2 结果分析与讨论
2.1 降解菌的分离与鉴定
在含有PAM和SPA的固体培养基上划线纯化后共获得23株单菌,16S rDNA测序分析后,将基因序列提交到NCBI GenBank进行比对分析,发现23株菌分别属于的4个不同的菌属,其中能够高效降解酰胺基的菌种有2株,分别命名为S-1(Ochrobactrumanthropi,相似度99%)、S-2(Acinetobactervenetianus,相似度99%);高效降解长碳链的菌有2株,分别命名为G-1(Pseudochrobatrumsp.,相似度100%)、G-2(Bacilluscereus,相似度100%)。其中,G-2所属的芽孢杆菌有大量研究数据表明可应用于PAM的降解,而其他3种菌尚未有应用于PAM的降解的报道[33]。
2.2 酰胺基降解菌的降解效果
分别取1 mL驯化前后的S-1、S-2菌液加入到经高温高压灭菌后的PAM基本培养基中,将其放置于摇床中30 ℃恒温震荡培养,每隔4 h取样进行检测,共培养120 h。图1(a)和图1(b)为驯化前后S-1、S-2的生长曲线和PAM降解效果,可以看出,生长曲线符合微生物生长繁殖的S型曲线规律,并且驯化后的S-1、S-2降解菌的生长情况要优于驯化之前,降解PAM的效果也更强。驯化之前S-1、S-2降解菌对500 mg/L的PAM溶液的降解率为37.28%和42.14%,经过驯化之后,提高到了46.7%和51.54%,说明经过驯化显著提高了降解菌在PAM溶液中的生存能力。

图1 驯化前后S-1、S-2的生长曲线和PAM降解效果
2.3 C—C长链降解菌的降解效果
分别取1 mL驯化前后的G-1和G-2菌液加入到经高温高压灭菌后的不加外加碳源的SPA液体培养基中,将其放置于摇床中30 ℃恒温震荡培养,每隔4 h取样进行检测,共培养120 h。图2(a)和图2(b)为驯化前后G-1、G-2的生长曲线和COD去除情况,可以看出,生长曲线符合微生物生长繁殖的S型曲线规律,并且随着降解菌的生长,COD去除率也在逐步提高,最终趋于稳定,说明G-1、G-2这2种降解菌能够以SPA作为唯一碳源进行生长繁殖,从而可以推出这2种降解菌对PAM的长链态的碳有去除效果。
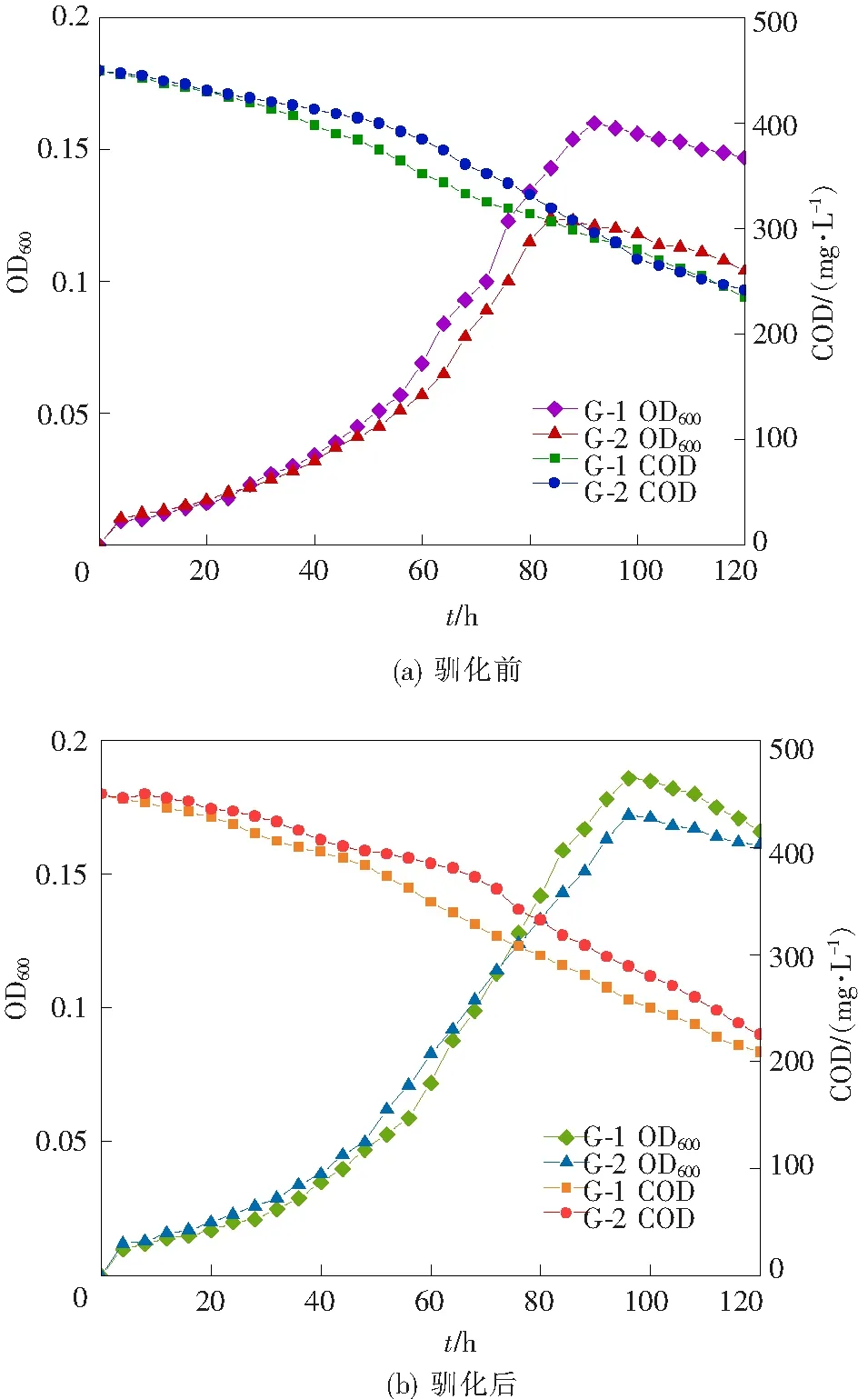
图2 驯化前后G-1、G-2的生长曲线和COD去除情况
2.4 2类降解菌制备复配菌剂的降解效果
在本实验中,选用胜利油田长期接触含聚废水的土壤来筛选酰胺基降解菌,采用生物接触氧化反应器中已长期降解含聚废水的生物膜筛选长碳链降解菌。2种降解菌的筛选来源不同,有利于菌株间更好的协同作用,提高降解效率。从图3来看,最佳混合菌剂的降解效果明显高于单一细菌。PAM的去除率大大提高,有利于降低PAM的分子质量,降解C—C长链将大大降低含聚废水的黏度。此外,混合菌剂对PAM的降解效果呈现多种状态,或增强或减弱,这是菌种间存在的协同以及竞争所导致,从而影响了菌种对PAM的降解效果。其中S-2&G-2混合菌剂对PAM的降解效果最为显著,能达到69%,说明S-2和G-2之前存在着良好的协同关系,而S-1&S-2&G-2混合菌剂对PAM的降解效果较单菌种而言降低了,只有35%,说明这3种菌剂之间存在着竞争关系。此外,本实验也对混合菌剂对含PAM废水黏度的降低效果进行了探究,研究发现,S-2&G-2混合菌剂仍然是最优的降解菌组,实验室配制的500 mg/L的PAM模拟废水黏度在1.61 mPa·s(14 ℃下水的黏度为1.17 mPa·s),如图4,经过84 h降解,黏度下降至1.24 mPa·s,与水的黏度十分接近,从侧面显示出混合菌剂对PAM有显著的降解效果。图5为混合菌剂对不同浓度PAM溶液TOC的降解效果,PAM质量浓度越低,去除率越高,针对100 mg/L PAM溶液的TOC去除率可达60%以上,远高于已有报道[26]。
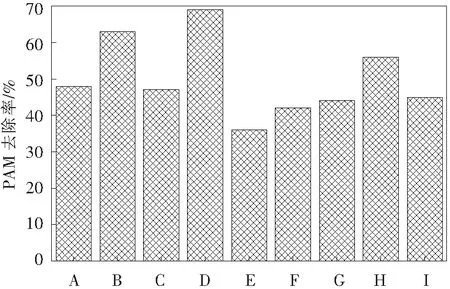
A.S-1&G-1,B.S-1&G-2,C.S-2&G-1,D.S-2&G-2,E.S-1&G-1&G-2,F.S-2&G-1&G-2,G.S-2&G-1,H.S-1&G-2,I.S-1&S-2&G-1&G-2。
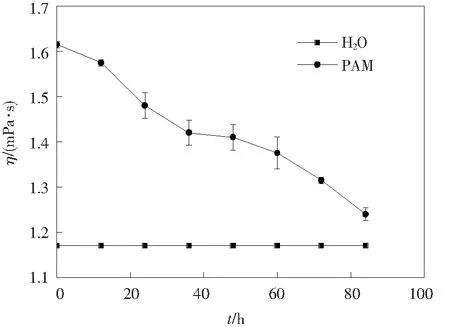
图4 S-2和G-2混合菌剂对降低含聚合物废水黏度的影响
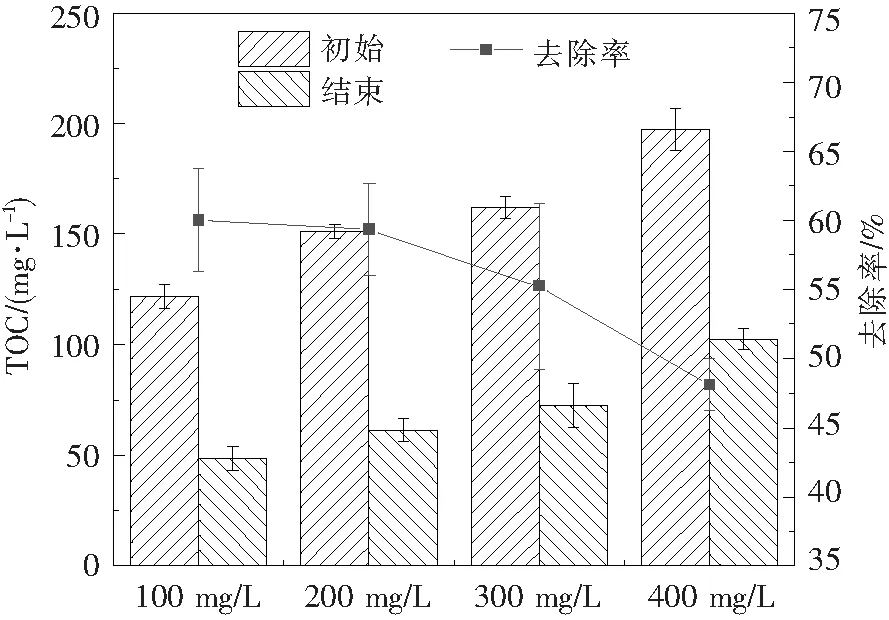
图5 S-2和G-2混合菌剂对不同浓度PAM溶液TOC的降解效果
2.5 FT-IR图谱分析
S-2&G-2混合菌剂降解PAM样品的红外图谱如图6所示,对比降解前后的PAM红外光谱可以发现经过复配菌剂降解之后,PAM的结构发生了很大的变化,红外光谱中原有的一部分特征吸收峰消失,同时出现了新的特征吸收峰,如位于3300~3500 cm-1区域内游离的-NH2的特征吸收峰消失变为-OH的尖锐吸收带,2929 cm-1处的亚甲基反对称吸收峰消失,同时位于1666 cm-1处的羰基(C=O)的特征吸收峰消失,说明降解菌可以利用PAM上的碳作为生长繁殖的碳源,并且于1000~1475 cm-1区域内出现新的特征吸收峰,此处出现的新的特征吸收峰属于醇类;位于1408 cm-1处的C-N特征吸收峰消失,说明氨基从主链脱落,而在650~1000 cm-1区域内新出现芳香烃类化合物的特征吸收峰,从而进一步证明:复合菌剂能够降解PAM并利用其长链态的碳以及酰胺基作为自身生长发育的碳源和氮源;实验结果与郑忠环等[37]的研究结果相符合,WEN等[33]的研究也表明,生物降解能够将PAM侧链上的氨基断裂下来,成为微生物生长繁殖不可或缺的氮源。
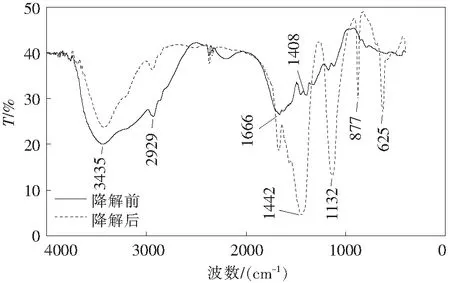
图6 PAM降解前后的红外光谱
3 结 论
(1)经16S rDNA鉴定,从胜利油田含聚污泥中筛选出的4种PAM降解菌S-1、S-2、G-1、G-2分别属于人苍白杆菌(Ochrobactrumanthropi),威尼斯不动杆菌(Acinetobactervenetianus),假苍白杆菌(Pseudochrobatrumsp.)和蜡状芽孢杆菌(Bacilluscereus)。
(2)降解菌经过驯化培养,生长情况与对PAM的降解能力优于驯化培养之前。2类降解菌复配成复配菌剂,其中S-2&G-2复配菌剂对PAM的降解效果最为显著,降解率能达到69%;混合菌剂对含聚废水的黏度的降低也有较好的效果,经过84 h降解,最优复配菌剂能够将含聚废水的黏度从1.61 mPa·s降至1.24 mPa·s(14 ℃下水的黏度为1.17 mPa·s),同时,混合菌剂对于TOC也有较强的去除作用,对于质量浓度为300 mg/L以内的PAM溶液的TOC去除率能达到50%以上。这表明复配菌剂可以降解PAM的碳链使其分子质量下降,并将部分长碳链矿化。
(3)对复配菌剂降解PAM前后的红外图谱进行分析显示,降解菌能够降解并利用PAM的氨基和碳作为生长繁殖的氮源和碳源。

