生防菌NH-8及其高效突变体诱导番茄抗性的比较
李德全 汪宝华 曹云英 邓自发


摘要:在比较枯草芽孢杆菌NH-8及其突变体B2、H7抑菌活性的基础上,以苏粉8号番茄幼苗为试材,比较枯草芽孢杆菌NH-8及其高效突变体对番茄幼苗生长、抗性酶活性的影响。结果表明,NH-8菌株及其高效突变菌株对番茄生长具有明显的促进作用,接种H7菌株的番茄幼苗其幼苗株高、主茎高度、鲜质量、干质量分别为42.50 cm、282 cm、1498 g/株、4.65 g/株,较清水对照增加73.04%、276.00%、77.28%、100.43%;2个高效突变菌株的拮抗能力较枯草芽孢杆菌NH-8有所提高,其促生作用和诱导抗性酶活性大多相应增强;接种生防菌株H7的番茄叶片过氧化物酶、超氧化物歧化酶、过氧化氢酶、多酚氧化酶活性相对最大,分别为4.5、55.5、47.6、14.7 U。
关键词:枯草芽孢杆菌NH-8;突变体;番茄;抗性酶;酶活性;抗性诱导
中图分类号: S641.201文献标志码: A
文章编号:1002-1302(2021)07-0111-04
收稿日期:2020-07-09
基金项目:江苏省南通市应用基础研究项目(编号:MS12015089);南通大学重点项目(编号:03080227)。
作者简介:李德全(1975―),男,江苏丰县人,博士,副教授,从事生物防治和抗性生理研究。E-mail:lidequan@ntu.edu.cn。
芽孢杆菌为芽孢杆菌科、芽孢杆菌属革兰氏阳性菌,既能产生芽孢以抵抗各种化学和物理的胁迫,又能产生多种抗菌活性物质抑制病原物,促进植物生长,在植物病害生物防治中应用广泛[1-5]。诱导植物产生抗病性保护是植物产生主动抗性的一种表现,经典抗性诱导是在植物体上先接种病原菌或诱导物,导致在接种部位产生病斑,进而产生系统抗病性,而多酚氧化酶(PPO)、过氧化物酶(POD)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)等酶的活性大小往往与植物抗性强弱有密切关系[6-9],可用于指征植物对病原菌的抗性能力。
枯草芽孢杆菌(Bacillus subtilis)NH-8是从近海海藻分离筛选到的具有良好抑菌活性的产芽孢杆菌[10],生长快,能产生抗生素,对多种植物病原生物具有较强的拮抗作用,是一种能在植物病害防治中发挥重要作用的生物防治因子[11]。本试验利用比单一诱变更为有效的氮离子注入法[12]对海洋细菌NH-8进行诱变处理,筛选获得2株拮抗性能比菌株NH-8更为高效的突变体;在此基础上,以苏粉8号番茄幼苗为试材,测定接种生防菌NH-8和2株高效突变菌株的番茄叶片多酚氧化酶、过氧化物酶、过氧化氢酶、超氧化物歧化酶等活性水平,并分析比较其对番茄幼苗的控病促生作用,旨在明确生防菌NH-8和2株突变菌株的诱抗能力,为评价该生防菌株的应用价值、生防作用机制及对植物病害的有效防治提供新途径。
1 材料与方法
1.1 材料
枯草芽孢杆菌NH-8及其高效突变菌株B2、H7、小麦纹枯病原菌,由南通大学生命科学学院实验室保存提供,供试番茄品种为苏粉8号。
1.2 试验时间、地点
田间盆栽试验于2019年2—5月选择在南通大学植物试验园进行,室内试验在南通大学生物技术重点实验室进行。
1.3 菌株NH-8及其高效突变株的抑菌活性比较
以小麦纹枯菌为指示菌,采用平板对峙法验证抑菌活性,其具体操作过程:将菌株NH-8及其2株突变菌株分别移植到牛肉膏、蛋白胨液体培养基中,26℃、140 r/min振荡培养36 h,备用;将纹枯病病原菌移植到直径为90 mm的PDA平板上,26 ℃培养48 h;打孔器打孔,将菌块移植到直径为90 mm的空白PDA平板中央培养8 h,对角接种NH-8及其2株高效突变体,26 ℃培养48 h;测量接种菌株的菌圈直径,计算抑制率,重复6次。抑制率计算公式:
抑制率=菌圈直径/45×100%。
式中:45为平板半径值,mm。
1.4 菌株NH-8及其高效突变菌株对番茄生长的影响
选取生长相对一致的番茄幼苗,移栽到按顺序摆放、装有灭菌土的塑料盆中,每盆移栽1株,接种菌含量为1010 CFU/mL的菌株NH-8及其高效突变菌株发酵液250 mL/株,分别以空白培养基、清水处理为对照,移栽后15、25 d再用相应的溶液处理1次;定植后30 d,每处理随机选择5点,每点选取番茄6株,取出植株,用自来水洗净,晾干;分别采用直尺、游标卡尺测量株高、短缩茎粗度,采用电子秤称量植株的鲜质量、干质量;称量干质量时,将番茄植株在烘箱中55 ℃烘干。每次处理试验植株数为30株,重复4次。
1.5 番茄叶片抗性酶活性的测定
1.5.1 接种处理 以番茄幼苗为试材,分别喷施菌含量为1010 CFU/mL的NH-8、H7、B2菌株发酵液100 mL/株,以喷等量清水为对照,共计4个处理;分别在接种后1、2、3、4、5、6 d取适量番茄叶片,测定其抗性酶活性,重复4次。
1.5.2 番茄叶片酶活性测定方法[13] (1)过氧化物酶和多酚氧化酶。取番茄叶片1.2 g,加入pH值6.8的0.05 mol/L磷酸缓冲液5 mL、石英砂少许,冰浴下研磨成匀浆;4 ℃、12 000 r/min离心 20 min,取上清液,采用紫外分光光度计测定波长。过氧化物酶:以0.18 mol/L愈疮木酚为底物,室温反应 6 min,以测定波长为460 nm的吸光度D420 nm 1 min 增加0.1所需酶量為1个酶活单位,U;多酚氧化酶:以150 μmol/L联苯三酚为底物,反应10 min,加人15% H2SO4 中止,以测定波长为 420 nm 的吸光度D420 nm 1 min增加0.001所需酶量为1个酶活单位,U。(2)超氧化物歧化酶和过氧化氢酶。取番茄叶片1.2 g,加入pH值7.8的 0.05 mol/L 缓冲液 5 mL、石英砂少许,冰浴下研磨成匀浆;4 ℃、12 000 r/min 离心20 min,取上清液,采用紫外分光光度计测定波长。超氧化物歧化酶:测定波长为560 nm的吸光度值D560 nm,以抑制氮蓝四唑光化学反应还原50%为1个酶活性单位,U;过氧化氢酶:测定以0.2%过氧化氢为底物,室温反应3 min,以测定波长为240 nm的吸光度D240 nm 1 min减少0.01所需酶量为1个酶活单位,U。
2 结果与分析
2.1 菌株NH-8及其高效突变体的抑菌效果
由表1、图1可见,菌株NH-8的2个高效突变体H7、B2的抑菌率分别为80.4%、72.0%,其拮抗能力明显好于出发菌株NH-8,分别较菌株NH-8增加23.6、32.0百分点;H7菌株对纹枯病病原菌的拮抗能力最强,其菌落直径相对最大,为36.2 cm。
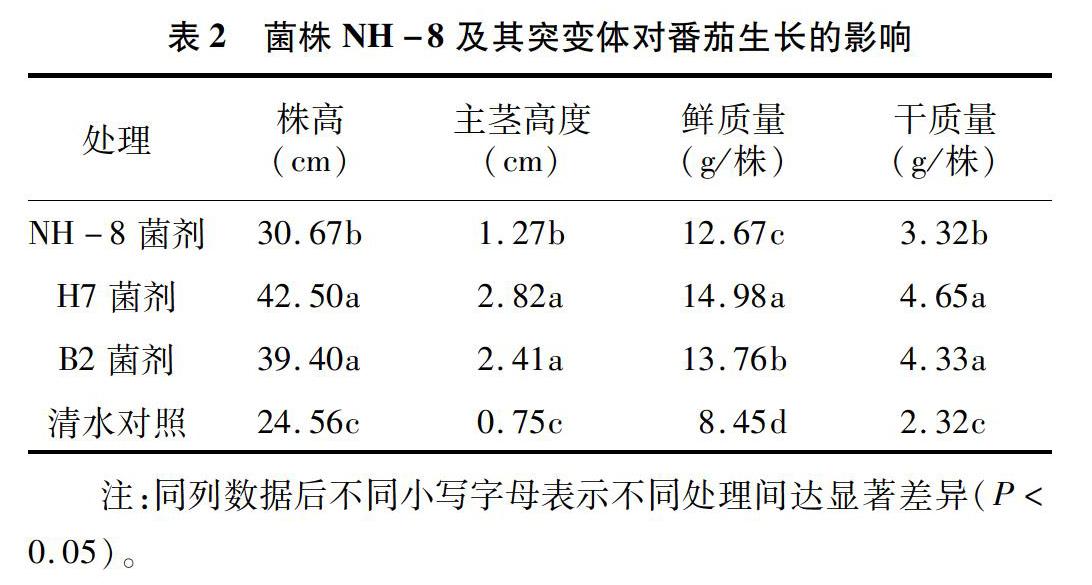
2.2 菌株NH-8及其高效突变体对番茄幼苗的促生效果
由表2可见,与对照相比,各个菌株发酵液处理对番茄生长均有显著的促生作用(P<0.05),菌株发酵液处理20 d,番茄幼苗株高、主茎高度、鲜质量、干质量分别显著高于清水对照,其中接种H7菌株的番茄幼苗增加相对最高,幼苗株高、主茎高度、鲜质量、干质量分别为42.50 cm、2.82 cm、14.98 g/株、4.65 g/株,分别较清水对照显著增加73.04%、276.00%、77.28%、100.43%(P<0.05)。
2.3 菌株NH-8及其突变体处理对番茄抗性酶活性的影响
由图2可见,喷施拮抗菌NH-8及其高效突变株B2、H7菌液,番茄叶片抗氧化酶活性均呈先上升后下降趋势。接种H7菌液的番茄叶片其过氧化物酶活性在接种3 d、多酚氧化酶活性在接种4 d、超氧
化物歧化酶活性在接种2 d、过氧化氢酶活性在接种3 d时达到最大,4个酶活性分别为4.5、14.7、55.5、47.6 U,接种6 d时均接近于对照水平;B2、H7这2个高效突变株的防御酶活性多高于出发菌株NH-8,说明防御酶系的活性随着拮抗菌株的拮抗能力和促生作用提高而增强。
3 结论与讨论
有研究认为,诱导植物获得系统抗性(SAR)在生防菌防病作用中起重要的作用[14],而诱导抗病性保护是植物产生主动抗性的一种表现[15]。王美琴等认为,生防菌可以影响与植物抗病性相关的重要酶活性,植物早期防御反应可提高木质化程度,增强氧化酶活性等,这都与诱导抗病性有关[16-17]。枯草芽胞杆菌对人畜无毒害,对环境无污染,具有明显的抗菌活性和极强的抗逆能力,本试验采用的枯草芽孢杆菌NH-8对多种植物病原生物具有较强的拮抗性能,与其高效突变菌株对番茄幼苗生长有明显的促进作用。本试验盆栽促生试验结果显示,接种H7菌株的番茄幼苗的株高、主茎高度、鲜质量、干质量分别为4250 cm、2.82 cm、14.98 g/株、4.65 g/株,较清水对照显著增加73.04%、27600%、77.28%、100.43%(P<0.05)。
生防菌对植物病害的防病作用可能是促生、产生抗菌物质及诱导宿主抗性产生等多因素综合作用的结果[18-19]。拮抗菌株NH-8和突变菌株可以诱导番茄幼苗叶片内过氧化物酶、超氧化物歧化酶、过氧化氢酶、多酚氧化酶等与抗病性相关的防御酶活性大幅度提高,而2个高效突变株的防御酶活性比出發菌株NH-8略高。因此,有必要进一步加强对高效突变菌株的研发与应用。
参考文献:
[1]Yourman L F,Jeffers S N. Resistance to benzimidazole and dicarboximide fungicides in greenhouse isolates of Botrytis cinerea[J]. Plant Disease,1999,83(6):569-575.
[2]Wsahington W S,Shanmuganathan N. Fungicide control of strawberry fruit rots and the field occurrence of resistance of Botrytis cinera to iprodione,benomyl and dichlofluanid[J]. Crop Protection,1992,11(4):355-360.
[3]Peng G,Sutton J C. Evaluation of microorganisms for biocontrol of Botrytis cinerea in strawbeerry[J]. Plant Pathology,1991,13(3):247-257.
[4]张 鹏,洪 葵,庄 令,等. 抗真菌活性物质的分离纯化及生物活性研究[J]. 福建热作科技,2006,31(1):5-7.
[5]Vollenbroich D,Ozel M,Vater J,et al. Mechanism of inactivation of enveloped viruses by the biosurfactant surfactin from Bacillus subtilis[J]. Biologicals,1997,25(3):289-297.
[6]何 红,欧雄常,王立才,等. 红树内生海洋细菌CⅢ-1菌株对辣椒青枯病的防病效果[J]. 植物保护学报,2008,35(6):497-500.
[7]Mohammed S H,Saedy M A,Enan M R,et al. Biocontrol efficiency of Bacillus thuringiensis toxins against root-knot nematode,Meloidogyne incognita[J]. Journal of Cell and Molecular Biology,2008,7(1):57-66.
[8]李德全,钱亚明,周鸣鸣,等. 海洋细菌NH-8防治草莓灰霉病机理及其抗菌物质分析[J]. 植物保护学报,2016,43(2):215-221.
[9]李德全,谈 蓉,周鸣鸣,等. 筛选和利用海洋细菌防治玉米纹枯病试验[J]. 江苏农业科学,2014,42(8):118-120,121.
[10]陈志谊,刘永锋,陆 凡. 井冈霉素和生防菌Bs-916协同抗病作用及增效机理[J]. 植物保护学报,2003,30(4):431-434.
[11]Rosslenbroich H J,Stuebler D. Botrytis cinerea-history of chemical control and novel fungicides for its management[J]. Crop Protection,2000,19(8/10):557-561.
[12]余增亮. 离子束生物技术引论[M]. 合肥:安徽科学技术出版社,1998:34-46.
[13]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:25-49.
[14]van Peer R,Niemann G J,Schippers B. Induced resistance and phytoalexin accumulation in biological control of Fusarium wilt of carnation by Pseudomonas sp. strain WCS417[J]. Phytopathology,1991,81:728-734.
[15]田 黎,顧振芳,陈 杰,等. 海洋细菌B-9987菌株产生的抑菌物质及对几种植物病原真菌的作用[J]. 植物病理学报,2003,33(1):77-80.
[16]王美琴,贺运春,薛 丽,等. 番茄内生细菌的分离及拮抗菌株的筛选[J]. 植物保护学报,2007,34(5):559-560.
[17]Jeon Y H,Chang S P,Hwang I G. Involvement of growth-promoting rhizobacterium Paenibacillus polymyxa in root rot of stored Korean ginseng[J]. Journal of Microbiology and Biotechnology,2003,13(6):881-891.
[18]李德全,邓自发,曹云英,等. 芽孢杆菌NH-8对番茄根结线虫病的生防效果[J]. 江苏农业科学,2020,48(8):108-110.
[19]Hong H,Qiu S,Fangping H,et al. Advance in biological effects of endophytic bacteria[J]. Bacteria Journal of Microbiology,2004,24(3):40-45.

