脂蛋白脂酶基因突变致儿童高三酰甘油血症性胰腺炎一例报道并文献复习
许锦平,白海涛,姚拥华,陈先睿
本文要点:
近十余年来儿童急性复发性胰腺炎诊断率不断升高,但急性复发性胰腺炎仍属于儿科相对少见的疾病。本文报道了1例脂蛋白脂酶基因突变所致儿童高三酰甘油血症性胰腺炎病例的诊治经过,并通过文献复习对脂蛋白脂酶基因突变所致高三酰甘油血症性胰腺炎的基因遗传特点及临床诊疗思路进行了讨论,有助于提高临床医生对该病的关注及该病危害的认识。
在过去十余年里,虽然儿童急性复发性胰腺炎(acute recurrent pancreatitis,ARP)诊断率不断升高,但ARP仍属于儿科相对少见的疾病。成人ARP的病因主要与饮酒、吸烟、胰腺坏死及高脂血症等有关,而儿童ARP的病因主要与自身免疫和遗传因素有关[1-3],但无论是成人还是儿童,高脂血症均可能是ARP的独立危险因素[1-2,4]。脂蛋白脂酶(lipoprotein lipase,LPL)是脂质代谢的关键酶,主要由脂肪细胞、心肌细胞、骨骼肌细胞及巨噬细胞等实质细胞合成并分泌入血。LPL以载脂蛋白C2(Apo C2)为协同因子,可将极低密度脂蛋白(very low density lipoprotein,VLDL)、乳糜微粒(chylomicrons, CM)等富含三酰甘油的脂蛋白水解为游离脂肪酸(free fatty acid,FFA),因此LPL缺乏会导致CM大量堆积并导致患者空腹血浆三酰甘油水平明显升高[5]。国内外研究均表明高脂血症性胰腺炎(hyperlipidemic pancreatitis,HLP)患者存在LPL基因突变[6-7]。本文报道了1例LPL基因突变所致儿童高三酰甘油血症性胰腺炎(hypertriglyceridemic pancreatitis,HTGP)病例,并进行了文献复习,以期提高临床医生对该病的关注及该病危害的认识。
1 病例简介
患儿,女,11岁,因“进食少量猪肝及姜母鸭后出现腹痛、呕吐1 d”而于2020-01-11由他院转入厦门大学附属第一医院儿科。患儿为足月顺产(第一胎第一产),出生体质量为2.8 kg,无窒息抢救史,采用母乳喂养,生长发育正常并按时添加了辅食;对花粉过敏。患儿平素饮食多为青菜、瘦肉,不喜油腻,2019-11-30因进食稀饭、鸡蛋后出现腹痛、呕吐半天而就诊于他院,查血三酰甘油为6.08 mmol/L(参考范围:0.50~1.70 mmol/L),总胆固醇为1.89 mmol/L(参考范围:3.10~5.20 mmol/L),脂肪酶为985.8 U/L(参考范围:5.6~51.3 U/L),淀粉酶为964.4 U/L(参考范围:20.0~220.0 U/L);行腹部CT检查示胰腺及周围改变,胰腺炎可能,出血坏死性不排除;行腹部彩超检查示胰腺肿大伴周围少量积液,脾脏轻度增大,肝胆未见明显异常;行胰腺磁共振成像(magnetic resonance imaging,MRI)检查示胰腺体部周围渗出,考虑胰腺炎。他院最终诊断为“急性胰腺炎、高三酰甘油血症(hypertriglyceridemia,HTG)、继发细菌感染”并收住院,予以禁食、注射用头孢哌酮钠舒巴坦钠抗感染、奥曲肽抑制胰酶分泌、奥美拉唑抑酸及补液等处理。2019-12-04患儿恢复流质饮食,2019-12-08出院;出院后继续口服奥美拉唑(20 mg/次,1次/d)、头孢地尼(50 mg/次,2次/d,)、酪酸梭菌肠球菌三联活菌片(1 g/次,3次/d),1周后停药并保持清淡饮食。2020-01-11患儿因进食少量猪肝及姜母鸭后出现腹痛、呕吐1 d而再次就诊于他院,查血三酰甘油>56.50 mmol/L,脂肪酶为343.3 U/L,淀粉酶为341.8 U/L;行腹部彩超检查示急性胰腺炎,门诊予禁食后患儿家长要求转入厦门大学附属第一医院进行治疗。患儿此次入院后查血三酰甘油为13.54 mmol/L,脂肪酶为231.5 U/L,淀粉酶为256.0 U/L,血钠为126 mmol/L(参考范围:130~150 mmol/L),且血标本浑浊、呈现奶酪样改变;行肝、胆、胰、脾CT检查示胰腺肿大,内未见明显坏死区域,胰腺边缘模糊,周围渗出明显;行腹部彩超检查示胰腺尾部略肿大伴周围不规则回声区,考虑胰腺炎性渗出;行磁共振胰胆管造影(magnetic resonance cholangiopancreatography,MRCP)示胆囊饱满、胰腺体尾部饱满且信号不均匀、胰周脂肪间隙模糊,考虑炎症。综合考虑患儿为急性胰腺炎、高脂血症,遂予以禁食、持续胃肠减压、补液等对症支持治疗,并采用乌司他丁抑制蛋白酶、生长抑素抑制胰酶分泌、奥美拉唑保护胃黏膜,同时间断使用注射用头孢哌酮钠舒巴坦钠(分别于2020-01-12至2020-01-15、2020-01-18至2020-01-22使用)联合甲硝唑(于2020-01-12至2020-01-15使用)预防感染;治疗11 d后复查血三酰甘油为5.47 mmol/L(轻度升高),总胆固醇为6.82 mmol/L,脂肪酶、淀粉酶正常,遂予以出院。
患儿出院后遵医嘱保持低脂饮食(婴儿米粉10 g+小百肽全营养配方粉1.5勺+鱼皮胶原蛋白肽4 g冲泡,100 ml/次,1次/6 h)+清水捞菜饮食,同时服用小儿善存片以补充多元维生素。2020-02-26患儿无明显诱因下出现腹痛、呕吐并再次入住厦门大学附属第一医院儿科。入院查体:体温为36.4 ℃,心率为96次/min,呼吸频率为22次/min,体质量为29 kg,发育正常,意识清晰,倦怠面容,皮肤未见黄色瘤,腹部紧张、触痛,左中上腹压痛明显、反跳痛可疑阳性;查血三酰甘油为127.51 mmol/L,总胆固醇为20.06 mmol/L,脂肪酶为685.4 U/L,淀粉酶为841.0 U/L,血钠为129 mmol/L;行B超检查提示胰腺形态饱满、回声增强,主胰管未见扩张,胰腺炎性改变;行血尿串联质谱分析(送福州金域医学检验所进行检测)及风湿免疫全套检查均未见明显异常;遂予以禁食、抑制胰酶分泌、降脂治疗等,患儿经治疗后好转。
鉴于患儿父母非近亲结婚,父亲于2016年因胰腺炎、高脂血症而于他院住院治疗(当时查血三酰甘油为4.20 mmol/L,总胆固醇为6.62 mmol/L)且近3年均口服降脂药物非诺贝特,母亲血三酰甘油为2.52 mmol/L,因此建议患儿及其父母进行基因检测。待告知患儿父母基因检测的目的及意义并征得其同意后签署知情同意书,抽取患儿及其父母外周血并送福州金域医学检验所进行检测,具体如下:先采用QIAamp DNA提取试剂盒(QIAGEN公司)抽提患儿基因组DNA并测量其吸光度值及浓度;将提取的DNA采用DNA酶片段化并采用磁珠法进行纯化,之后进行PCR扩增并连接上接头序列,经 TruSight One Sequencing Panel(Illumina Inc,USA)两次捕获及纯化、PCR再次扩增和纯化后获得最终文库;使用MiSeq测序仪(Illumina Inc,USA)对4 811个相关基因外显子区进行测序,并采用BWA算法、仪器默认设置比对参考序列(UCSC hg19),结合文献报道进行注释;最后经筛选并结合患儿临床资料及PolyPhen2、LRT、Mutation Taster等生物信息学软件预测结果对各个基因功能、突变情况及遗传模式进行分析,发现可疑候选突变时针对相应位点设计PCR引物并进行扩增及Sanger测序验证,同时对患儿父母相应基因位点进行检测。
患儿同时发现已报道的具有致病性的LPL基因第6外显子区错义突变c.835C>G和c.836T>G(见图1),并分别来源于其父亲和母亲,后经检索发现两篇LPL缺乏症患者LPL基因第6外显子区c.835C>G突变导致脂蛋白酶活性降低的报道[8-9],也发现LPL基因第6外显子区c.836T>G突变导致酶活性完全丧失的体外实验[9]。
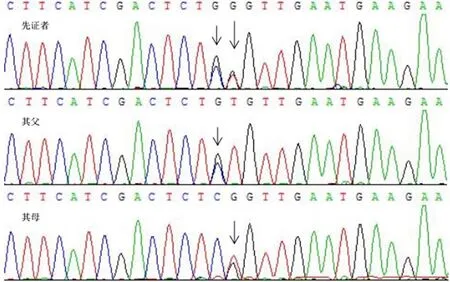
图1 先证者及其父母基因测序结果Figure 1 DNA sequencing validation of LPL gene mutation in the proband and her parents
2 讨论
2.1 LPL基因及其突变情况 人LPL基因位于染色体8p22,包含10个外显子及9个内含子,长约35 kb,编码由475个氨基酸组成的LPL,涉及27个氨基酸残基信号肽。LPL基因具有N端区和C端区两个结构域,其中N端区第279~282个及第292~304个氨基酸是LPL肝素结合位点,而C端区LPL肝素结合位点则在第319、403、405、407个及第413~414个氨基酸,且该部位是LPL的催化活性部位。与N端区相比,C端区能更好地增加VLDL、CM与肝素的结合,但与全长LPL基因相比,C端区结合LDL的效率却不到10%[10]。由于LPL基因高度保守的第4~6外显子既是脂质及肝素的结合部位,也是酶的催化活性部位,因此多数LPL基因外显子区错义突变集中在该区域。LPL基因第4~6外显子区位点突变或缺失可导致LPL活性降低或消失,继而引起血三酰甘油水平升高[11]。目前人类基因突变数据库(http://www.hgmd.cf.ac.uk/ac/index.php)已纳入报道过的LPL基因突变221个,其中错义突变147个,移码突变-缺失25个,无义突变17个,剪切突变13个,移码突变-插入9个,深度内含子突变及移码突变-缺失后插入各5个。本例患儿存在LPL基因第6外显子区错义突变c.835C>G和c.836T>G,即C>G和T>G杂合错义突变,进而导致其编码的第279位氨基酸分别由亮氨酸(Leu)错编为缬氨酸(Val)和精氨酸(Arg)。
LPL由脂肪细胞、心肌细胞、骨骼肌细胞及巨噬细胞合成、分泌后会被转运至毛细血管内皮细胞表面,而LPL作为三酰甘油代谢的限速酶会在糖基磷脂酰肌醇固定的高密度脂蛋白结合蛋白(glycosylphosphatidylinositol-anchored high-density lipoprotein-binding protein 1,GPIHBP1)转运下跨过毛细血管内皮细胞到达血管管腔侧,进而水解血循环系统中VLDL、CM中的TG,最终形成FFA并进行储存[12-14]。据统计,>90%的HTG患者存在LPL基因突变[15],LPL单基因缺陷所致HTG发病率为1/100万[7]。
2.2 HTGP的临床特点 因HLP仅与血清三酰甘油水平异常升高相关,与血清总胆固醇水平无关,因此HLP常被称为 HTGP[16]。IPPISCH 等[17]于2020年发表的一项单中心研究结果提示HTG可能是儿童急性胰腺炎的重要诱因,但严重高三酰甘油血症(severe hypertriglyceridemia,SHTG)在儿童中并不常见,且目前尚缺乏相关临床诊治指南。本例患儿急性胰腺炎反复发作期间血三酰甘油均明显升高(≥11.30 mmol/L)且最高达127.51 mmol/L,经排除胆石症、药物、酗酒等引起的急性胰腺炎后最终诊断为HTGP[17-18]。
成人HTGP具有病情重、易反复发作及预后差(病死率高)等临床特点。一项包含3 558例急性胰腺炎患者的研究表明,HTGP患者(n=623)胰腺坏死发生率(28.3%比18.1%)、器官衰竭发生率(35.8%比29.1%)及持续性器官衰竭发生率(24.4%比16.5%)均明显高于非HTGP患者(n=2 935),提示HTGP患者与非HTGP患者相比存在病情重症化及更差的临床预后[19]。另有研究表明,HTGP患者急性胰腺炎复发率高于非HTGP患者,尤其是胆源性胰腺炎患者[20]。
2.3 HTGP的发病机制 近年来,成人HTGP发病率逐年升高,但目前关于儿童HTGP患病率及其病因的临床研究报道较少[21],且虽然已明确HTG是导致急性胰腺炎的直接原因之一,但HTGP的确切发病机制仍未能完全阐明。HTGP相关机制研究理论主要包括FFA假说、胰腺组织微循环障碍、蛋白激酶C活化、炎性反应及遗传学因素等[22-23]。
2016年发表的一项回顾性研究在30 623例来自三级儿童医院的儿童中发现36例(平均每千例中有1例)极度高三酰甘油血症(extreme hypertriglyceridemia,eHTG,血清三酰甘油水平≥2 000 mg/dl)患儿,其中12例曾患有急性胰腺炎,且多数患儿为继发性,如糖尿病控制欠佳(30%)、采用L-天冬酰胺酶和大剂量类固醇皮质激素治疗的急性淋巴细胞白血病(28%)、实体器官移植后采用西罗莫司/他克莫司治疗(14%)、家族性高乳糜微粒血症(familial hyperchylomicronemia,FCS)(14%)等[19]。RICHARDSON等[24]通过对124例SHTG(血三酰甘油>1 000 mg/dl)患儿的病因进行分析发现,其中48例合并血液系统肿瘤,46例合并糖尿病和胰岛素抵抗,12例合并肾脏疾病,6例进行肠胃外营养支持,12例存在其他疾病;而在11例急性胰腺炎患儿中,5例合并糖尿病,3例合并血液系统肿瘤病,3例进行肠胃外营养支持,但未发现基因突变者。
此外,鉴于>90%的HTG患者存在LPL基因突变,因此在首次诊治伴有HTG的ARP患者时应高度关注其基因突变情况,但儿童与成人ARP的遗传因素可能存在差异。XIAO等[25]研究表明,ARP及慢性胰腺炎患儿CFTR、SPINK1、PRSS1、CTSB、CASR基因突变发生率为65%;ABU-EL-HAIJA等[26]在31例ARP患儿中发现16例(52%)存在基因突变且SPINK1基因突变与ARP的发展密切相关,提示遗传学因素在首次胰腺炎发作进展为ARP过程中发挥着重要作用。
2.4 病例反思及HTGP的临床诊疗思路 本例患儿血三酰甘油最高达127.51 mmol/L,血标本浑浊、呈现奶酪样改变,伴血总胆固醇升高及反复发作的急性胰腺炎,但无黄色瘤、肝脾大、视网膜脂血症等脂质沉积表现,经排除肥胖、肾病、甲状腺功能减退症、药物及糖尿病等引起的继发性高脂血症后考虑为罕见的LPL单基因缺陷所致FCS。此外,本例患儿急性胰腺炎反复发作过程中伴有低钠血症,考虑为血脂容积效应引起的假性低钠血症(血钠较实际值低10 mmol/L)[27]。有学者认为低钠血症是区分HTGP与其他类型急性胰腺炎的有效指标之一,且低钠血症(血钠<130 mmol/L)预测HTGP患者预后的受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)下面积为0.926,预测价值良好,因此初始血钠可能是诊断HTGP的第一个线索,也可能为HTGP患者风险分层及治疗方案的制定提供一定的依据[28]。
SCHAEFER等[27]研究认为HTGP患者血、尿淀粉酶通常无明显升高且>50%的HTGP患者入院时血淀粉酶正常或接近正常,但假性血、尿淀粉酶正常也是HTGP患者临床特点之一,且血脂肪酶相较于血淀粉酶诊断HTGP的灵敏度和特异度更高[20,23]。本例患儿急性胰腺炎反复发作过程中伴有血脂肪酶较淀粉酶明显升高现象。
鉴于HTG是导致急性胰腺炎患者病情恶化的诱因和病因,且HTG与急性胰腺炎互为因果,因此应在疾病早期尽快控制三酰甘油水平以阻断三酰甘油及炎症形成的恶性循环,进而减轻患者病情严重程度、改善患者预后[20],但目前尚无关于儿童HTGP的临床诊治指南,也无可指导SHTG治疗的儿科学指南。RAWLA等[29]于2018年总结了HTGP的治疗和预防策略,其中常规治疗包括禁食、去除诱因、营养支持、液体管理、抗炎、抑制胰腺分泌等,急性期治疗方法为血液净化/血浆置换或胰岛素或肝素或胰岛素+肝素;预防分为药物干预(包括贝特类药物、烟酸、ω-3 脂肪酸)和非药物干预(包括控制体质量、控制饮食及严格控制血糖)两部分。此外,患者明确诊断为HTGP且在病情允许情况下早期的规范降脂治疗也被临床广泛认可,常用降脂药物包括贝特类药物、烟酸及ω-3 脂肪酸,而在血三酰甘油降低幅度方面,贝特类药物、烟酸、ω-3 脂肪酸分别为25%~50%、35%、30%~40%[30]。本例患儿急性胰腺炎反复发作过程中血三酰甘油明显升高,入院后经常规治疗及降脂治疗后临床症状明显缓解,出院后继续严格控制饮食并行降脂治疗、定期随访。
综上所述,儿童HTGP在临床上较少见,而儿童eHTG的发生可能与基因突变有关,应借助基因检测技术尽早明确诊断;虽然目前尚缺乏儿童HTGP临床诊治指南,但由于血三酰甘油水平异常升高与急性胰腺炎反复发作密切相关,因此早期规范的降脂治疗仍是治疗儿童HTGP及防止急性胰腺炎反复发作的关键。
作者贡献:许锦平、陈先睿进行文章的构思与设计,对文章整体负责,监督管理;许锦平进行文献/资料收集、整理并撰写论文;白海涛、姚拥华、陈先睿进行论文的修订,负责文章的质量控制及审校。
本研究经厦门大学附属第一医院医学伦理委员会审核批准〔审批号:[2020]科研伦审字(013)号〕,无利益冲突。

