白藜芦醇通过调控microRNA-506/sphingosine kinase 1抑制非小细胞肺癌细胞的增殖及促进其凋亡①
黎展华 周继红 陈斯宁 潘玲 冯原 罗美群 李瑞祥 王浩舟 刘剑
(广西中医药大学附属瑞康医院,南宁 530021)
肺癌是世界范围内发病率与病死率居首位的恶性肿瘤,全世界的年发病人数约为123万[1‐2]。其中85%的肺癌为非小细胞肺癌(non‐small cell lung cancer,NSCLC)。目前对NSCLC的主要治疗手段为手术、物理疗法、放疗和化疗,但总体治疗效果差强人意,因此开发出安全高效的肺癌治疗药物乃是当前肺癌研究的热点之一[3‐4]。
天然来源的小分子白藜芦醇(resveratrol)具有结构简单、毒性小等特点,可以通过多种途径抑制肿瘤细胞增殖并诱导凋亡,已被证实具有较为肯定的抗肿瘤作用,但具体的作用机制尚未完全阐明[5]。
microRNA在肿瘤中的作用类似于癌基因或抑癌基因,通过调节多个靶基因影响多种信号通路,调节一系列肿瘤细胞的功能如增殖、凋亡、侵袭和分化[6‐7]。在我们的前期研究中,microRNA506(miR‐506)在肺癌细胞及肺癌组织中表达明显减少[8]。鞘氨醇激酶1(sphingosine kinase 1,SPHK1)是一种高度保守的脂酶,是调控神经酰胺/1‐磷酸鞘氨醇的限速酶。SPHK1作为一个致癌激酶在多种癌症中被显著上调,它与癌症的发展和侵袭密切相关[9‐10]。在我们的前期研究中,qRT‐PCR、免疫印迹和荧光素酶报告基因的结果表明SPHK1是miR‐506的一个直接靶点;通过作用于SPHK1,miR‐506的上调可以抑制NSCLC的细胞增殖、侵袭,并且促进NSCLC细胞的凋亡[8]。
本研究通过探讨白藜芦醇对人肺腺癌细胞(A549细胞)增殖、周期、凋亡的影响以及白藜芦醇对miR‐506、SPHK1的影响,进一步探索白藜芦醇抑制NSCLC的作用机制,为白藜芦醇在NSCLC治疗方面提供新的思路与实验基础。
1 材料与方法
1.1 材料人肺腺癌A549细胞(货号:NA)购自上海细胞库。白藜芦醇(分子质量228 g/mol,纯度>99.99%,货号:501‐36‐0)购自上海麦克林公司。DMEMH培养基(货号:12100046)、胎牛血清(货号:10270‐106)购自美国Gibco公司。QuantiNova SYBR(货号:208054)购自德国QIAGEN公司。CCK‐8试剂盒(货号:CK04)购自上海Dojindo公司。hsa‐miR‐506‐3p inhibitor购 自 吉 玛 基 因。Green PCR Kit(500T,货号:D7268M)购自上海碧云天公司。First strand cDNA synthesis kit(货号:K1622)购自美国Thermo公司。FITC Annexin V(货号:556547)购自美国BD Biosciences公 司。HRP‐Conjugated GAPDH Antibody(货号:HRP‐60004)、HRP‐Conjugated Beta Actin Antibody(货号:HRP‐60008)购自美国Potein-tech公司。Anti‐Mouse IgG(Fc specific)‐Peroxidase antibody produced in goat(货号:A2554‐1ml)购自美国Sigma公司。Anti‐rabbit IgG、HRP‐linked Antibody#7074(货号:7074S)购自美国CST公司。Anti‐SPHK1 antibody(货号:Ab71700)购自英国Abcam公司。
1.2 方法
1.2.1 细胞培养A549细胞用含10%胎牛血清的DMEMH培养基接种于培养瓶中,于37℃,5%CO2培养箱中培养。
1.2.2 细胞分组培养及药物干预
1.2.2.1 细胞增殖、细胞周期及细胞凋亡实验将A549细胞接种于细胞培养板中分为以下各组(白藜芦醇干预24 h和48 h两个时间点):①空白对照组:A549细胞单纯培养;②白藜芦醇30µmol/L组:A549细胞使用浓度为30µmol/L的白藜芦醇干预24 h或48 h;③白藜芦醇50µmol/L组:A549细胞使用浓度为50µmol/L的白藜芦醇干预24 h或48 h;④白藜芦醇100µmol/L组:A549细胞使用浓度为100µmol/L的白藜芦醇干预24 h或48 h。
1.2.2.2 miR‐506、SPHK1实验根据说明书使用脂质体转染miR‐506‐inhibitor至A549细胞,然后将A549细胞接种于6孔板中并分为以下各组(白藜芦醇干预24 h和48 h两个时间点):①空白对照组:A549细胞单纯培养;②A549细胞(miR‐506‐inhibi-tor)组:转染miR‐506‐inhibitor的A549细胞单纯培养;③白藜芦醇30 µmol/L(miR‐506‐inhibitor)组:A549细胞(miR‐506‐inhibitor)使用浓度为30µmol/L的白藜芦醇干预24 h或48 h;④白藜芦醇50µmol/L(miR‐506‐inhibitor)组:A549细 胞(miR‐506‐inhibi-tor)使用浓度为50 µmol/L的白藜芦醇干预24 h或48 h;⑤白 藜芦醇100 µmol/L(miR‐506‐inhibitor)组:A549细 胞(miR‐506‐inhibitor)使 用 浓 度 为100µmol/L的白藜芦醇干预24 h或48 h。
1.2.3 CCK‐8法检测A549细胞增殖按CCK‐8实验说明书操作,细胞分别孵育24 h、48 h后加入CCK‐8显色液,于培养箱中孵育100 min后细胞培养板置于酶标仪中读取各孔450 nm处吸光度值。每个时间段设置3个复孔,实验重复3次,检测细胞增殖情况。
1.2.4 流式细胞术检测A549细胞周期收集各组细胞,使用70%的甲醇固定,离心,洗涤细胞后加入500µl PI/RNase染料孵育后,使用流式细胞分析仪检测细胞周期,实验重复3次。
1.2.5 流式细胞术检测A549细胞凋亡收集各组细胞,根据实验说明书使用Annexin V‐FITC和PI双标记免疫荧光染色,流式细胞仪激发光波长488 nm,用一波长为515 nm的荧光通道检测FITC荧光,另一波长大于560 nm的荧光通道检测PI值,实验重复3次。
1.2.6 qRT‐PCR检 测A549细 胞miR‐506及SPHK1 miR‐506引 物 序 列:上 游5'‐TATTCAG-GAAGGTGTTACTTAA‐3',下 游5'‐CGCAGGGTCC-GAGGTATTC‐3'。SPHK1引 物 序 列:上 游5'‐GC-GCTTCACTCTGGGCACCTTCC‐3',下游5'‐GTCCTC-GTCGGGCACCACTGTCC‐3'。miR‐506的内参U6引物序列:上游5'‐CTCGCTTCGGCAGCACA‐3',下游5'‐AACGCTTCACGAATTTGCGT‐3'。SPHK1的内参GAPDH引物序列:上游5'‐CAAATTCCATGGCACC-GTCA‐3',下游5'‐GACTCCACGACGTACTCAGC‐3'。收集各组细胞,根据说明书裂解细胞,提取RNA,逆转录cDNA。实时荧光定量PCR扩增程序:95℃预变性2 min,95℃变性5 s,60℃退火30 s,共40个循环。采用2-ΔΔCt方法计算相对表达量,每个样品设3个复孔。
1.2.7 Western blot检测A549细胞SPHK1收集各组细胞,加入RIPA裂解液及蛋白酶抑制剂,按照使用说明书提取蛋白,BCA试剂盒检测蛋白浓度,煮沸使蛋白变性,按照凝胶试剂说明书及检测指标的分子量大小,配置相应浓度的蛋白胶,上样,电泳,转膜,封闭,按照抗体说明书推荐的稀释比,稀释相应抗体,SPHK1一抗室温摇床孵育2 h,HRP标记的二抗室温摇床孵育1 h,ECL化学发光显影,用Image J软件对目的条带进行灰度值计算,蛋白相对表达水平=目的条带灰度值/GAPDH条带灰度值。每个样品设3个复孔。
1.3 统计学处理采用SPSS22.0软件进行统计分析,数据以±s表示,组间比较采用单因素方差分析,方差不齐则采用秩和检验。检验水平以P<0.05为差异具有统计学意义。
2 结果
2.1 白藜芦醇抑制A549细胞增殖CCK‐8实验结果显示:各白藜芦醇干预组对A549细胞的增殖均有抑制作用,与对照组相比,差异均有统计学意义(P<0.05)。并且白藜芦醇对A549细胞的增殖作用和白藜芦醇的药物浓度及干预时间密切相关。其中30 µmol/L的白藜芦醇干预24 h对A549细胞的抑制作用最弱,100 µmol/L的白藜芦醇干预48 h对A549细胞的抑制作用最明显。见图1。
2.2 白藜芦醇对A549细胞周期的影响流式细胞仪检测A549细胞的细胞周期,结果显示与对照组相比,白藜芦醇干预A549细胞后使大部分细胞的细胞周期停滞在G0‐G1阶段,少部分细胞停滞在G2‐M阶段和S阶段,并且白藜芦醇对A549细胞周期的影响在48 h更明显,差异均有统计学意义(P<0.05)。见图2。
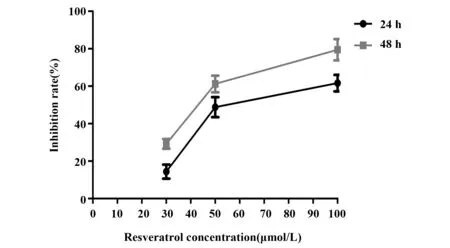
图1 白藜芦醇抑制A549细胞增殖的抑制率Fig.1 Inhibition rate of A549 cultivated with resveratrol
2.3 白藜芦醇对A549细胞凋亡的影响流式细胞仪检测A549细胞的凋亡情况,结果显示:各白藜芦醇干预组均能诱导A549细胞的凋亡,与对照组相比,差异均有统计学意义(P<0.05)。其中100µmol/L的白藜芦醇干预A549细胞48 h组凋亡的细胞数量最多,呈现浓度时间依赖性。见图3。
2.4 白藜芦醇对A549细胞miR‐506表达的影响qRT‐PCR法检测A549细胞miR‐506表达情况,结果显示:白藜芦醇干预A549细胞后,使A549细胞中的miR‐506表达明显上调,与对照组相比,差异有统计学意义(P<0.05)。白藜芦醇干预A549细胞24 h时间点,100µmol/L浓度组上调miR‐506的表达量最多;白藜芦醇干预A549细胞48 h时间点,30µmol/L浓度组上调miR‐506的表达量最多。miR‐506‐in-hibitor转染A549细胞后使miR‐506的表达量下降,使用白藜芦醇干预miR‐506‐inhibitor转染的A549细胞后,miR‐506表达量明显上调,差异具有统计学意义(P<0.05)。见图4、5。
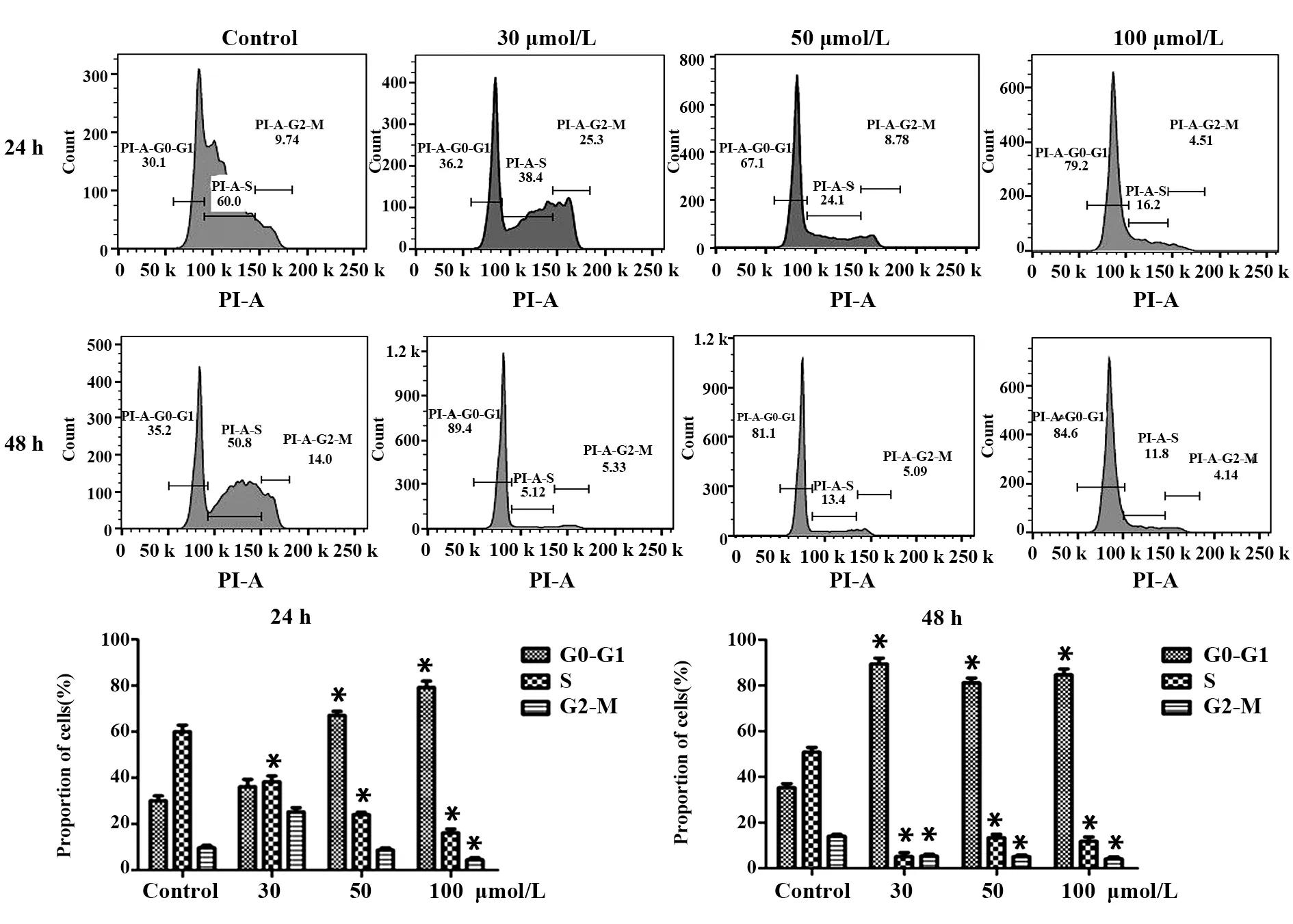
图2 流式细胞术检测白藜芦醇对A549细胞周期的影响Fig.2 Effects of resveratrol on A549 cell cycle tested by flow cytometry
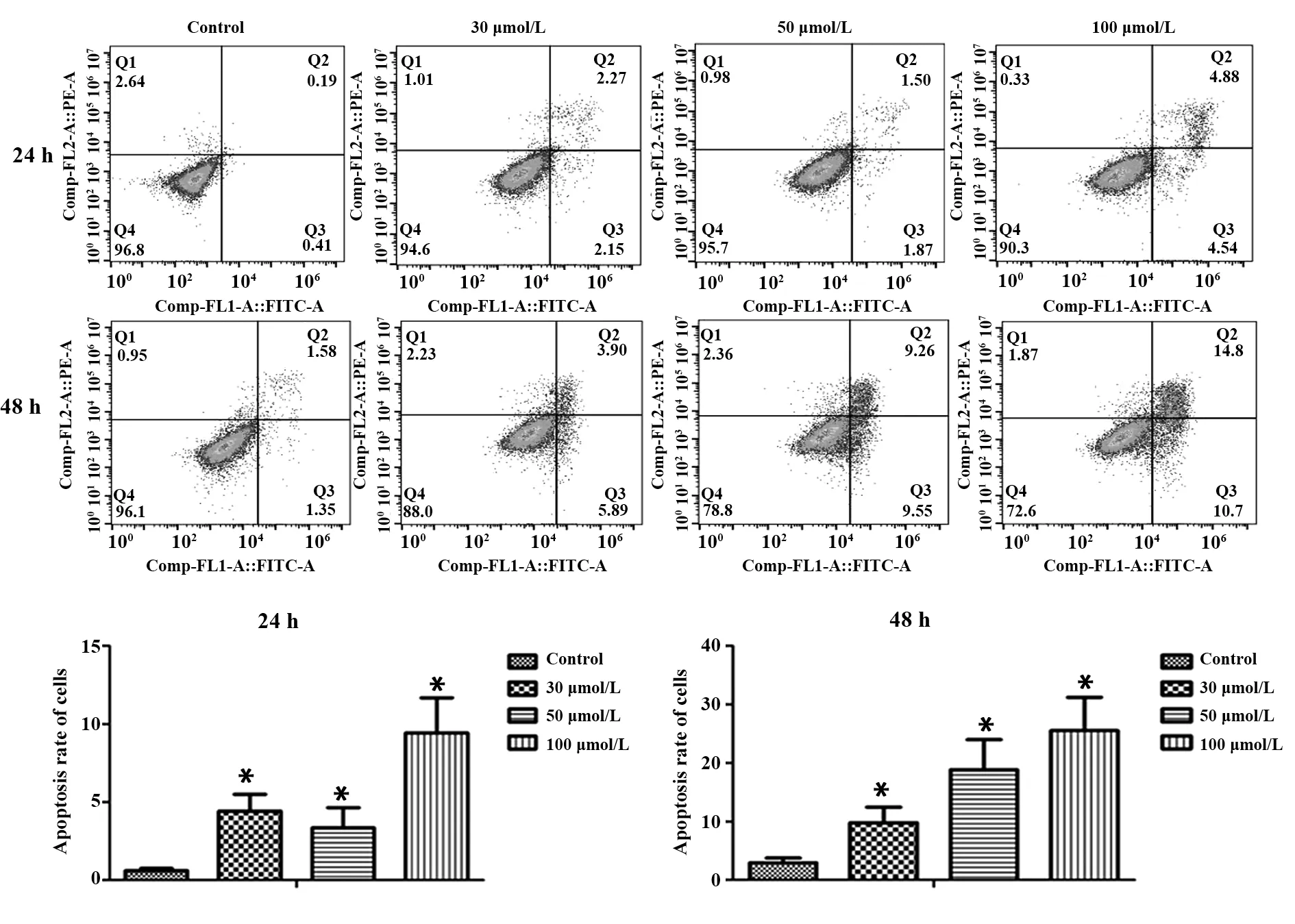
图3 流式细胞术检测白藜芦醇对A549细胞凋亡的影响Fig.3 Effect of resveratrol on A549 cell apoptosis tested by flow cytometry
2.5 白藜芦醇对A549细胞SPHK1 mRNA表达的影响qRT‐PCR法检测A549细胞SPHK1 mRNA表达情况,结果显示白藜芦醇干预A549细胞后,可以使SPHK1 mRNA的表达下调,差异有统计学意义(P<0.05)。在miR‐506‐inhibitor转染组,沉默miR‐506使SPHK1 mRNA表达明显上调,差异有统计学意义(P<0.05)。但白藜芦醇干预miR‐506‐inhibitor转染的细胞后能够使SPHK1 mRNA表达明显下降,差异有统计学意义(P<0.05)。见图6、7。
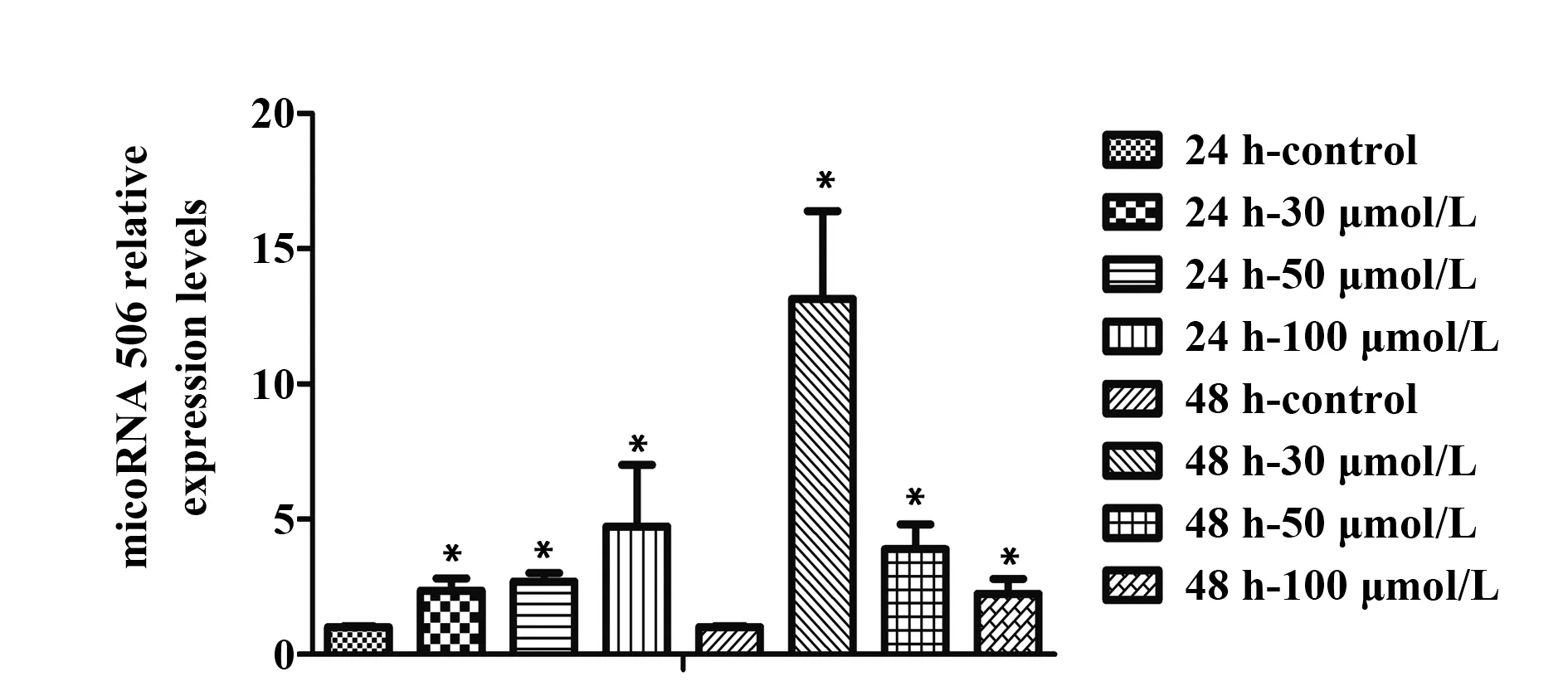
图4 qRT‐PCR检测白藜芦醇对A549细胞miR‐506的影响Fig.4 Effect of resveratrol on miR‐506 in A549 cells de-tected by qRT‐PCR

图5 qRT‐PCR检测白藜芦醇对转染miR‐506‐inhibitor的A549细胞miR‐506的影响Fig.5 Effect of resveratrol on miR‐506‐inhibitor trans-fected A549 cells detected by qRT‐PCR
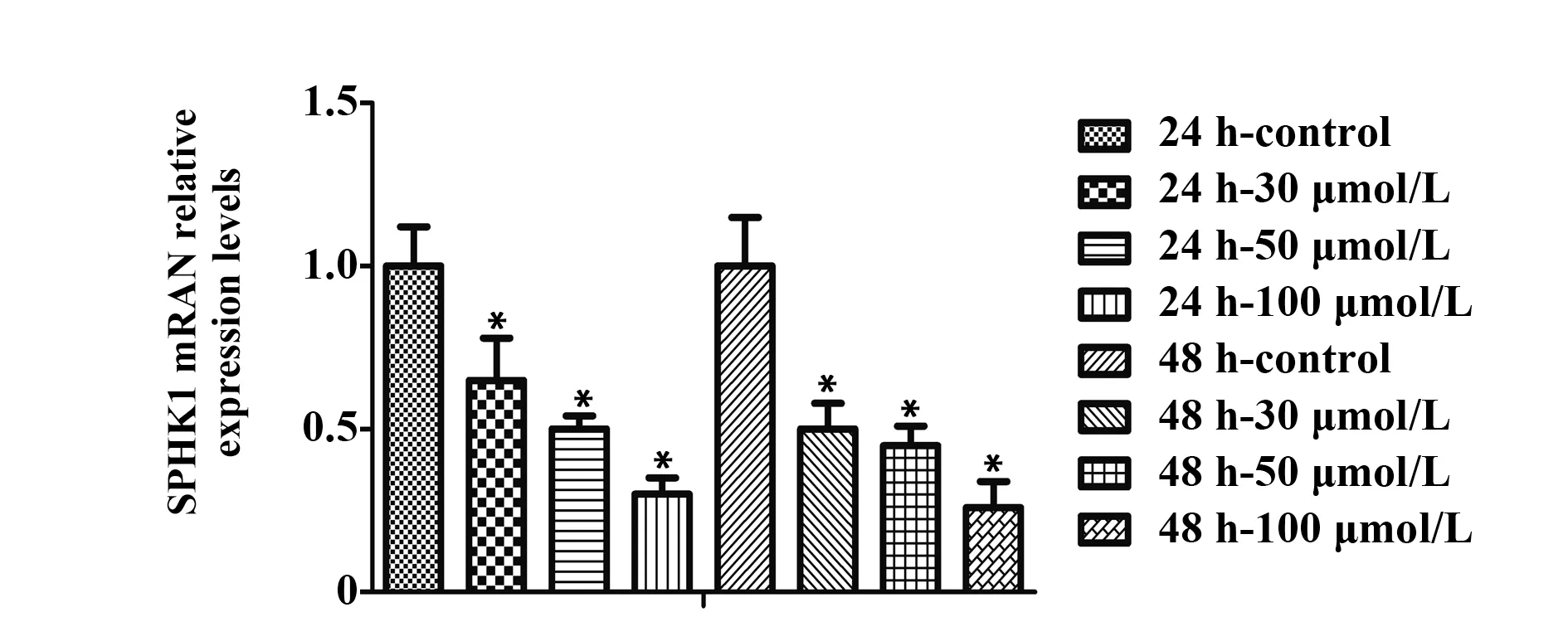
图6 qRT‐PCR检测白藜芦醇对A549细胞SPHK1 mRNA的影响Fig.6 Effect of resveratrol on SPHK1 mRNA expression in A549 cells by qRT‐PCR
2.6 白藜芦醇对A549细胞SPHK1蛋白表达的影响Western blot法检测A549细胞SPHK1蛋白表达情况,结果显示白藜芦醇干预A549细胞后,SPHK1蛋白表达水平降低,与对照组相比,差异有统计学意义(P<0.05)。在miR‐506‐inhibitor转染组,沉默miR‐506后SPHK1蛋白表达与对照组相比无明显统计学差异(P>0.05)。但白藜芦醇干预miR‐506‐in-hibitor转染的细胞能够使SPHK1蛋白表达明显下降,差异有统计学意义(P<0.05)。见图8、9。

图7 qRT‐PCR检测白藜芦醇对转染miR‐506‐inhibitor的A549细胞SPHK1 mRNA的影响Fig.7 Effect of resveratrol on mRNA expression of SPHK1 in A549 cells transfected with miR‐506‐in-hibitor by qRT‐PCR
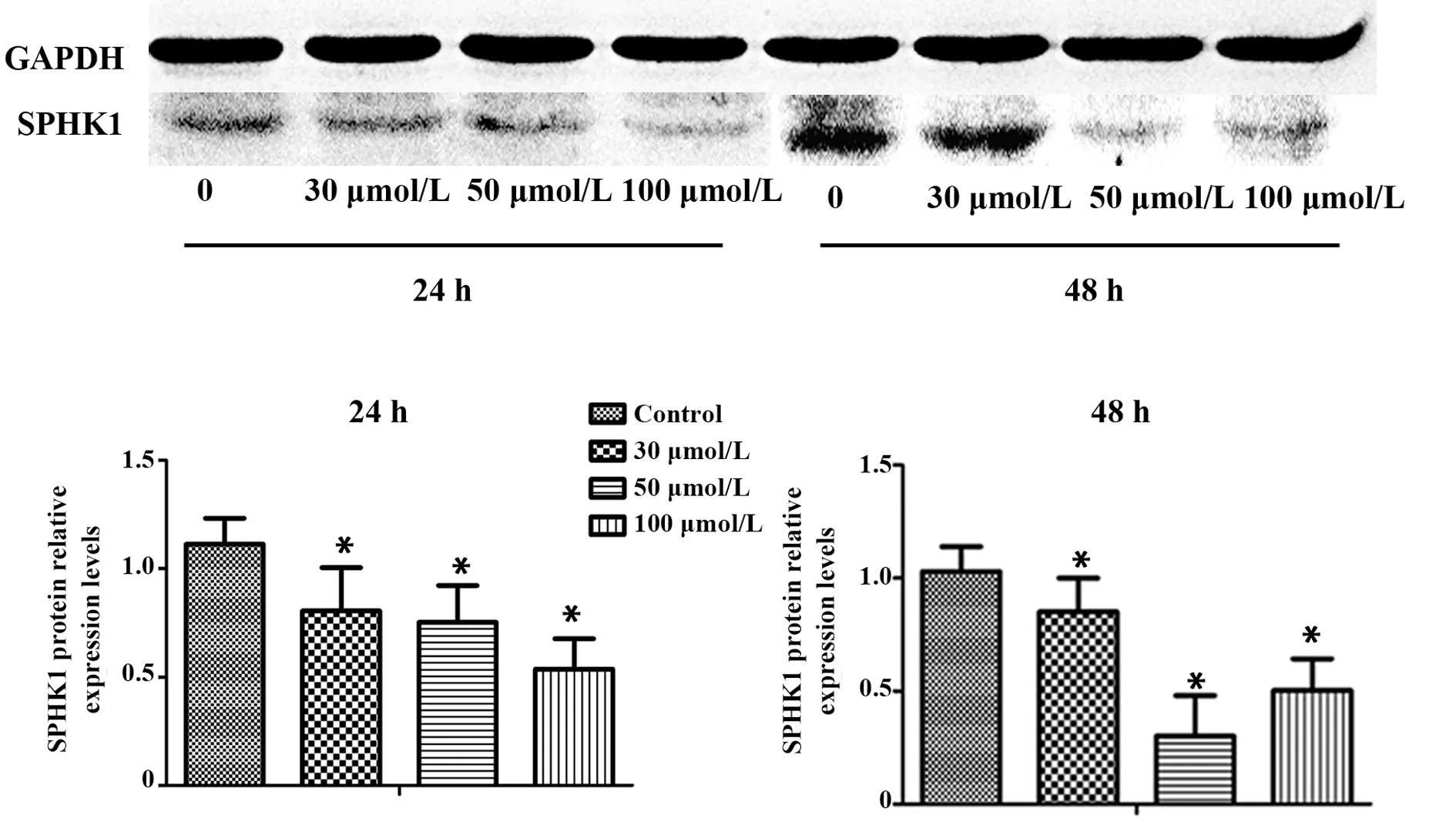
图8 Western blot检测白藜芦醇对A549细胞SPHK1蛋白的影响Fig.8 Effect of resveratrol on SPHK1 protein in A549 cells by Western blot
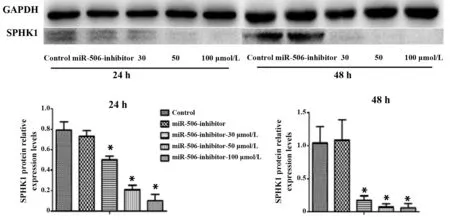
图9 Western blot检测白藜芦醇对转染miR‐506‐inhibitor的A549细胞SPHK1的蛋白的影响Fig.9 Effect of resveratrol on expression of SPHK1 pro-tein in A549 cells transfected with miR‐506‐inhibi-tor by Western blot
3 讨论
已有研究表明,白藜芦醇可以抑制人类宫颈癌细胞、白血病细胞、肝癌细胞、胃癌细胞、肺癌细胞在内的多种肿瘤细胞的生长且诱导肿瘤细胞凋亡[11‐14]。YU等[15]的研究发现白藜芦醇通过抑制miR‐520‐h‐PP2A/C‐Akt‐NF‐B‐grade FOXC2通路从而抑制肺癌细胞的增殖。另一项研究中,BAE等[16]通过miRNA表达谱研究发现白藜芦醇干预A549细胞后能使71个miRNAs的表达量增加,并且这些miRNAs直接影响肺癌细胞的增殖、分化、侵袭和凋亡。
在我们的前期研究中,miR‐506的表达量在NSCLC中明显减少[8]。上调miR‐506可以有效抑制NSCLC的增殖及侵袭,MMP‐9和MMP‐2的表达也明显被抑制[8]。此外,还发现SPHK1是miR‐506的一个直接靶点,通过作用于SPHK1,miR‐506的上调可以抑制NSCLC细胞的增殖、侵袭,并且促进NSCLC的凋亡[8]。
目前白藜芦醇治疗NSCLC的机制尚未完全阐明,我们的实验首先证实了白藜芦醇能够抑制A549细胞的增殖及诱导A549细胞的凋亡,并且白藜芦醇抑制A549细胞增殖及促进其凋亡具有浓度和时间依赖性。白藜芦醇干预后大部分A549细胞的细胞周期停滞在G0‐G1阶段。qRT‐PCR结果显示白藜芦醇干预组均能使A549细胞的miR‐506表达量上调;使用miR‐506‐shRNA转染沉默miR‐506后,白藜芦醇亦能明显提高miR‐506的表达;总的来说白藜芦醇能有效提高miR‐506的表达量。TIAN等[17]研究发现白藜芦醇可能通过调控SPHK1/(sphingosine‐1‐phosphate,S1P)通路和神经酰胺表达量从而抑制白血病细胞株K562的增殖及诱导其凋亡。我们通过qRT‐PCR及Western blot实验检测A549细胞的SPHK1,结果显示白藜芦醇干预A549细胞后SPHK1,mRNA表达量较对照组明显减少,白藜芦醇干预A549细胞后SPHK1蛋白表达量亦较对照组明显减少,该实验结果和TIAN等[12]的研究结果一致;并且使用miR‐506‐inhibitor转染沉默miR‐506后白藜 芦 醇 干 预miR‐506‐inhibitor转 染 组SPHK1的mRNA及蛋白表达量均明显下降,大体上说明白藜芦醇可以抑制A549细胞的SPHK1表达。结果表明白藜芦醇可能通过调控miR‐506和SPHK1从而抑制A549细胞的增殖且促进其凋亡。
LI等[18]的 研 究 表 明 上 调miR‐506可 能 通 过SPHK1/Akt/NF‐κB通路抑制胰腺癌的进展且降低其耐药性,提示在胰腺癌中SPHK1是miR‐506的调控靶点。我们的前期研究与其他研究均表明,上调miR‐506可以通过作用于SPHK1逆转NSCLC和胰腺癌的增殖且促进其凋亡[8,18]。在本研究中白藜芦醇可以抑制A549细胞的增殖同时诱导其凋亡,此外白藜芦醇可以上调miR‐506和降低SPHK1的表达水平,因此我们认为白藜芦醇可以通过靶向调控miR‐506/SPHK1从而有效抑制NSCLC。
综上所述,白藜芦醇可以抑制人肺腺癌A549细胞的增殖和诱导细胞凋亡,上述作用的强弱与白藜芦醇的药物浓度及白藜芦醇的作用时间密切相关;通过进一步的机制研究发现白藜芦醇通过提高miR‐506的表达从而抑制SPHK1的表达进而抑制A549细胞的增殖且诱导其凋亡。miR‐506/SPHK1信号通路可能是白藜芦醇发挥抗肿瘤作用的机制之一,为白藜芦醇的抗肿瘤治疗提供新的理论依据。