银屑病中免疫抑制性细胞及中医药对其调控作用的研究进展①
侯怡飞 苏琳 邹纯朴 陈晓 张慧敏 胥孜杭(上海中医药大学基础医学院,上海 201203)
银屑病是一种常见的、难以根治且易复发的皮肤病,影响全世界约1.25亿人,以皮肤出现明显红斑、脱屑,甚至干燥出血为主要临床表现,民间俗称“牛皮癣”,给患者造成巨大的身心负担,并严重影响其生活质量[1‐2]。银屑病的主要病理特征表现为T细胞亚型(如Th17细胞、Th1细胞等)过度激活所介导的异常免疫应答[3]。在机体的免疫系统内,免疫抑制性细胞主要包括MDSCs、Tregs、Bregs、Mφ等,它们发挥着维持免疫稳态的调节作用,可以预防效应免疫细胞的异常活化和增殖。以往对此类细胞的关注点主要聚焦于肿瘤微环境中,因为大量研究表明免疫抑制性细胞在肿瘤微环境中直接或间接发挥强大的以T细胞为主的免疫抑制作用并介导肿瘤免疫逃逸[4]。然而,近年来在国际上,越来越多的报道显示银屑病中免疫抑制性细胞的募集及其功能存在异常[5],但根据文献检索发现,国内对于免疫抑制性细胞在银屑病中的分子机制的相关探讨明显匮乏,特别是中医药在这方面的研究尤为不足。中医药治疗疾病是以促进机体恢复或维持“阴平阳秘”(阴阳平衡)的状态为宗旨,并且越来越多的基础和临床研究表明,中医药对机体免疫系统具有独特的调控优势[6‐7]。故本文以此为切入点,探讨包括MDSCs、Tregs、Bregs、Mφ等在内的免疫抑制性细胞在银屑病中的异常募集和功能变化及中医药对此类细胞的调节作用,以期为银屑病的中西临床治疗提供新思路。
1 MDSCs在银屑病中的募集增多及其免疫抑制活性受限
1.1 在银屑病中MDSCs被大量招募1990年末,BRONTE和GABRILOVICH将小鼠体内具有CD11b+Gr1+表型及免疫抑制功能的细胞定义为MD-SCs,基于此细胞群的髓系来源和免疫抑制活性的特征而命名为髓源抑制细胞。MDSCs主要有两大亚型,分别是粒细胞样‐髓源抑制细胞(PMN‐MD-SCs)和单核细胞样‐髓源抑制细胞(M‐MDSCs)。目前对于MDSCs的深入研究主要聚焦于肿瘤微环境。在肿瘤患者中,MDSCs被大量募集到肿瘤部位,主要发挥对T细胞(尤其是细胞毒性T细胞,即CD8+T细胞)的抑制作用并介导肿瘤免疫逃逸,因此MD-SCs的异常募集通常被认为是肿瘤的不良预后指标[8‐9]。然而近年来有研究发现在银屑病患者的外周血中,MDSCs亦被大量招募[10‐12];另有研究证明在银屑病患者病变皮肤中,MDSCs的积累也同样显著上调[13]。由此可见,与肿瘤微环境中的MDSCs的募集相似,银屑病患者的外周血和病变皮肤中MDSCs的数量显著增多,然而这类MDSCs是否具有与肿瘤微环境中的MDSCs一样强大的免疫抑制活性目前尚不清楚。
1.2 银屑病中的MDSCs免疫抑制活性被下调近年来,大量研究显示银屑病的发生发展与T细胞的过度活化密切相关,特别是IL‐23/Th17轴在银屑病发病机制中的作用越来越受到关注[14‐16]。众所周知,MDSCs在肿瘤微环境中主要通过表达高水平的精氨酸1(arginine 1,Arg1)、一氧化氮合酶(nitric oxide synthase,iNOS)等或以细胞接触的方式发挥免疫抑制活性,其主要靶标是T细胞[17]。然而越来越多的证据显示,与肿瘤微环境甚至正常健康机体中的MDSCs相比,银屑病患者中的MDSCs虽明显增多,但其对T细胞的免疫抑制能力却大幅下降。研究表明,相较于健康者,银屑病患者外周血中提取的M‐MDSCs直接抑制CD8+T细胞增殖的效率更低。此外,银屑病患者的M‐MDSCs减少了程序性细胞死亡蛋白‐1(programmed cell death protein‐1,PD‐1)的表面表达,并且抗炎细胞因子IL‐10的产量亦降低,说明MDSCs对T细胞的免疫抑制活性降低。体外实验表明,银屑病组和健康对照组M‐MDSCs均可诱导幼稚T效应细胞向Tregs转化,但不同的是,与健康对照组相比,银屑病组M‐MDSCs诱导的Tregs抑制功能却明显下调[10‐11]。此外,还有研究显示银屑病患者外周血中的MDSCs具有表面蛋白DC‐HIL的特异表达,与肿瘤(黑色素瘤)微环境中的MDSCs相比,抑制活性大幅降低且使用Arg1抑制剂、iNOS抑制剂、抗IL‐17A抗体等分别能在不同情况下逆转其抑制功能,说明银屑病中MDSCs在发挥其免疫抑制功能时亦可能具有异质性[12]。由此可见,银屑病机体外周血及病变皮肤中MDSCs数量虽然增多,但其活性的下调会显著降低对过度激活的T细胞的免疫抑制作用,妨碍免疫系统正常自我调节的能力,从而加速银屑病的进展。
1.3 在银屑病中靶向MDSCs的免疫疗法随着精准医学概念的提出,靶向治疗逐渐成为疾病最有效的治疗方式之一,其中免疫疗法越来越受到重视。在实验室研究中,通过靶向MDSCs以扭转银屑病进程的免疫疗法开始受到关注。使用粒细胞‐巨噬细胞集落刺激因子(GM‐CSF)等诱导骨髓细胞分化为MDSCs,通过尾静脉将MDSCs过继转移到小鼠体内,可明显改善咪喹莫特(IMQ)诱导的银屑病小鼠背部皮肤红斑、脱屑和增厚等症状,降低相关炎症因子(如TNF‐α、IL‐17A和IL‐23等)的表达,下调异常激活的辅助性T细胞(如Th1和Th17等)数量,并增加其他免疫抑制性细胞如Tregs的数量[18]。MDSCs过继转移治疗明显提高了他克莫司(治疗银屑病的有效单一疗法)对小鼠银屑病的治疗效果[19]。另外,趋化因子CXCL17通过招募MDSCs进而降低银屑病小鼠耳朵厚度,下调炎症细胞因子表达和浸润性炎症细胞数量,达到改善银屑病的效果[20]。由此可见,MDSCs可以通过发挥其免疫抑制功能阻止银屑病进程,具有抗炎作用。然而在另外一项研究中发现,使用MDSCs抑制剂吉西他滨将小鼠体内的MDSCs耗竭后,Th17细胞的数量反而被显著下调,进而减轻了银屑病症状;据此,MDSCs在该项研究中的作用不再是抑制免疫,而是发挥促炎效应[13]。综上,目前靶向MDSCs治疗银屑病的方法几乎都来自实验室研究,尚未进入临床试验阶段,并且MDSCs在不同的研究中展现出截然相反的作用,促炎亦或抗炎,仍需进一步探索。
2 Tregs在银屑病中呈现多元化募集及抑制活性受限
2.1 在银屑病中Tregs数量变化的多元性Tregs作为免疫抑制性细胞在免疫应答中起负向免疫调节的作用,被定义为CD4+CD25+T细胞,表达转录因子Foxp3,可以抑制T细胞的增殖和活化[21]。Tregs通过多种机制调节免疫应答,例如产生IL‐10和TGF‐β,以及直接的细胞毒性作用等发挥免疫抑制功能[22‐23]。研究表明,Tregs在银屑病患者中的数量增多亦或减少仍然存在争议,在聚焦于银屑病患者外周血的研究中发现,Tregs的数量变化大致存在三种情况:Tregs的百分比降低[24‐27];Tregs的数量并无变化[28‐30];在严重性银屑病中,Tregs会被募集到外周血中,且其增加水平与疾病的严重程度呈正相关[31‐32]。而聚焦于银屑病患者皮损的研究中发现,Tregs在慢性银屑病患者皮肤中募集增加但与疾病严重程度无关,而在急性加重型患者病变皮肤中却呈现减少趋势[29]。此外,Tregs在银屑病不同分型中的募集亦呈现多元化,如在斑块状银屑病中,病变皮肤中的Tregs募集增多,而在滴状银屑病中Tregs募集则减少[33]。这些矛盾的结果可能是由于银屑病的疾病状态、病变斑块内的活检部位以及疾病亚型的不同,导致Tregs在银屑病机体的外周血和皮肤中的积累数量呈现多元性;而其免疫抑制活性是否与前文所述的MDSCs一样也受到限制呢?
2.2 多途径导致Tregs在银屑病中的免疫抑制活性被下调研究表明,与MDSCs类似,Tregs的免疫抑制活性在银屑病中同样降低,但不同的是根据现有的报道,Tregs的免疫抑制活性可通过多种途径被下调,导致其不能有效抑制过度活化的T细胞(见表1):①在银屑病外周血和病变皮肤中除了增多的Tregs外,与疾病严重程度相关的Th17∶Tregs比率亦增加,表明T细胞亚群的比例失衡可能会限制Tregs的免疫抑制活性[32]。②通过T细胞与Tregs共培养发现,T细胞对银屑病中Tregs细胞免疫抑制的敏感性降低,提示Tregs免疫抑制活性的固有缺陷[32,34]。③严重型银屑病患者外周血中的Tregs同时表达Foxp3和转录因子视黄酸相关的孤儿受体γt(retino-ic acid‐related orphan receptor γt,RORγt),然 而RORγt是Th17细胞的特征性表达,研究表明Tregs中Foxp3∶RORγt的比率降低,使其易分化成为Th17细胞相关表型,因此在银屑病中Foxp3可能已经不是评估Tregs的可靠标记[35]。④研究表明在银屑病小鼠模型中,Tregs细胞上整合素CD18的表达减少导致TGF‐β分泌减少及其功能失调[36]。⑤Tregs抑制功能下调的原因可能还在于银屑病的促炎性环境,Tregs暴露于高水平的促炎因子(IL‐6,IL‐23等)环境中会导致信号传导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)的磷酸化,从而促使Tregs活性降低[37]。⑥腺苷信号传导途径的损伤也可能是导致Tregs抑制功能降低的原因。Tregs同时表达CD39和CD73,并通过腺苷信号传导对T细胞进行免疫抑制。然而在寻常型银屑病患者的Tregs中,CD73表达显著降低,CD73/AMPK途径失活,从而降低了其免疫抑制活性[38]。⑦Tregs在炎症部位归巢效率和趋化性的低下也可能是Tregs不能有效抑制异常活化T细胞的原因之一[39]。⑧皮肤微生物组定植可影响Tregs的发展,并通过在淋巴结和皮肤中诱导抗原特异性Tregs的形成来促进免疫耐受。尽管微生物营养不良是银屑病的一个致病因素,但有关皮肤菌群对Tregs影响的数据研究较少。已有研究表明肠道菌群会显著影响其他疾病中的Tregs,但仍需要进行进一步研究,以确定在皮肤炎症中皮肤菌群与Tregs的相互作用[40]。综上所述,银屑病患者或小鼠模型的外周血及病变皮肤中存在多种下调Tregs免疫抑制活性的途径,同时也充分体现了银屑病中免疫机制的复杂性。
2.3 在银屑病中以Tregs为靶标的免疫治疗相较于仍停留在实验室阶段的MDSCs银屑病免疫研究,针对Tregs的银屑病免疫疗法已拓展至临床试验阶段。在临床研究中发现,通过上调银屑病中Tregs数量和/或功能,可以抑制T细胞的过度增殖和活化。例如,小剂量的IL‐2可选择性激活并扩展Tregs,实现安全有效的银屑病治疗[41]。抗IL‐17A或IL‐23p19抗体可以通过增加Tregs产生IL‐10改善银屑病症状[42]。表观遗传编程对于Tregs谱系的稳定性和功能性至关重要,在银屑病患者中,银屑病组织中的组蛋白去乙酰化酶1(histone deacetylase 1,HDAC‐1)升高,使用HDAC抑制剂Trichostatin‐A已被证明在体外能阻止Tregs对IL‐17表型的可塑性,亦能增加Foxp3表达以及上调Tregs的免疫抑制活性,使通过调节Tregs治疗银屑病成为一种潜在可能[43‐44]。另外,在实验室研究中,维生素D3类似物马沙骨化醇改善银屑病疗效显著,其通过调节Tregs产生IL‐10进而治疗银屑病,并且将马沙骨化醇处理过的小鼠产生的Tregs过继转移到银屑病小鼠中能够明显改善症状[45]。过去十年中已经批准了基于T细胞的细胞疗法,即CAR‐T细胞疗法,用于治疗多种肿瘤[46],那么开发出基于Tregs的细胞疗法进而重新平衡Th17∶Tregs的比率来改善银屑病可能成为一种潜在有效策略,但其诱发其他疾病的风险亦待考察。
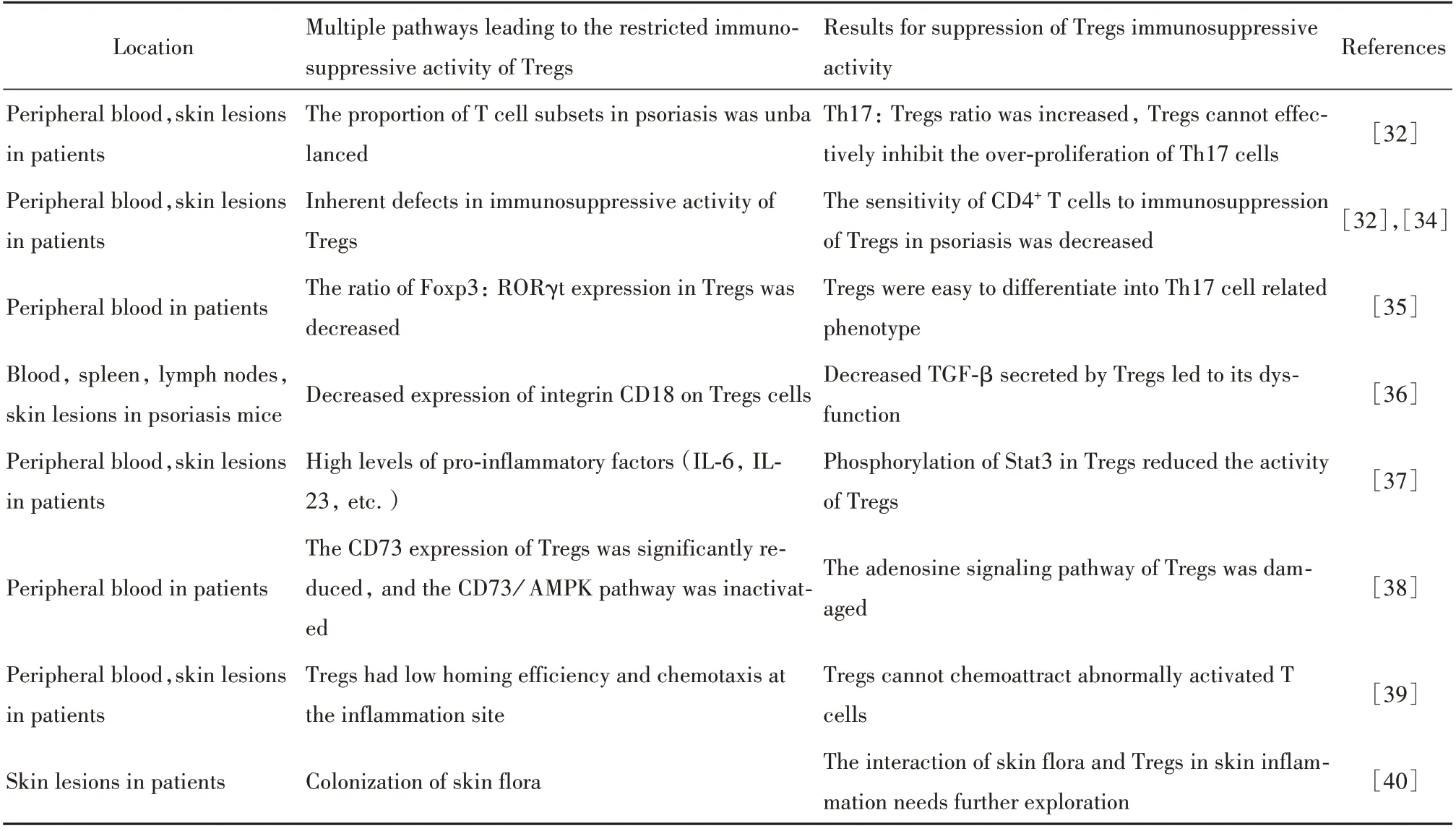
表1 Tregs在银屑病中通过多途径下调其免疫抑制活性Tab.1 Downregulation of immunosuppressive activity of Tregs in psoriasis is regulated by multiple pathways
3 其他免疫抑制性细胞在银屑病中的数量、功能变化
B10细 胞 是Bregs中 能 够分 泌IL‐10的 一类 亚群,具有负向调节炎症反应的功能[47‐48]。B10细胞定义 为CD1highCD5+CD19+CD24highCD38high,以p38和STAT3依赖性方式活化产生IL‐10,进而抑制Th17和Th1细胞[49]。与健康者相比,观察到银屑病患者外周血中B10细胞数量减少,而B10细胞很容易被检测到,这表明银屑病患者的B10分化可能受阻,且免疫抑制功能受损[49]。另有研究显示磷酸二酯酶4抑制剂Apremilast能够上调B10的数量并减少促炎性T细胞的产生,进而改善银屑病,而过继转移B10细胞可以有效治疗脓包型银屑病[50‐52]。由此可见,银屑病中的B10活性也同样受限,对其深入探索将有助于临床治疗银屑病。
Mφ作为免疫应答的第一道防线,通过先天免疫机制保护宿主,不同的刺激环境导致其获得不同的功能特征[53]。MILLS等[54]2000年提出Mφ存在2种主要功能表型:M1(经典激活)和M2(替代激活)。在肿瘤微环境中,M1具有抑制肿瘤发生发展的作用,而M2则能通过调节血管生成及其整体免疫抑制作用等发挥促瘤效应,目前研究主要集中于诱导M2型向M1型的转变进而阻止癌症进程[55]。研究发现银屑病中的Mφ数量在皮肤中上调,不同的是,此类Mφ不但表达M2细胞的标记物(例如CD163),同时还表现经典活化表型,即M1型[56],因此,银屑病皮损中通常含有M1/M2混合表型的Mφ。在体外,IL‐17E主要作用于M2,从而导致促炎细胞因子的分泌和中性粒细胞募集,因此,IL‐17E的抑制剂可能会使Mφ保持M2表型,发挥免疫抑制作用进而治疗银屑病。但在一项研究中表明,在耗竭小鼠皮肤中的巨噬细胞后,其银屑病症状明显减轻[57]。由此可见,Mφ在银屑病中与MDSCs发挥的作用亦有相似之处:即可能发挥抗炎功能改善银屑病症状,又可能发挥促炎功能扩大炎症级联反应而加重银屑病症状。
4 中医药对银屑病中免疫抑制性细胞的调控作用
中医药是我国治疗银屑病的重要手段之一,近年来的研究表明,中医药治疗银屑病的主要优势在于改善机体的内环境,重新平衡机体阴阳气血,促进银屑病中过度激活的免疫反应正常化,达到“阴平阳秘”的阴阳平衡状态,这与现代医学中的“免疫再教育”概念不谋而合。安徽中医药大学使用凉血四物汤治疗寻常型(血热型)银屑病患者,发现在治疗前,银屑病组患者血浆中Tregs的数量比健康对照组低,治疗后患者血浆中Tregs水平上调,取得良好的临床疗效,为凉血四物汤临床治疗银屑病提供了免疫学依据[58]。银屑灵是广东省中医院临床治疗银屑病的有效方,而PSORI‐CM02是从中优化的配方;研究发现,PSORI‐CM02能够平衡银屑病小鼠淋巴结及脾脏中Th17∶Tregs的比例,并抑制皮肤中促炎细胞因子的表达,进而改善银屑病[59]。除此之外,PSORI‐CMO2能够通过调节NF‐κB、STAT1信号通路和STAT6信号通路途径分别改善M1和M2在银屑病中的表达,并且通过上调M2中Arg‐1、IL‐10等基因表达,达到治疗银屑病的目的[60]。另外,市售的银屑胶囊主要成分为丹参、土茯苓等,研究表明其能够增加银屑病小鼠腹腔巨噬细胞的吞噬百分率,进而有效治疗银屑病[61]。文献检索发现,中医药通过调节免疫抑制性细胞治疗银屑病的研究主要集中于以上几种复方,然而中医药有效成分及单体对银屑病中免疫抑制性细胞的调控研究几乎尚未涉及。
综上所述,免疫抑制性细胞数量及其功能在银屑病机体中存在异常表现,可能影响银屑病进程,而临床医学及中医药可通过调节这类细胞的数量或功能活性促使其免疫正常化,进而达到治疗银屑病的目的(表2)。
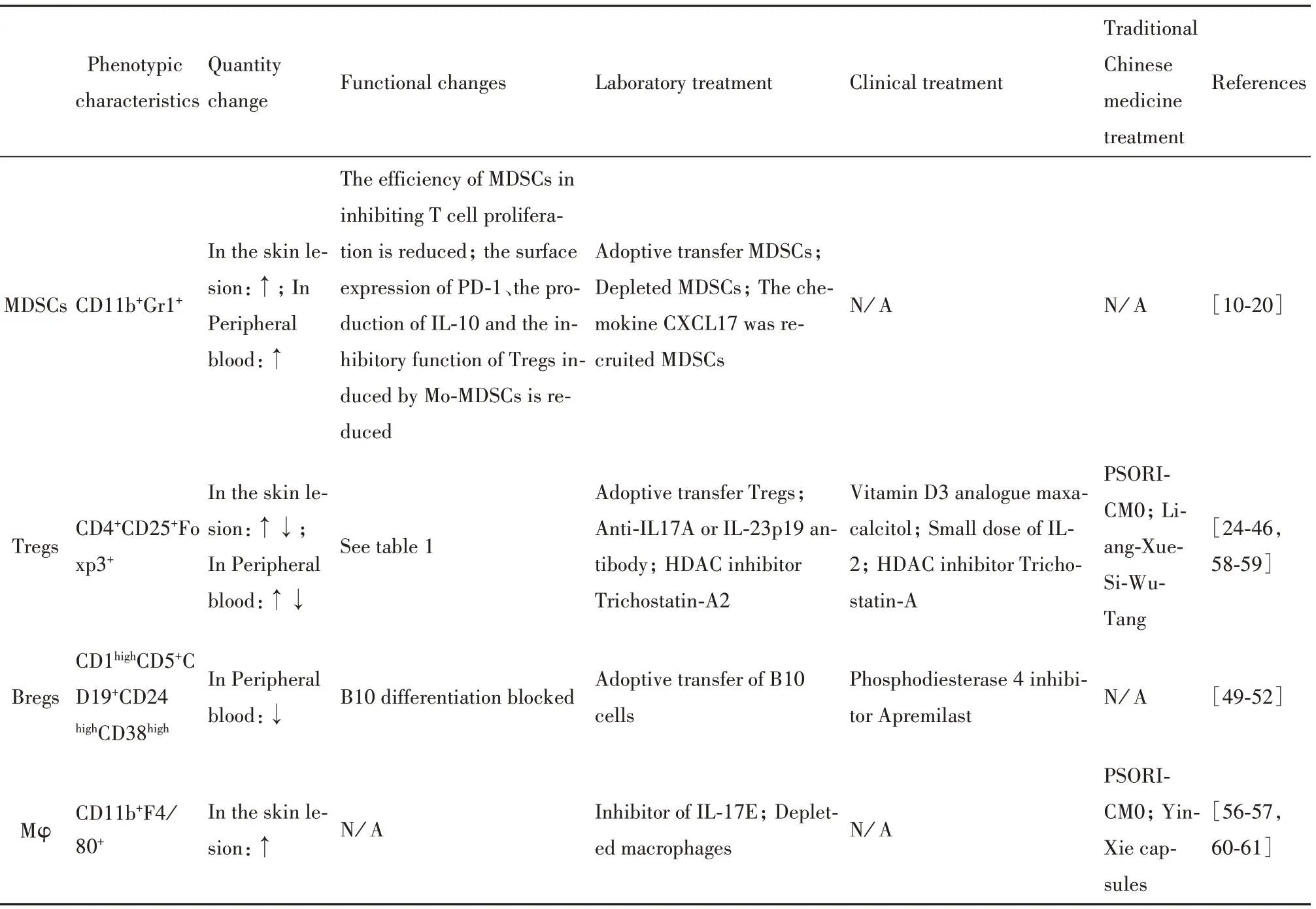
表2 银屑病中的免疫抑制性细胞数量、功能变化及靶向治疗Tab.2 Changes in number and function of immunosuppressive cells in psoriasis and targeted therapy
5 讨论与展望
银屑病是一种由先天因素、免疫及感染等多病因而诱发的皮肤疾病,T细胞的过度增殖和活化是银屑病发病机制中的重要环节[62]。近年来,无论临床医学还是中医药对银屑病免疫机制研究几乎都以T细胞的免疫调控为主,而很少关注MDSCs、B10、Mφ等免疫抑制性细胞群体。目前,学术界对此类免疫抑制性细胞的研究又集中于肿瘤微环境,对非肿瘤疾病,如银屑病中,对此类细胞的研究探索十分匮乏。已有研究发现,银屑病中免疫抑制性细胞存在数量及功能活性的异常表现,其可能加速银屑病进展。因此,对此类细胞进行免疫调控将有望成为控制银屑病病情进展的限速酶。
5.1 免疫抑制性细胞在银屑病中呈现多元化的原因解析据前文所述,在银屑病中,Tregs数量变化呈现多元性、MDSCs和巨噬细胞亦或促炎亦或抗炎结果的矛盾性可能是由银屑病机体内环境的复杂性所导致。首先,银屑病根据发病时期不同主要分为进行期、静止期、退行期,疾病所处时期不同,机体免疫细胞数量、免疫因子表达亦有改变;其次根据其发病部位不同分为头皮银屑病、甲银屑病、阴部银屑病等,因此不同发病部位的活检组织中免疫抑制性细胞的募集及活性亦可能发生改变;另外根据银屑病临床症状主要分为寻常型、关节型、脓疱病型和红皮病型这四种类型,因此所研究银屑病的临床症状不同,其机体内环境中免疫抑制性细胞发挥的作用亦可能不同;此外,中医体质学说提出,疾病的性质和病理过程与个体差异有很大的相关性,因此根据体质学说结合中医药独特的辨证论治体系,可以将银屑病大致分为血热证、血燥证和血瘀证,由此可见银屑病患者的个体差异与中医证型的不同亦可导致免疫抑制性细胞的数量和/或功能多元性;最后,机体内除前文所述MDSCs、Tregs、B10、Mφ以外,仍有其他免疫抑制性细胞群的存在,例如调节性树突细胞(regulatory dendritic cells,DCreg)、2型先天性淋巴细胞(type 2 innate lymphocytes,ILC2)等,但目前文献检索尚未发现银屑病与DCreg、ILC2等的联系,此类细胞之间的相互串扰同样可能影响机体免疫细胞的产生和发展。因此,以上结果提示临床患者样本的病变时期、类型,证型的不同亦或实验研究中模型小鼠的取材时间、取材部位的不同等均可导致炎症环境下免疫抑制性细胞的异质性。
5.2 MDSCs在银屑病中的作用机制相对Tregs可能更为复杂目前有大量临床报道中医药复方及中药单体能够下调肿瘤微环境中MDSCs免疫抑制活性从而干扰癌症进程[17];本课题组一直聚焦于中医药复方及其有效成分对MDSCs免疫功能的调控作用,发现其在肿瘤和非肿瘤疾病中发挥的作用不同,例如MDSCs在肿瘤微环境中发挥免疫抑制作用促进肿瘤的进展[17],然而MDSCs在非肿瘤疾病,如Ⅰ型糖尿病、真菌感染等中却能够阻止疾病发生发展,发挥一定的良性调节作用[63‐64];因此在不同病理条件下MDSCs具有高度可塑性。除此之外,MDSC表型具有异质性,除了前文所述的PMN‐MDSC和M‐MDSC两大类亚型外,还包括尚未明确定义的MD-SCs前体细胞(e‐MDSC)与骨髓祖细胞的混合细胞群等,另外MDSCs还通过多途径(ROS、Arg1等)发挥免疫抑制作用[65]。在银屑病免疫环境中,Tregs相对于MDSCs而言其表型单一,然而其免疫抑制活性尚受到多种途径的限制,那么可塑性、异质性相对较高的MDSCs在银屑病中的免疫机制可能更为复杂,因此研究其在银屑病中的发病机制可能为改善银屑病提供新靶点。
5.3 中医药调控免疫抑制性细胞改善银屑病的展望中医药作为医学领域的重要分支,是治疗银屑病的重要手段。目前中医药调节银屑病中的免疫抑制性细胞也与现代临床医学的免疫疗法一致,研究主要聚焦于Tregs,对于其他免疫抑制细胞的研究涉及很少,其中对于MDSCs的研究目前几乎没有。但大量报道显示中医药复方及单体通过调节机体其他免疫机制(如异常激活的T细胞免疫反应)能够有效阻止银屑病进程,例如复方泽漆冲剂通过降低银屑病患者血清中IL‐17、IL‐22、IL‐23等炎症因子进而改善银屑病症状[66];凉血活血的单味中药(紫草、茜草等)能有效降低银屑病小鼠中IL‐23/Th17信号传导轴相关免疫因子的表达[67]。由此可见,目前中医药改善银屑病的研究主要集中于调控IL‐23/Th17轴相关炎症细胞及因子,对免疫抑制性细胞的调控涉及较少且研究较浅显,相对于临床医学对免疫抑制性细胞的探索亦较为滞后,因此中医药靶向免疫抑制性细胞扭转银屑病进程的探索尤为必要。
基于中医药复方多环节、多靶点、多重功效发挥作用的特点,是否可以针对银屑病中尚未受到重视的MDSCs进行“免疫再教育”从而上调其免疫抑制活性进而改善银屑病?另外,在肿瘤微环境中MDSCs与Tregs等协同发挥T细胞抑制作用,因此中医药复方在“再教育”MDSCs的同时是否可以调控Tregs、B10等免疫抑制性细胞?除此之外,中医药复方在治疗银屑病皮损的同时还可提高患者生活质量,比如睡眠、饮食等,从多环节调节机体免疫进而改善银屑病。除此之外,目前得益于对肿瘤微环境中MDSCs等研究的深入,调控MDSCs等细胞免疫抑制活性的主要相关通路得以明确,例如Stat3通路、PGE2‐COX2通路等具有调控MDSCs增殖和活化的作用[68],因此从中医药天然单体库中寻找对以上主要通路有效的作用单体,进而上调MDSCs的免疫抑制活性,将有可能成为缓解银屑病症状的潜在策略;并且相对于甲氨蝶呤等传统药物,天然单体更为安全,副作用更少,为新药研发提供思路。但值得思考的是,无论临床医学亦或中医药对MDSCs的数量以及其免疫抑制活性的上调是否会诱导其他疾病发生(比如肿瘤的形成),如何才能更好地把握免疫抑制性细胞与过度活化的T细胞之间的平衡等问题依然有待解决。