基于COMSOL Multiphysics 的橙子电池电化学模拟
张建刚
(国网四川省电力公司凉山供电公司,四川 西昌615000)
水果电池由伦敦钟表修理工、业余电源研究爱好者东安尼·阿希尔发现的,他把导线的一端接在插进柠檬里的一块铜片和一块锌片上,另外一端接在电动台钟的发动机上,由此获得了水果电源[1]。水果电池属于原电池中的一种,水果的种类、电极的种类、电极插入的深度以及电极间的距离等方面都会对水果电池的电压产生影响[2-3]。
电化学研究方法较多,利用极化曲线研究电极过程是一种常用的研究方法[4]。极化曲线是电流密度与电势的关系曲线,通过极化曲线可了解电势随电流密度的变化规律,进而得到电极电位与电化学反应速度的关系[5]。
本文基于COMSOL Multiphysics 建立一种橙子电池的电化学模型,其中模拟了橙子和两根金属棒构成的化学电池;通过改变金属棒的半径,研究了橙子电池的电化学模型极化图、电池电位图的变化趋势;以及通过观察电流密度矢量图,得出了金属棒半径越小,金属棒的腐蚀速率越慢;且电流密度越高,电池释放热量越多的结论。
1 模型的建立
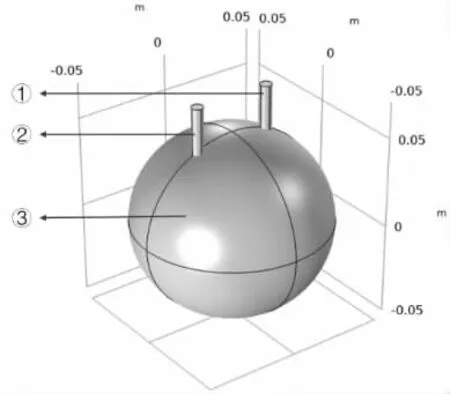
图1 橙子电池的示意图
在此模型中,如图1 所示:③表示橙子,其内部的电解质为柠檬酸及各类其它离子;①表示锌棒,作为原电池一极,且设定为电池电位以满足总电流条件;②表示铜棒,作为原电池另外一极,且设定为接地;由此组成一个原电池,本模型基于能斯特方程,电解质电流根据欧姆定律进行求解。
锌棒用作其中一个电极,发生如下的电极反应:

2 控制方程
Bulter-Volmer 动力学方程描述了嵌入橙子的锌棒表面发生的电极动力学[6],方程如下:
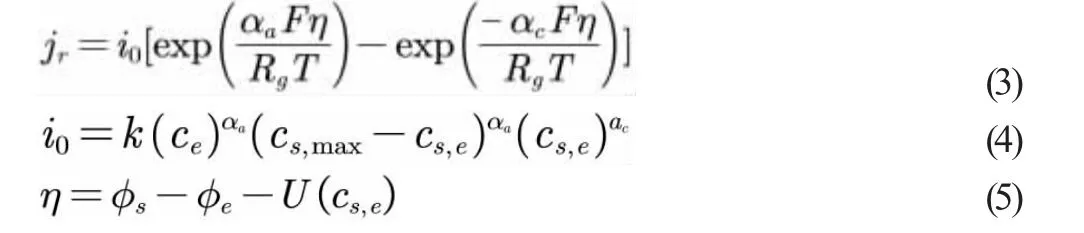
cs,max为锌离子最大浓度,η 为电极过电位;U 为开路电压,与锌离子浓度有关。
Nernst-Planck 方程描述了由锌电极反应产生的溶解的锌离子在橙子中的扩散和迁移[7],方程如下:
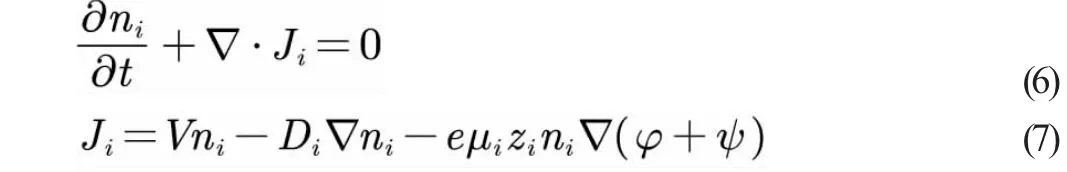
式中,ni表示第i 种离子数量浓度(正离子或负离子);Ji为第i种离子数量通量,即单位时间通过单位面积的离子数量总和。对于稀释电解质溶液,式(7)由三部分构成:第一部分是离子的对流通量,描述了流体流动所携带的离子数量总和,V是流场速度矢量;第二部分是离子浓度梯度通量,Di是第i 种离子扩散率;第三部分是电迁移量,描述了离子在电场驱动下的运动通量。

表1 不同模型的金属棒直径
本次模拟过程中设置了四个模型,每个模型仅有金属棒的半径不同,具体的尺寸如表1 所示;仿真开始时,锌浓度设为0.001 mol/m3。
3 结果分析
在极化曲图中,横坐标代表电流密度,纵坐标代表电极电位;整个极化曲线反映了电极电位随着电流密度的变化而变化的趋势,因此它也是获取原电池中电极腐蚀速率的有效方法之一。
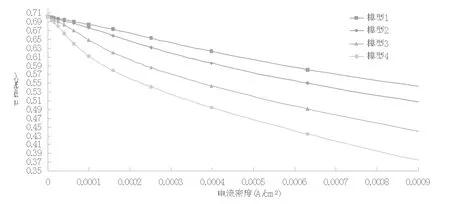
图2 四个模型的极化图
从图2 中可以看出,模型1 的欧姆极化比模型2、模型3、模型4 的欧姆极化小,且呈现出随着电极半径逐渐减小而变小的趋势。此外,在以往学者的研究中表明欧姆极化越小,电流密度也会越小,二者呈近似正比关系;欧姆极化越小,温度会越高,二者呈近似反比关系;这也间接的说明了在电池电极半径越小的情况下,如果相同电流密度,电池将会释放出更多的热量,进而电池内部电解质的温度也会更高。
金属腐蚀与防护的众多基本参数中,电位是其中最重要的一个。通过电位随时间变化的关系曲线,可以更好地分析研究金属的腐蚀行为和腐蚀过程。一般而言,金属的腐蚀电位有下降的趋势时则表明腐蚀加速,金属腐蚀电位有保持不变的趋势时则表明腐蚀速率基本保持稳定,金属腐蚀电位有上升的趋势时则表明腐蚀减缓。
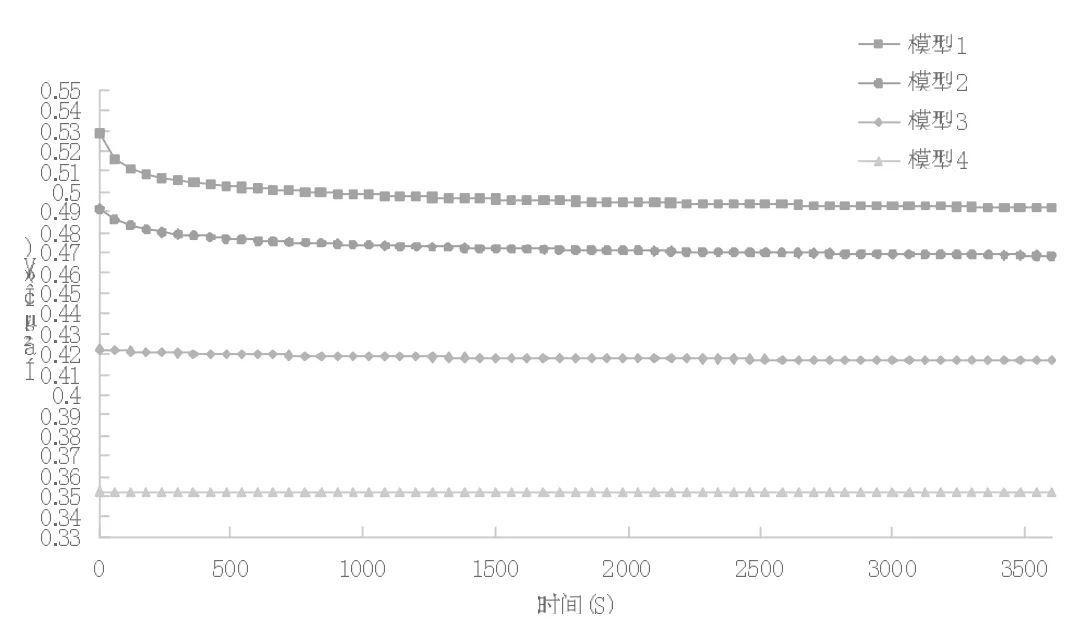
图3 四个模型的电池电位图
从图3 可以看出,模型1 和模型2 中锌棒的腐蚀电位随着时间的变化开始有下降的趋势,最后达到一个相对稳定的值;表明了电池电极中的金属棒腐蚀速度先是加快,然后减缓,最后保持稳定;模型3 和模型4 中锌棒的腐蚀电位随着时间的延长基本无明显变化;通过对以上四个模型的分析,表明了在原电池中电极锌棒的半径越小腐蚀速率越小。
从图4 也可以更加直观地看见,从图4(a)到图4(d)金属棒的半径越来越小,然而在金属棒半径越小地情况下,电解质中的电流密度越来越高了。这也说明了,电流密度越高,电池将会释放出更多的热量,进而电池内部电解质的温度也会更高。
4 结论
4.1 在以上水果电池的模型中,随着电池电极金属棒半径越来越小时,欧姆极化也越小,电解质中的电流密度越来越高;电池将会释放出更多的热量,进而电池内部电解质的温度也会更高。
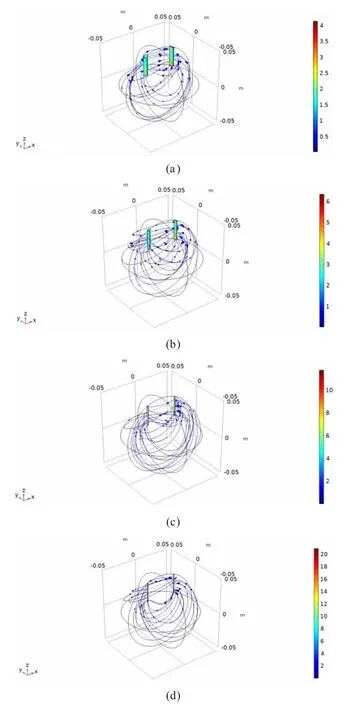
图4 四个模型的电解质电流密度矢量图
4.2 通过对以上四个模型的分析,表明了在原电池中电极锌棒的半径越小,其腐蚀速率越小。
——以2023年高考湖南卷物理第14题为例

