淀山湖鱼类群落结构季节性变化分析
党莹超,戴小杰,吴 峰
( 1.上海海洋大学 海洋科学学院,上海 201306; 2.上海海洋大学,国家远洋渔业工程技术研究中心,上海 201306; 3.上海海洋大学,大洋渔业资源可持续开发省部共建教育部重点实验室,上海 201306; 4.中国长江三峡集团 有限公司 中华鲟研究所,湖北 宜昌 443100; 5.三峡工程鱼类资源保护湖北省重点实验室,湖北 宜昌 443100 )
淀山湖是上海市最大的天然湖泊,属太湖水系,位于上海、江苏、浙江3个地区的交界处,N 31°04′~31°12′,E 120°53′~121°01′。湖泊面积63.7 km2,呈葫芦形,最大水深4.9 m,平均水深2.5 m[1]。该湖拥有丰富的渔业资源和丰富的水生生物多样性,在维持周边渔民社会稳定和提高渔民收入等方面发挥着重要作用[2]。鱼类是影响水域生态系统结构和功能变动的主要因素,其种群结构组成和数量的变化能反映出水域生物群落结构和水质的状况[3]。然而,随着环境变化和捕捞强度增加,淀山湖里的鱼类资源出现衰退,为了改善淀山湖的生态环境,上海市已实施了一系列湖泊治理工程,一些学者就淀山湖水质环境及水生生物生态学方面做了大量研究[4-8]。孙菁煜等[6]根据2006年淀山湖的调查数据分析了鱼类的多样性;韩婵等[9]分析了2010—2012年淀山湖鱼类群落结构多样性的年际变化。但至今未见淀山湖鱼类群落季节性变化的研究报道。上海市自2004年开展增殖放流活动,增殖放流在水生生物资源保护、生态修复、渔业修复等方面发挥着重要的作用[10]。笔者根据2013年1—11月淀山湖渔业资源调查数据,结合相关历史调查资料,分析淀山湖鱼类群落的季节性变化,以期为淀山湖渔业资源管理和增殖放流提供参考。
1 材料与方法
1.1 野外取样
调查的时间为2013年1—11月,每月进行1次拖网调查(春季为2—4月),拖网船长6 m、宽2 m,功率为9 kW,动力为柴油发动。拖网网口高1.5 m,网口宽2.0 m,网长3 m,囊网网目2.0 cm。渔船左右各放1顶拖网,每次拖网时间为30 min。渔获样本冷冻保存,带回实验室进行分析。先根据《上海鱼类志》[9]进行鱼类种类鉴定,再进行体长(精确度为0.1 cm)、体质量(精确度为0.1 g)测量。根据淀山湖的实际水文环境和以往研究资料,共设置19个调查站点(图1)。
1.2 分析方法
1.2.1 优势种
为确定渔获物中不同物种的相对重要性,需运用多种计算指数,包括数量百分比[11](N%)、质量百分比[11](M%)、出现频率[12](F%)和相对重要性指数[3](IRI),其计算公式如下:
图1 调查站点分布Fig.1 Sampling sites in the Dianshan Lake
(1)
(2)
(3)
IRI=F%×(N%+M%)
(4)
式中,Ni为第i种鱼类生物的个数,N为所有渔获生物的总个数,Mi为第i种鱼类生物的质量,M为所有渔获生物的总质量,fi为第i种鱼类生物出现站点数,f为调查站点的总个数。
根据以往研究结果[9],将相对重要性指数≥500的物种定为优势种,500>相对重要性指数≥100的物种定为常见种,100>相对重要性指数≥10的物种定为一般种,10<相对重要性指数的物种定为少有种。
1.2.2 生物多样性
在对鱼类群落的生物多样性进行分析时,多采用香农—威纳指数(H′)、种类丰富度指数(D)和均匀度指数(J′)来分析,其计算公式如下[13]:
(5)
(6)
(7)
式中,S为渔获物种数;pi为渔获中第i种物种个体数所占比值;N为渔获的总个体数。
1.2.3 数量生物量比较曲线
数量生物量比较曲线(ABC)方法是在同一坐标系中比较生物量优势度曲线和数量优势度曲线,通过两条曲线的分布情况来分析群落不同干扰状况下的特征[14]。当群落处于稳定状态时,群落主要是以生长慢、性成熟晚的大个体鱼种为主,此时生物量优势曲线处在数量优势曲线上方;当群落受到中度干扰时,生长快、个体小的鱼种增加,此时生物量优势曲线与数量优势曲线相交叉;当群落受到严重干扰时,群落主要是以个体小、性成熟早的鱼种为主,此时数量优势曲线处在生物量优势曲线上方[15-16]。
W为数量生物量比较曲线方法的统计量[15],当生物量优势曲线在数量优势度曲线之上时,W为正,反之W为负,按下式计算:
(8)
式中,Bi和Ai为数量生物量比较曲线中种类序号对应的生物量和数量的累积百分比,S为出现物种数。
1.2.4 生物量谱方法
用生物量谱方法分析生物量与平均个体体质量之间关系,先计算每个季节每个种类的平均体质量,然后以平均个体质量5 g单位区间间隔计算每个区间的总渔获数量,标准化的生物量谱(NBSS)由Gi的值进行线性回归得到[17],Gi的计算公式如下:
(9)
式中,ni为第i个平均个体质量区间的总渔获数量;t为平均个体质量的分组间隔;Ti为第i个平均个体质量组的上限值。
若回归直线的斜率等于-1,则表明渔获数量随着个体质量的增加呈均匀分布;若斜率小于-1,渔获数量随着个体质量的增加而减少;若斜率大于-1,则渔获数量随着个体质量的增加而增加[18-19]。最小平均个体质量组的渔获数量往往会影响标准生物量谱的斜率,最小个体质量的渔获数量越少,其回归线会越平;反之,则回归线将会越陡[17]。
2 结 果
2.1 种类组成


表1 淀山湖鱼类组成Tab.1 Species composition of fish in the Dianshan Lake
2.2 物种多样性
2013年淀山湖水域鱼类物种多样性的季节变化显示,多样性指数变化为1.2374~1.9886,以春季最小,秋季最大,即春季的物种多样性最低,秋季的物种多样性最高;丰富度指数变化为2.3809~3.1054,以冬季最小,秋季最大;均匀度指数变化为0.4131~0.6274,以春季最小,夏季最大(表2)。
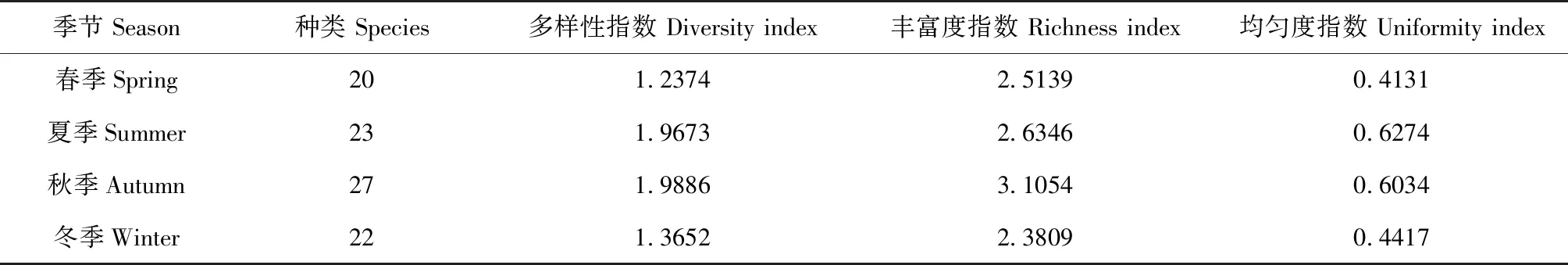
表2 淀山湖水域鱼类物种多样性的季节变化Tab.2 Seasonal variation in biodiversity indices of fish species in the Dianshan Lake
2.3 数量生物量比较曲线特征
通过对淀山湖4个季节鱼类的数量生物量比较曲线的绘制,可清晰地看到其鱼类群落的优势度曲线变化趋势(图2)。其中,春季淀山湖鱼类群落的数量优势度曲线位于生物量优势度曲线之上,夏季、秋季和冬季淀山湖鱼类群落的数量优势度曲线与生物量优势度曲线出现交叉。

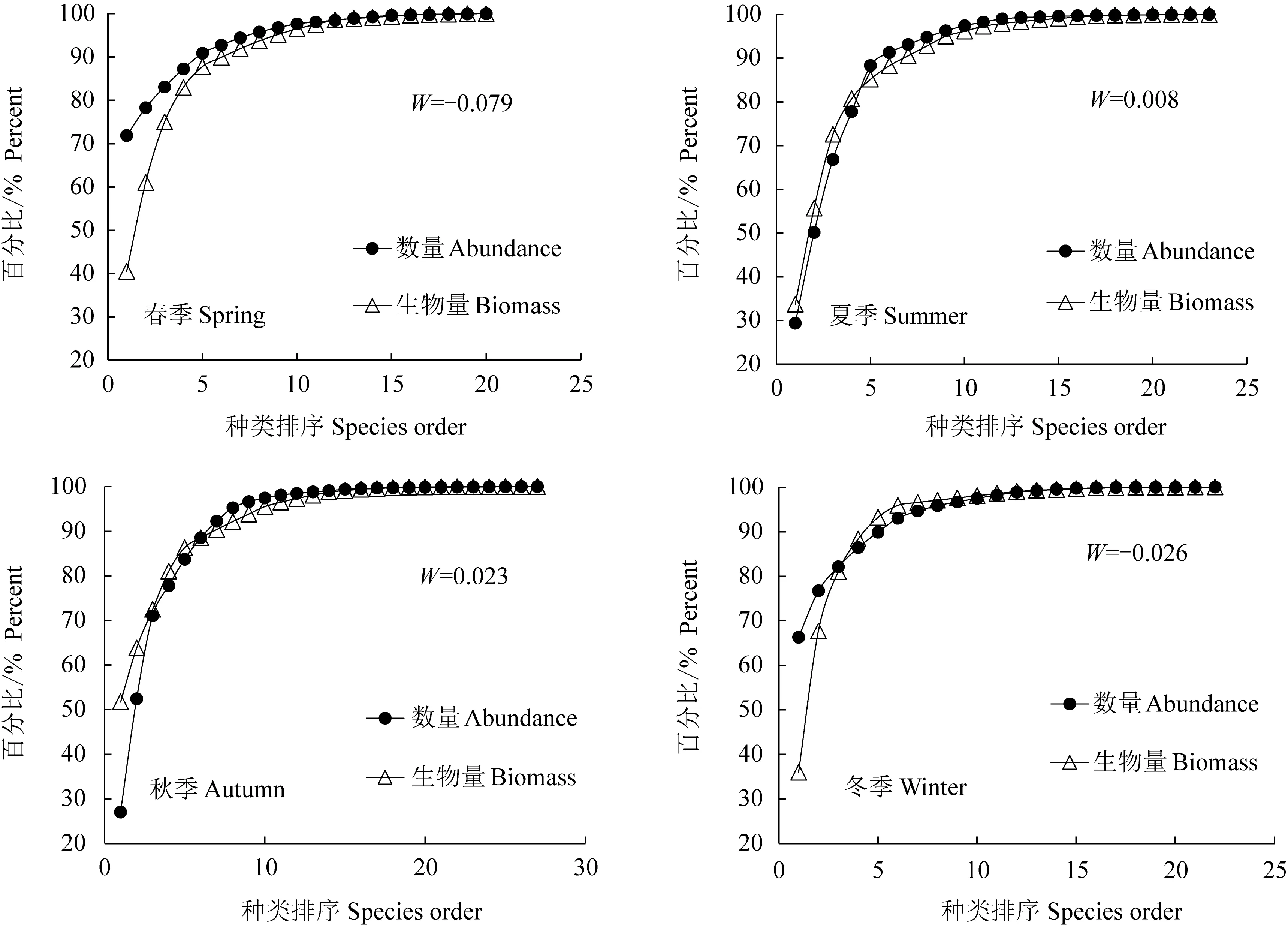
图2 淀山湖各季节鱼类群落的数量生物量比较曲线以及W统计值Fig.2 ABC curves and W values of fish community in the Dianshan Lake in each season
秋季和冬季数量优势曲线和生物量优势曲线中,数量百分比和生物量百分比均排前5的优势种为刀鲚、细鳞鲴和鲫鱼。其中,秋季鲫鱼的数量百分比和生物量百分比均排第1;在数量优势曲线中,平均个体质量最大的是鲫鱼,为24.71 g,平均个体质量最小的是棒花鱼,为3.37 g;在生物量优势曲线中,平均个体质量最大的是鲤鱼,达373.96 g,平均个体质量最小的是细鳞鲴,为5.90 g。冬季刀鲚的数量百分比最高,为66.24%,鲫鱼的生物量百分比最高,为35.95%;在数量优势曲线中,平均个体质量最大的是鲫鱼,为37.03 g,平均个体质量最小的是子陵吻虾虎鱼,为1.32 g;在生物量优势曲线中,平均个体质量最大的是鲤鱼,达203.18 g,平均个体质量最小的是刀鲚,为5.15 g。秋季和冬季的数量百分比与生物量百分比的大小呈交错分布,因此造成了数量优势度曲线和生物量优势度曲线的交叉。
4个季节根据数量生物量比较曲线计算的W统计值中,春季和冬季的W值小于0,夏季和秋季的W值大于0,其变化为-0.079~0.023,春季W统计值最低,其次为冬季,秋季最高。
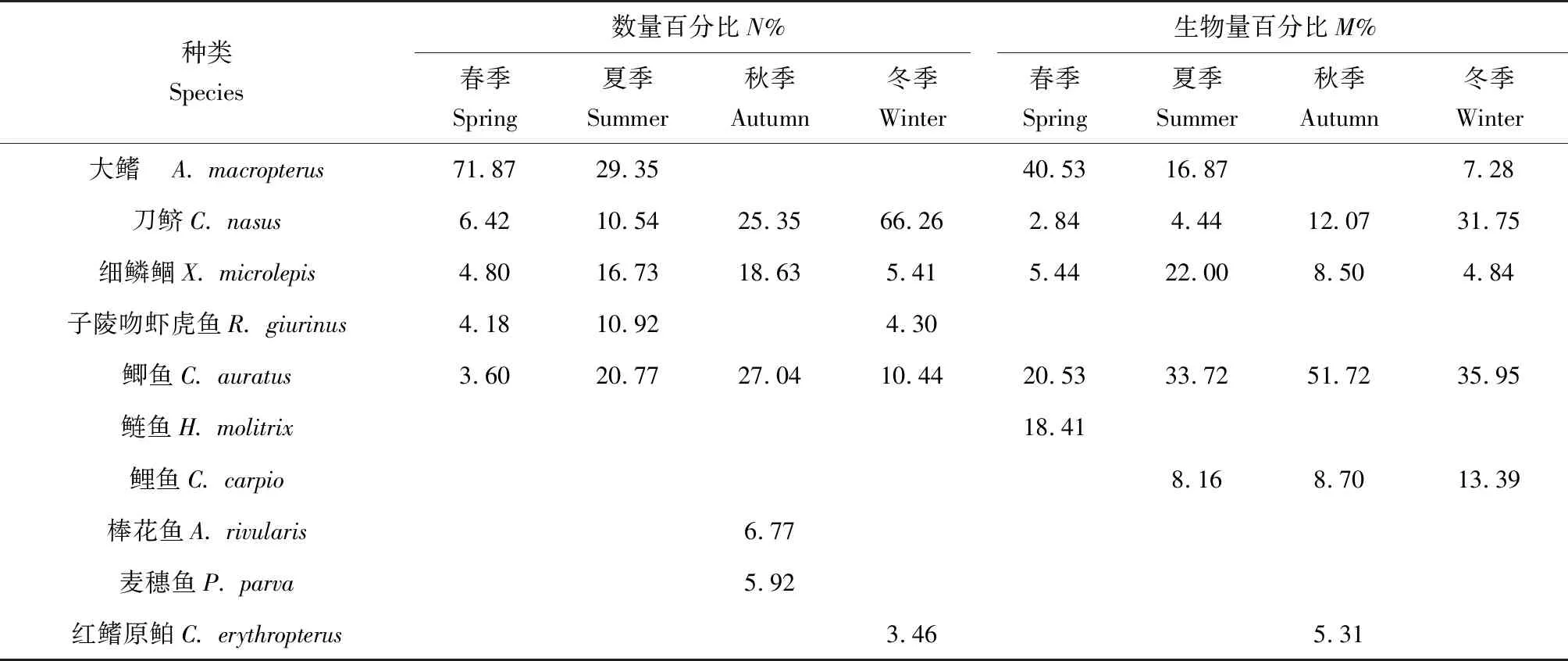
表3 各季节数量百分比和生物量百分比排在前5位的优势种类 %Tab.3 Top 5 dominant fish species ranking on abundance percentage and biomass percentage in each season
2.4 生物量谱
淀山湖鱼类群落各季节生物谱回归分析的参数见表4。4个季节的标准化生物量谱的斜率为-1.6954~-0.5001,夏季的斜率绝对值最大,冬季的斜率绝对值最小,呈先增后减的变化趋势。春季、夏季和秋季的标准化生物量谱的斜率均小于-1,而冬季的标准化生物量谱的斜率大于-1,表明淀山湖鱼类群落的数量随着体质量的增加呈不均匀分布,在春季、夏季和秋季随着体质量的增加数量逐渐减少,而冬季在较大体质量的区间内出现了较高的渔获量。4个季节的标准化生物量谱的相关系数r2为0.0456~0.6399,夏季的相关系数最高,冬季的相关系数最低。

表4 淀山湖鱼类群落各季节生物谱回归分析的参数值Tab.4 Descriptive statistics for biomass spectra of fish community in the Dianshan Lake in each season
由生物数量随平均个体质量的变化趋势可见(图3),4个季节的生物数量随着平均个体质量的变化趋势基本相同,均呈先增后减变化趋势,不同个体质量区间的数量差异较大,个体质量较小的占主导地位。其中,春季个体质量<20 g的生物数量比例高达94.42%,5~10 g内的生物数量比例最大,为74.79%;夏季个体质量<30 g的生物数量比例高达98.89%,5~10 g内的数量比例最大,为41.10%;秋季个体质量<30 g的生物数量比例高达99.45%,5~10 g内的生物数量比例最大,为53.57%;冬季个体质量<50 g的生物数量比例高达99.29%,5~10 g内的生物数量比例最大,为76.79%;4个季节中个体质量>70 g的生物数量所占比例均相对较小。
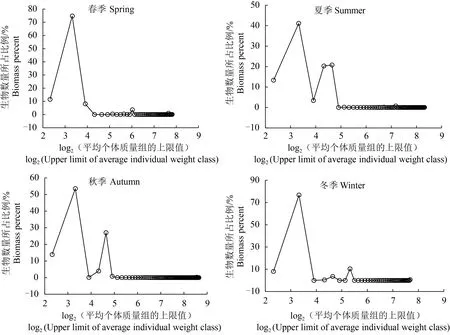
图3 淀山湖鱼类群落各季节的不同个体质量区间的数量所占百分比Fig.3 Seasonal proportional biomass spectra of fish community in the Dianshan Lake in each season
3 讨 论
3.1 种类组成
20世纪60年代的渔业调查中[20],淀山湖鱼类有60属75种;1974、1981—1982、1982—1985年和1987—1988年调查的鱼类分别为47属61种、42属62种、44属55种和34属45种[21]。可看出淀山湖渔业资源在20世纪后期正逐渐衰退,故2004年淀山湖开始实施增殖放流行动。孙菁煜等[6]调查发现,2006年调查收集的鱼类样品隶属9科18属,共包含23个鱼种,其中鲤科鱼类14种,尾数占样本总数的41.7%。本调查结果与孙菁煜[6]的研究结果相比,鱼类种数明显增加,渔业资源得到较好的恢复,表明增殖放流有效减轻了鱼类资源遭受破坏的压力[10]。韩婵等[9]对淀山湖2010—2012年鱼类结构的研究表明,在淀山湖共采集鱼类39种,隶属14科33属,以鲤科鱼类为主,与本调查结果基本一致。此外,历史资料显示[6,22],20世纪50年代淀山湖主要以野生鲤科鱼类为主,红鳍原鲌、翘嘴鲌、蒙古鲌、等为优势种,还有大型的鳡鱼(Elopichthysbambusa)等,其次为小型土著性种类、少数的河口鱼类和降河洄游鱼类。而笔者对2013年4个季节的调查数据进行分析发现,各季节中个体质量较小的鱼体总数都明显占主导地位,且在优势种中,大多为小型个体,这表明淀山湖的鱼类组成多以小型鱼类为主。
3.2 优势物种

3.3 数量生物量比较曲线分析
数量生物量比较曲线可反映出淀山湖鱼类群落结构的受干扰程度,而数量生物量比较曲线的不同特征主要体现在组成群落结构的物种种类的数量和生物量的相对比例变化中[26]。Warwick[27]认为,当生物量优势曲线一直处于数量优势曲线上方时,群落处于相对稳定状态,当2种优势曲线出现交叉或重叠时,说明群落遭受干扰程度增大。2013年淀山湖鱼类群落4个季节的数量生物量比较曲线中,春季和冬季的数量生物量比较曲线特征相似,W均为负值,夏季和秋季的数量生物量比较曲线的W虽均为正值,但数量优势曲线与生物量优势曲线几乎重叠,综合李圣法等[19,24]的研究标准,淀山湖的鱼类群落整体受到较大程度的干扰,但在某些季节呈现有所好转的迹象,如春季的物种多样性最低,秋季的物种多样性最高。春季和冬季淀山湖鱼类群落受到严重的干扰,这主要来自于鱼类群落各种类的补充、生长等内在因素[9]和环境污染[28]、酷渔滥捕等人为因素[23]。夏季和秋季有所好转,这可能主要受淀山湖2—5月的休渔期和夏初的增殖放流活动的影响。但随着捕捞作业的继续,鱼类群落又将处于严重干扰状态下,数量生物量比较曲线将逐渐呈现出生物量优势曲线处于数量优势曲线之下。
3.4 渔业资源管理建议
淀山湖鱼类组成多以小型鱼类为主的这种现状主要是由人为因素(如捕捞)所致[23,29],渔民对经济鱼种的利益追求会增大捕捞强度,当鱼类群落结构受干扰程度加剧时,鱼类种类组成将逐渐以个体小、生长快的种类为主[15]。进行增殖放流活动不仅能提高淀山湖的群落稳定性,也可控制浮游藻类[30],平衡水体生态系统中的物质循环和能量流动[3]。生物多样性是人类赖以生存的基础[17],淀山湖渔业资源的合理开发仍需与科学的养护管理措施结合起来。今后对淀山湖的渔业管理中应加强春季禁渔制度,延长禁渔期,避免一边放流一边捕捞现象发生;控制污水排放,保护淀山湖生态环境;加大增殖放流的强度和力度,强化对自然捕捞的管理,严格控制捕捞数量及网具的种类和规格,以保护小型鱼类,提高淀山湖增殖放流的效果。
4 结 论
2013年淀山湖渔业调查结果显示,淀山湖鱼类主要以小型鱼类为主,各季节中鱼类优势种有较大差异,物种多样性春季最低,秋季最高。淀山湖春季和冬季鱼类群落的数量优势曲线均在生物量优势曲线之上,夏季和秋季鱼类群落的数量优势曲线几乎与生物量优势曲线重叠,整体上鱼类群落结构仍处于较大干扰状态。今后仍需改善淀山湖水质,减轻捕捞强度,加大增殖放流力度,以保护淀山湖渔业资源。

