鸭疫里氏杆菌的分离鉴定及耐药性分析
韩心语,邓建峰,张丽霞,刘 倩,王 颖,田文霞
(山西农业大学动物医学学院,山西太谷030801)
鸭疫里氏杆菌病是由鸭疫里氏杆菌(Riemerel
la anatipestifer,RA)引起的一种高度接触性、败血性传染病,临床上又称鸭传染性浆膜炎病。该病主要侵害1~8 周龄雏鸭,死亡率可达80%。鸭疫里氏杆菌容易产生耐药性,使得临床上对鸭疫里氏杆菌病的防控与治疗造成一定的困难。该病已成为养鸭业经济损失最为严重的细菌性传染病之一[1],一旦某地被检测到鸭疫里氏杆菌病,很快将暴发为地方性疾病,且不容易根除。
鸭疫里氏杆菌最早由RIEMER 在患有流行性鹅渗出性败血症的病鹅中分离发现[2]。该菌为革兰氏阴性菌,瑞士染色可见两极浓染[3],菌体呈杆状或椭圆形,多为单个存在,无芽孢,无鞭膜,可形成荚膜。该菌属于兼性厌氧菌,对营养成分要求较高,因此,常使用含5%血清的TSA 固体培养基进行培养。鸭疫里氏杆菌血清型多达21 种,临床上多为不同血清型间的混合或交替感染[4]。鸭疫里氏杆菌不能使糖类发酵,常将此特性作为检测该菌的重要指标。尽管不同菌株之间生化特性存在差异,但仅通过生化指标来鉴定鸭疫里氏杆菌是比较困难的[5]。而PCR 鉴定作为一种特异性强、易于操作的技术,已经广泛应用于鸭疫里氏杆菌的鉴定。胡清海等[6]首次建立了应用PCR 鉴定鸭疫里氏杆菌的方法体系,并设计特异性引物来鉴定鸭疫里氏杆菌的不同血清型。
鸭疫里氏杆菌病一年四季都有发生,各种应激都会促进该病的发生,如饲养密度大、环境卫生差、管理不当等。该病主要经过呼吸道传播,常呈现大量感染。在病程初期表现为精神沉郁、黄色下痢;后期表现为行动障碍,可见斜颈、转圈等症状。剖检可见明显的纤维素性心包炎和肝周炎。该病的治疗主要通过疫苗注射和使用抗菌药物,但抗菌药物在畜牧养殖业中的滥用不仅加快了鸭疫里氏杆菌耐药性的产生,而且食品安全问题也日益严重,故鸭疫里氏杆菌病的预防、控制和治疗仍是当前养鸭业的首要待解决问题[7-8]。
本试验从广东和山东地区的病鸭分离鉴定鸭疫里氏杆菌,采用Kirby-Bauer 纸片法对其进行常见抗生素的耐药性试验,旨在为当地鸭疫里氏杆菌病提供临床用药参考。
1 材料和方法
1.1 试验材料
临床采集广东和山东地区疑似鸭疫里氏杆菌病的组织样品。
供试15 种药物有林可霉素、庆大霉素、青霉素、大观霉素、卡那霉素、阿莫西林、氨苄西林、链霉素、左旋氧氟沙星、环丙沙星、红霉素、四环素、恩诺沙星、头孢噻呋钠、氟苯尼考,均购自南京建成科技有限公司。
1.2 试剂
胰酪胨大豆琼脂(美国BD公司,货号为CNL17-B0022);胎牛血清FBS(杭州四季青生物有限公司,货号为3011-8611);瑞氏染色试剂盒(南京建成科技有限公司,货号为D008-1-2);革兰氏染色试剂盒(南京建成科技有限公司,货号为D010-1-2);预混液Premix TaqTM、DNA Marker(索莱宝科技有限公司,货号为M1070)。
1.3 试验方法
1.3.1 细菌的分离培养 采用无菌操作将采集病料研磨,并用无菌PBS 稀释,将稀释液用0.45 μm滤器过滤。用划线法接种于含5%血清的TSA 固体培养基上,于37 ℃、5%CO2恒温培养箱中培养48~72 h,观察细菌菌落形态,选择疑似菌落进行纯化培养。传代时培养皿中挑取肉眼可见半透明、圆形、微凸起的单菌落至含5%血清的TSB 液体培养基中,37 ℃恒温培养箱中200 r/min 振荡培养。
1.3.2 染色镜检 挑取纯化培养的单菌落于滴有PBS 的载玻片上进行涂片,用革兰氏、瑞氏染色试剂盒进行染色。革兰氏染色步骤按其说明书进行。瑞氏染色方法:瑞士吉姆萨A 液涂片染色1 min;再将瑞士吉姆萨B 液滴加A 液上,染色3 min;冲洗、干燥。然后进行显微镜镜检,观察记录菌落颜色与形态特征。
1.3.3 菌液PCR 检测鉴定 挑取适量传代培养单菌落作为基因扩增模板,以鸭疫里氏杆菌ATCC 11845菌株作为参考菌株,DnaK基因作为保守基因,设计鉴定引物F:ATGGAGCAAGATTTATTCATTATTTGG GATAGATGCCTAC;R:TTATTTCTTATTTTCTCCTTC AATTCTTTTATGTACTTTC。用该引物进行聚合酶链反应(PCR)扩增试验,PCR 反应体系为:12 μL 预混液PremixTaqTM,1 μL 上游引物,1 μL 下游引物,1 μL cDNA 模板和10 μL 蒸馏水,总计25 μL。PCR 最佳热循环程序为:95 ℃3 min;95 ℃30 s,60 ℃30 s,72 ℃1.5 min,35 个循环;72 ℃10 min。PCR 反应后,通过2.0%琼脂糖凝胶电泳鉴定菌液PCR 扩增产物。
1.3.4 药敏试验 参考文献[9-10],采用Kirby-Bauer纸片法,在无菌条件下将培养好的10 株菌液分别涂布在含5%血清的TSA 固体培养基上,涂布均匀。待稍微干燥后,用无菌镊子将15 种药物纸片平贴在培养基表面,间隔均匀,置于37 ℃条件下培养12 h 后观察结果。判定药敏抑菌结果的标准[11]为:抑菌环直径20 mm 以上为极度敏感;15~20 mm 为高度敏感;10~15 mm 为中度敏感;在10 mm 以下为低度敏感;不出现抑菌环则为耐药性。
2 结果与分析
2.1 细菌的分离培养及形态观察
试验分离得到10 株菌株,在TSA 培养基上生长为半透明、光滑、湿润、中央稍有隆起的圆形菌落,直径为0.5~1.0 mm。在5%CO2条件下培养约48 h 后可见透明露珠样小菌落(图1)。

2.2 染色镜检结果
由图2 可知,革兰染色后,可发现革兰阴性的小短杆状病原菌,多为单个菌分布或者成对散落,少量为链状排列,无鞭毛和芽胞;瑞氏染色可见两极浓染,符合鸭疫里氏杆菌的形态特征。

2.3 PCR 扩增结果
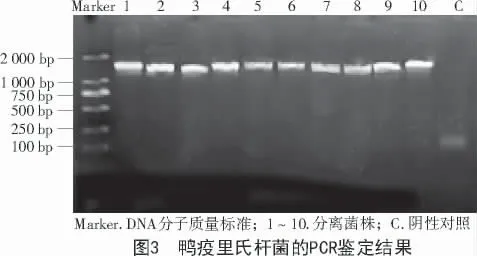
通过特定引物进行特异性PCR 扩增,凝胶电泳结果可见清晰单一特定10 条目的条带,确定其为鸭疫里氏杆菌(图3)。
2.4 药敏试验结果
分离菌的药敏试验检测结果如表1 所示,通过抑菌环直径对比,大部分菌株对林可霉素、庆大霉素、青霉素、大观霉素、卡那霉素、阿莫西林、氨苄西林、链霉素表现出不同程度的耐药,其中,对β- 内酰胺类(阿莫西林、青霉素、氨苄西林)、氨基糖苷类(庆大霉素、链霉素、大观霉素、卡那霉素)和林可霉素类药物(林可霉素)的耐药率在50%以上,对大环内酯类(红霉素)耐药率较低,为10%;均对左旋氧氟沙星、环丙沙星、头孢噻呋钠、四环素、恩诺沙星、氟苯尼考高敏。

表1 鸭疫里氏杆菌分离株对不同药物的耐药性检测
3 结论与讨论
鸭疫里氏杆菌病可在全世界内广泛流行[12],严重阻碍了当前养鸭业的经济发展。鸭疫里氏杆菌血清型较多,疫苗难以有效防治,使其成为危害养鸭业的主要病原菌之一[13]。已知的鸭疫里氏杆菌至少有21 种血清型[8],我国主要流行1 型、2 型、6 型和10 型[14],在不同血清型之间其交叉免疫保护作用偏弱,再加上注射疫苗之后禽类产生免疫应答的时间又比较长,因此,长期以来药物防治一直是生产中控制该病的主要措施[15-16]。当前养殖业中,越来越多的抗生素已被应用于临床治疗中,且使用次数及使用量越来越多。抗生素的使用虽然短时间内有所控制,但因雏鸭自身免疫力较低、疾病的传染性较高,且饲养管理不当使抗生素过度使用,加剧耐药菌株的产生。相关研究表明[3,10],鸭疫里氏杆菌对常用的阿莫西林、青霉素和庆大霉素等抗生素已经产生单种耐药性及多重耐药性。本试验分离的10 株鸭疫里氏杆菌同样对这3 种药物产生较强的耐药性,其中8 株对阿莫西林产生耐药性,6 株对青霉素产生耐药性,5 株对庆大霉素产生耐药性,同时7 株对其表现多重耐药性,由此可见,鸭疫里氏杆菌的耐药性日趋严峻。
天然性耐药和获得性耐药为细菌耐药性的2 种形式,细菌呈现获得性耐药是因为敏感性抗生素多次且长时间刺激该菌,进而使其基因突变表现出相应药物的耐药性。对鸭疫里氏杆菌的流行株进行分离及体外药敏试验的测定是确保药物防治有效性的基础检测。SUN 等[12]对103 株鸭疫里氏杆菌完成了23 种常用抗菌药物的耐药性结果分析,其中68 株菌株表现多重耐药性,即对2 种或2 种以上的抗菌药物表现出耐药。ZHENG 等[17]完成了对分离到的里氏杆菌的耐药菌株研究,结果表明,分离得到的菌株有40%以上对氯霉素表现出耐药性,已呈现中度敏感,耐药性趋势增加。LUO 等[18]在CH-2株鸭疫里氏杆菌的全基因中找到了耐药基因lnuH,该基因为一种新型的林可酰胺类抗性基因。XING 等[19]检测了80 株鸭疫里氏杆菌对药物的耐药性情况,结果检测到对红霉素耐药性菌株43 株(53.75%),通过基因分析,其分别携带ermF、ermFU或ereD红霉素耐药基因。上述报道的菌株耐药性与本试验结果存在较大差异,这是由于各个地区用药习惯不同而抗药性不同所致。吴彩艳等[20]对前几年广东地鸭疫里氏杆菌的耐药性检测表明,其对头孢类、氟苯尼考、阿莫西林药物敏感。本研究分离菌株对头孢类、氟苯尼考高敏,但已经对阿莫西林完全耐药。
本试验分离鉴定的10 株鸭疫里氏杆菌对β-内酰胺类(阿莫西林、青霉素、氨苄西林)、氨基糖苷类(庆大霉素、链霉素、大观霉素、卡那霉素)、林可霉素类药物(林可霉素)的耐药性在50%以上,对大环内酯类(红霉素)耐药率较低,为10%,但对喹诺酮类(左旋氧氟沙星、环丙沙星、恩诺沙星)、四环素类(四环素)、氯霉素类药物(氟苯尼考)和头孢噻呋钠高敏。本研究对当地鸭疫里氏杆菌病的用药预防与临床治疗提供了参考。

