糖尿病足患者皮肤微循环结构及HIF-1α、VEGF表达水平的改变1
林楚佳,蓝尤冕,欧妙琼,鄞国书,杨晓平,林少达
(汕头大学医学院第一附属医院,广东 汕头 515041)
糖尿病足病皮肤与正常皮肤相比具有典型组织学改变,真皮乳头层内血管数量明显减少,影响创面的血供[1]。缺氧诱导因子-1α(Hypoxia Inducible Factor-1α,HIF-1α)作为调控血管新生的一种核转录因子,可通过调控下游基因血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF )促进微血管形成,促进侧支循环建立。我们前期的研究工作发现糖尿病小鼠创面HIF-1α及VEGF总体表达水平降低,导致创面愈合过程血管形成不足[2],因此推测HIF-1α及VEGF在人类糖尿病皮肤表达下降可能是糖尿病创面愈合延迟的原因之一。我们观察30例糖尿病足溃疡患者皮肤微循环结构改变及真皮层HIF-1α、VEGF水平的改变,探讨HIF-1α、VEGF水平改变在糖尿病足溃疡难愈合以及修复过程中的作用机制。现报告如下。
1 资料与方法
1.1 一般资料 按符合1999年世界卫生组织WHO糖尿病诊断标准并且足部出现溃疡和/或深层组织破坏的入选标准,选择2017年7月至2018年10月在汕头大学医学院第一附属医院内分泌科住院的30例糖尿病足病患者作为研究对象,其中男性16例,女性14例,平均年龄(62.36±10.82)岁,糖尿病病程96个月。本研究获得医院伦理学委员会批准,患者均自愿参加并签署知情同意书。同时入选因下肢外伤行外科手术治疗的住院非糖尿病患者20例作为对照组,其中男性11例,女性9例,平均年龄(59.43±9.82)岁,从切除的多余皮肤中进行取材。两组患者性别、年龄差别无统计学意义。
1.2 方法
1.2.1 皮肤组织标本的采集 糖尿病足组患者常规消毒后取伤口皮肤,使用无菌手术剪对糖尿病足病皮肤溃疡边缘皮肤组织进行皮肤全层取材,大约0.5cm×1cm,去除皮下脂肪组织,一份立即放入4%多聚甲醛中固定,于48h内制成蜡块保存,用于免疫组化;另一份立即放入液氮中,并尽快放入-80℃冰箱保存,用于ELISA及荧光定量PCR。非糖尿病足对照组患者在外科手术过程中按手术需求切除多余皮肤并进行皮肤取材。
1.2.2 免疫组化观察皮肤微循环结构特点及检测皮肤HIF-1a、VEGF的表达 HE染色对比两组观察对象皮肤真皮层组织结构。通过免疫组化方法,用血小板-内皮细胞黏附分子(CD31)标记皮肤组织中的血管。200倍镜下每张切片随机选取4个视野进行真皮乳头内微血管计数、测量真皮乳头区域面积,计算微血管密度(微血管密度=微血管数÷乳头层面积)。通过免疫组化方法对各组皮肤石蜡切片进行HIF-1a、VEGF抗体染色,应用Image pro plus 6.0软件对图像进行各指标的量化分析,400倍镜下每张切片随机选取4个视野观察皮肤表皮HIF-1a、真皮乳头内VEGF表达强度的平均光密度值。
1.2.3 ELISA检测皮肤组织匀浆HIF-1α、VEGF水平 用ELISA双抗夹心法,以特异性HIF-1α、VEGF单克隆抗体包被,酶联特异性HIF-1α、VEGF多克隆抗体作为二抗检测。操作严格按照试剂盒(英国R&D Systems公司)说明书执行。
1.2.4 荧 光 定 量PCR检 测 皮 肤HIF-1α mRNA、VEGF mRNA水平 荧光定量PCR试剂和仪器:Tripure试剂、逆转录试剂盒及SYB Green qRT-PCR Master Mix(Roche公 司,美 国)、DEPC(Sigma公司,美国)、低温高速离心机及紫外分光光度仪(Eppendorf公司,德国)、CFX Connect荧光定量PCR检测系统(Bio-Rad公司,德国)。引物基因序列采用NCBI自行设计,同时经NCBIBLAST检索无显著同源性。取2-△△Ct代表目的基因的相对表达量。
1.2.5 统计学处理 采用SPSS 13.0统计软件进行统计学处理。计量资料进行正态性检验,方差齐性检验。正态分布数据用均数±标准差(±s)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 皮肤真皮层HE染色观察及免疫组化观察糖尿病足皮肤微循环结构特点 皮肤HE染色见糖尿病足组皮肤基底膜变薄扁平,真皮乳头面积增大,真皮胶原纤细、变性、断裂,纤维束排列紊乱。CD31免疫组化观察糖尿病足病组皮肤真皮乳头密度(59.2±16.7)个/mm2比非糖尿病组(77.6±11.2)个/mm2下降(P=0.032)。糖尿病足病组皮肤真皮乳头微血管密度(110.7±28.4)条/mm2比非糖尿病组(156.2±27.5)条/mm2下降(P=0.017)。见图1。
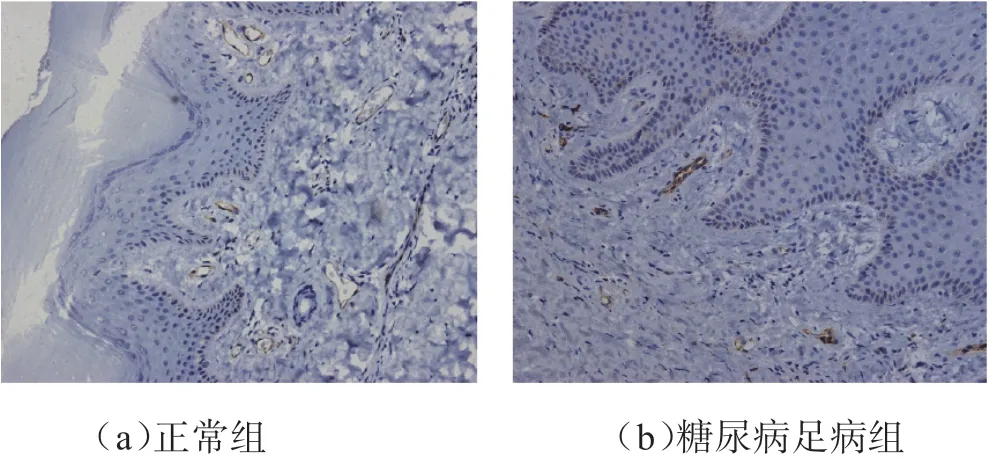
图1 非糖尿病组及糖尿病足病组皮肤真皮乳头微血管密度(IHC×200)
2.2 皮肤HIF-1α、真皮层乳头VEGF的表达强度HIF-1α蛋白阳性表达为细胞核出现棕黄色颗粒。HIF-1α在非糖尿病皮肤表皮基底层细胞核呈阳性表达,而在糖尿病足病足皮肤表皮基底层表达明显减弱。非糖尿病组皮肤表皮HIF-1α表达平均光密度值(0.28±0.07)明显高于糖尿病足组(0.13±0.04),P=0.022。见图2。非糖尿病组皮肤及糖尿病足组皮肤真皮层HIF-1α蛋白均呈阴性表达。
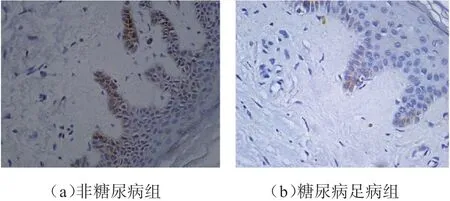
图2 非糖尿病组及糖尿病足病组皮肤HIF-1α表达(IHC×400)
VEGF主要表达与细胞质内出现金黄色颗粒,非糖尿病组皮肤表皮层真皮层细胞均有阳性表达,糖尿病足组皮肤表皮层真皮层VEGF表达减弱。非糖尿病组皮肤真皮乳头内VEGF表达平均光密度值(0.51±0.07)明显高于糖尿病足组真皮乳头内VEGF表达光密度值(0.39±0.04),P=0.029。见图3。
2.3 ELISA检测皮肤真皮层组织匀浆HIF-1α、VEGF水平,荧光定量PCR检测皮肤HIF-1α mRNA、VEGF mRNA水平,见表1。
3 讨论
缺血缺氧诱导后新生血管生成障碍是糖尿病皮肤软组织再生修复障碍的主要原因之一[3]。皮肤真皮乳头层是真皮层与表皮层的物质交换场所,微血管结构及真皮乳头生长状态对伤口的愈合有重要影响。本次实验结果显示,糖尿病足皮肤组织学结构发生改变,糖尿病足病组创口周围皮肤真皮乳头密度下降,真皮乳头微血管密度比非糖尿病组下降,表明糖尿病足创面愈合过程血管形成不足。糖尿病足皮肤真皮乳头层微循环结构的改变与糖尿病足的发生发展有着密切关系,血管新生障碍和/或延迟导致的缺氧缺血是糖尿病创面难以愈合的重要原因之一[4]。HIF-1α作为一种核转录因子,其调控的多种靶基因参与机体能量代谢、血管生成、细胞增殖和迁移、细胞凋亡等病理生理过程,在创面愈合过程中发挥了重要作用[5]。在正常氧浓度条件下,HIF-1α被脯氨酸羟化酶羟化后降解;在缺氧条件下,HIF-1α不被降解而在细胞内蓄

表1 皮肤组织匀浆HIF-1a、VEGF浓度及HIF-1α、VEGFmRNA表达水平 单位:ng/ml
积,通过核定位信号介导入细胞核激活下游基因表达,对机体内的一系列因素进行调节[6]。HIF-1α可通过调控下游基因包括VEGF等改善微血管病变。有研究表明,皮肤创伤后HIF-1α表达升高,进而上调一系列成血管因子如VEGF的表达水平,触发机体血管新生,促进侧支循环建立[7]。本实验结果显示非糖尿病皮肤表皮HIF-1a表达明显高于糖尿病足皮肤表皮HIF-1α表达;非糖尿病皮肤真皮乳头内VEGF表达明显高于糖尿病足真皮乳头内VEGF表达。ELISA检测皮肤真皮层组织匀浆HIF-1α、VEGF水平,荧光定量PCR检测皮肤HIF-1α、VEGFmRNA水平均提示糖尿病皮肤组织HIF-1α和VEGF在表达水平及其相关mRNA表达量较非糖尿病组下降。原因可能是高糖水平促进超氧化物的增加,诱发细胞内丙酮醛积累,从而减少HIF-1α的转录活动[8]。糖尿病足创口难愈合的主要因素可能是皮肤组织HIF-1α和VEGF表达的减少、微血管密度下降、血液供应不足。
总之,HIF-1α及VEGF在糖尿病创口愈合中起到重要作用,其表达水平的下降导致新生血管的缺乏,并且延迟愈合过程。本次研究在治疗糖尿病创口愈合中起到指导性意义,提示糖尿病足治疗过程要关注皮肤微循环的改善。在未来,我们将会进一步探索红外治疗技术是否能提高糖尿病足患者皮肤HIF-1α及VEGF的表达,促进糖尿病创口的愈合。

