不同类型高脂血症患者脂蛋白残粒胆固醇水平差异
胡咏梅 李群 林淳
广州市荔湾区人民医院检验科510370
脂蛋白残粒(remnant lipoprotein,RLP)是富含甘油三酯脂蛋白(triglyceride-rich lipoproteins,TRLs)代谢产生的残粒,是乳糜微粒(chylomicron emulsion,CM)和极低密度脂蛋白(VLDL)被脂蛋白脂肪酶(lipoprotein lipase,LPL)水解逐渐失去甘油三酯(TG)、磷脂、载脂蛋白A和载脂蛋白C(apoC),转化为富含载脂蛋白E、胆固醇和胆固醇酯的密度较大的小分子颗粒[1]。流行病学和遗传学研究均发现,高浓度脂蛋白残粒胆固醇(remnant lipoprotein cholesterol,RLP-C)与心血管事件的发生及其风险因素相关联[2-4],是动脉粥样硬化性心血管疾病(atherosclerosis cardio-vascular disease,ASCVD)的重要致病危险因子,与动脉粥样硬化的发生和发展密切相关[5]。本文通过比较不同类型高脂血症患者血清RLP-C水平,旨在探讨血清RLP-C与常规血脂指标的相关性及其临床意义,为进一步阐明高脂血症患者发生动脉粥样硬化的分子机制提供依据,现报道如下。
1 资料与方法
1.1 研究对象选择2020年3月至12月来本院体检经临床确诊为高脂血症的261例患者作为研究对象,其中男174例,女87例,年龄(57.1±9.5)岁。参照《中国成人血脂异常防治指南(2016年修订版)》的临床分类方法[6],将78例总胆固醇(TC)≥6.2 mmol/L、TG<1.7 mmol/L的患者纳入高胆固醇血症(HTC)组,其中男53例,女25例;将85例TC<5.7mmol/L、TG≥1.7 mmol/L的患者纳入高甘油三酯血症(HTG)组,其中男56例,女29例;将98例TC≥5.7 mmol/L、TG≥1.7 mmol/L的患者纳入混合型高脂血症(MHL)组,其中男65例,女33例。另选择85例同期在本院体检各项指标正常且TC<5.7 mmol/L、TG<1.7 mmol/L的健康成人作为健康对照组,其中男56例,女29例,年龄(56.8±10.8)岁。各组研究对象年龄、性别等一般资料差异无统计学意义(均P>0.05),具有可比性。所有研究对象对该研究均知情同意。本研究经本院伦理委员会审核通过,且符合《赫尔辛基宣言》的原则。
所有观察对象均排除心脑血管、肝肾、呼吸和内分泌系统的各种慢性疾病且近半年内未使用过调脂类药物。采集空腹12 h以上的血液标本,分离血清待检。
1.2 方法血清RLP-C采用苏州普瑞斯生物科技有限公司(中国)提供的RLP-C检测试剂盒(过氧化物酶法),其他血脂指标TG、TC、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、极低密度脂蛋白胆固醇(VLDL-C)、脂蛋白(a)[LP(a)]、载脂蛋白A-I(apoA-I)和载脂蛋白-B(apoB)检测试剂盒由上海执诚生物科技有限公司提供。所有项目均严格按照试剂盒说明书设置参数,在日本东芝120-FR全自动生化分析仪上完成检测。VLDL-C=TC-(HDL-C+LDL-C)。
1.3 统计学处理采用SPSS 23.0统计学软件包进行统计学分析,符合正态分布的计量数据以(±s)表示,两组间比较采用独立样本t检验,相关性分析采用Spearman相关分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 不同类型高脂血症患者血清RLP-C水平及血脂指标检测结果高脂血症患者血清RLP-C水平(0.40±0.27)mmol/L,明 显 高 于 健 康 对 照 组 的(0.19±0.07)mmol/L,差异具有统计学意义(P<0.01);HTG组和MHL组血清RLP-C水平均明显高于健康对照组(均P<0.01);HTC组血清RLP-C水平与对照组差异无统计学意义(P>0.05),明显低于HTG组(P<0.01)。各组研究对象其他常规血脂指标检测结果见表1。
2.2 高脂血症患者血清RLP-C水平与其他血脂指标的相关性高脂血症患者血清RLP-C水平与TG、VLDL-C呈 显 著 正 相 关(均P<0.01),与TC、HDL-C、LDL-C、apoA-I、apoB和Lp(a)相关不显著(均P>0.05);见表2。
3 讨 论
随着我国居民生活水平的提高,人群血脂水平逐年升高,ASCVD负担不断加重,防治形势日趋严峻。心血管病危险等级是确定患者血脂异常干预时机和干预强度的主要依据[7],患者心血管病危险程度不仅取决于其TC与LDL-C水平,还取决于患者其他心血管病危险因素的种类、水平及临床并发疾患[8]。RLP-C的致动脉粥样硬化作用被认为比LDL更强,与多种动脉粥样硬化相关疾病的发生、发展密切相关[9-11]。本研究结果显示,261例高脂血症患者血清RLP-C水平明显高于对照组,且与TG、VLDL-C呈显著正相关;提示血清RLP-C、TG、VLDL-C浓度升高可能是动脉粥样硬化和心脑血管疾病的独立危险因子,对心脑血管疾病的临床预测和预后评估具有重要价值。
表1 261例不同类型高脂血症患者HTG组、HTC组、MHL组和85例对照组血清RLP-C和血脂水平比较(±s)
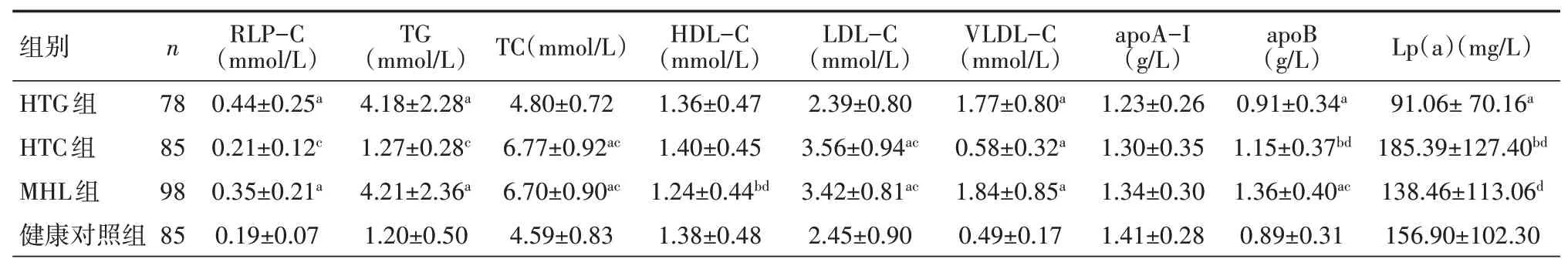
表1 261例不同类型高脂血症患者HTG组、HTC组、MHL组和85例对照组血清RLP-C和血脂水平比较(±s)
注:HTC组为高胆固醇血症患者,HTG组为高甘油三酯血症患者,MHL组为混合型高脂血症患者;与对照组比较,aP<0.01,bP<0.05;与HTG组比较,cP<0.01、dP<0.05;RLP-C为脂蛋白残粒胆固醇,TG为甘油三酯,TC为总胆固醇,HDL-C为高密度脂蛋白胆固醇,LDL-C为低密度脂蛋白胆固醇,VLDL-C为极低密度脂蛋白胆固醇,LP(a)为脂蛋白(a),apoA-I为载脂蛋白A-I,apoB为载脂蛋白-B
?

表2 261例不同类型高脂血症患者RLP-C水平与血脂指标的相关性分析
动脉粥样硬化会使血清RLP-C、TG和VLDL水平升高,导致心脑血管疾病的发生,但其致病机制尚未完全明了[12]。细胞生物学研究发现,循环中脂蛋白颗粒通过囊泡运输的方式进出动脉壁,这些由特异性网格蛋白包被的运输囊泡的平均直径大约为100 nm,只有直径小于70 nm的颗粒才能借助囊泡运输。富含三酰甘油的CM和VLDL颗粒都因体积太大,不能通过囊泡运输进入动脉壁;而体积较小的RLP刚好能够顺利进入动脉壁,但却不能完全满足返回血流的条件,因此被“困”在动脉壁内[13]。与LDL致动脉粥样硬化的机制相似,RLP透过内皮细胞层后聚集在动脉壁内,巨噬细胞和平滑肌细胞吞噬TRLs残粒后转化成泡沫细胞,大量泡沫细胞沉积形成脂纹,血管内皮发生隆起形成动脉粥样硬化斑块[14]。大量循证医学研究表明,脂质代谢异常可能影响RLP-C水平[15],但少见针对不同类型高脂血症患者RLP-C水平差异的临床研究。因此,本研究针对HTG、HTC和MHL 3种类型高脂血症患者的血清RLP-C水平进行了比较,发现HTG和MHL患者血清RLP-C水平均明显高于HTC患者和对照组,且高脂血症患者RLP-C水平与TG、VLDL-C呈显著正相关,而与TC、HDL-C、LDL-C、apoA-I、apoB和Lp(a)相关不显著;提示高脂血症患者TG浓度升高可直接反映RLP颗粒(即VLDL和/或CM残粒)的增多,流行病学和医学遗传学研究均发现高浓度TRLs残粒可能是心血管事件发生的独立危险因子。
循环中的TRLs是TG的主要载体,可以通过多种机制促进动脉粥样硬化和心脑血管疾病的发展,如促成胆固醇在血管内膜沉积、加重血管慢性炎症反应、促凋亡和促凝血途径的激活等。TRLs代谢是一个复杂的过程,主要受到LPL的调控[16]。有研究发现,HTG、MHL患者的LPL活性明显低于HTC患者和正常人,导致TG分解缓慢,TRL清除速度减缓致使血中RLP增多[17]。有研究发现,apo C III是LPL的天然抑制剂,可抑制LPL的活性,延缓TRLs的清除。此外,apo C III还能竞争性抑制肝细胞膜上的脂蛋白受体功能,阻碍肝脏等器官摄取和分解TRLs,引起血中RLP升高[18]。RLP致动脉粥样硬化的机制比较复杂,一般认为RLP不仅诱导不同细胞来源的炎症因子的分泌,还可影响内皮型一氧化氮合酶的表达与激活,抑制内皮细胞释放一氧化氮,损害内皮细胞功能,从而促发动脉粥样硬化的形成[19]。因此,比较不同类型高脂血症患者血清RLP-C水平差异,对进一步了解其致病机制、指导制定相应的防治措施有重要价值。
综上所述,脂质代谢异常会影响血清RLP-C水平,高脂血症患者血清RLP-C水平与TG、VLDL-C密切相关,HTG和MHL型高脂血症患者血清RLP-C水平显著升高。RLP-C是高脂蛋白血症疾病的危险因素,期待未来有大规模的多中心试验研究RLP-C水平与高脂蛋白血症相关指标的临床科研。
利益冲突:作者已申明文章无相关利益冲突。

