哈维氏弧菌Bfr 蛋白的原核表达及免疫特性研究
张志强,王苗,杜万年,刘勃兴,康元环,单晓枫,吴同垒,朱国强,史秋梅
(1.河北科技师范学院河北省预防兽医学重点实验室,河北 秦皇岛 066000;2.吉林农业大学动物科学技术学院,吉林 长春 130000;3.扬州大学,江苏 扬州 225009)
哈维氏弧菌Vibrio harveyi(又称哈氏弧菌)广泛引起多种海洋鱼类、甲壳类动物感染发病,造成重大经济损失[1],是重要的渔业致病菌。目前,多用抗生素和化学药物处理哈维氏弧菌感染发病的动物,治疗效果并不显著,且导致水体污染和菌株耐药现象极其普遍[2]。目前针对哈维氏弧菌疫苗的开发工作已经开展,发现哈维氏弧菌菌蜕成分作为免疫成分能较好地预防哈维氏弧菌感染;亚单位疫苗研究证实,细菌的外膜蛋白OmpK、OmpU 和OmpW具有较好的免疫保护效果[3-5];有一部分在其他病原上免疫效果优异的蛋白,如硫氧还蛋白也可作为哈维氏弧菌的优良候选疫苗[6]。这些研究为哈维氏弧菌疫苗的开发提供了重要参考。
Bfr 是细菌外膜表面编码的储铁蛋白。致病菌通过Bfr 蛋白将摄取的铁储存起来,用于应对宿主体内铁贫瘠的环境[7]。研究发现,细菌Bfr 蛋白是一种T 细胞抗原,能刺激机体IFN-γ 产生以及淋巴细胞增殖[8-10],设计表达Bfr 蛋白的核酸疫苗能诱导产生较高水平的抗体[10]。揭示了Bfr 作为疫苗的潜在价值。目前有关哈维氏弧菌Bfr 蛋白的研究尚未见报道。本研究以Bfr 蛋白为研究对象,利用原核表达系统表达哈维氏弧菌Bfr 蛋白,以探索其免疫特性。
1 材料与方法
1.1 材料
1.1.1 菌株、载体与实验动物
哈维氏弧菌菌株VHCL-1 分离自患病的半滑舌鳎Cynoglossus semilaevis,保存于河北科技师范学院动物传染病研究室。原核表达载体pET-32a 由本实验室保存。SPF 级6~8 周龄昆明小鼠购自北京维通利华实验动物技术有限公司。实验用斑马鱼Danio rerio 体长约3~5 cm,购自秦皇岛某花鸟市场,实验适应饲养2 周。
1.1.2 主要试剂
Ex Taq DNA 聚合酶、限制性内切酶和T4DNA连接酶购自宝生物工程(大连)有限公司;小鼠抗His标签单克隆抗体(His-MAb)、HRP 标记山羊抗小鼠IgG 抗体(HRP-IgG)、异丙基-β-D-硫代半乳糖苷(IPTG)及Ni2+argose 填料购自康维世纪公司;DH5α 和BL21 感受态细胞由河北科技师范学院动物传染病研究室制备保存;细菌基因组DNA 提取试剂盒和质粒小提取试剂盒购自北京艾德莱生物科技有限公司。
1.2 方法
1.2.1 bfr 基因的克隆
参考细菌基因组DNA 提取试剂盒说明书提取哈维氏弧菌VHCL-1 的基因组。根据GenBank 上已公布的哈维氏弧菌bfr 基因序列(GenBank 登录号:CP 025796.1),分别设计含BamH I 和Sal I 酶切位点的上下游引物,上游引物P1:5'-CGGGATCCATGAAAGGCGATCCAATCATAATCC-3'(BamH I),下游引物P2:5'-GCGTCGACACTCTTCATCAACGTAT TGCGCTTG-3'(Sal I)。以哈维氏弧菌VHCL-1 的基因组为模板链扩增bfr 基因。PCR 反应体系为50 μL,反应条件为95℃5 min;94℃30 s,54℃30 s,72℃1 min,30 个循环;72℃延伸10 min,扩增的目的片段用纯化试剂盒纯化,再将纯化产物与载体PMD18-T 连接,16℃连接2 h 后转化至DH5α 感受态细胞,经LB 液体培养1 h 后,取200 μL 涂布于平板培养基,经过夜培养后,挑取单菌落进行PCR验证,并送至上海生工生物科技有限公司测序[11,12]。
1.2.2 生物信息学分析
用DNA STAR 的MegAlign 软件将所测菌株的bfr 基因序列与GenBank 中已知不同细菌的bfr 基因序列进行Blast 对比分析,将已测序的菌株序列进行系统进化树分析。
1.2.3 表达载体pET-32a-bfr 的构建
对测序正确的pMD-18T-bfr 和pET-32a 载体用BamH I 和Sal I 双酶切后,经T4 连接酶连接并转入大肠杆菌BL21 感受态细胞中。挑取单克隆进行PCR 验证,阳性克隆参照质粒提取试剂盒说明书提取质粒,进行双酶切验证和序列测定,保证构建的表达载体pET-32a-bfr 在表达中不发生突变和移码。
1.2.4 rBfr 蛋白的诱导表达
参照文献[11]描述的方法,将含pET-32a-bfr 重组质粒的大肠杆菌BL21 接种于LB 液体培养基后,当OD600达到0.4~0.6 时,向培养基中加入1 mmoL/L诱导剂IPTG 进行诱导表达,以不诱导的含pET-32abfr 的BL21 为对照组。37℃再次震荡培养4 h 后离心收集菌液,PBS 洗净后水煮法提取细菌蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳分析。将重组表达菌体进行扩大培养,超声破碎菌体,离心分离沉淀、上清,利用SDS-PAGE 方法分析目的蛋白在沉淀和上清中的含量,用Ni2+亲和层析方法纯化蛋白,并用BCA 蛋白浓度检测试剂盒测定纯化蛋白浓度,于-70℃保存。
1.2.5 Western blot 分析
参照文献[12]描述的方法,SDS-PAGE 电泳后,将蛋白胶转移至PVDF 膜,用镊子取出PVDF 膜浸泡在含5%脱脂奶粉(w/v)的封闭液中,浸泡条件为:4℃、12 h。TBST 洗液清洗3 次,每次清洗3 min。加鼠抗His-Tag 单克隆抗体(体积比1∶1000 稀释)后室温放至摇床孵育2 h,TBST 漂洗后加入HRP-Tag 山羊抗鼠IgG(体积比1∶5000 稀释)室温放至摇床孵育2 h,TBST 漂洗后使用BAD 显色液在避光条件下显色5 min,ddH2O 终止反应,拍照观察结果。
1.2.6 rBfr 蛋白免疫小鼠抗体水平检测
参照文献[12]描述的方法,利用小鼠模型评价rBfr 的免疫效果。将40 只健康昆明鼠随机分成两组,每组20 只。实验组以纯化的rBfr 蛋白作为免疫原,分别于第0 d、15 d 和30 d 进行免疫,首免以50 g弗式完全佐剂乳化的蛋白皮下注射免疫,二免和三免蛋白用弗氏不完全佐剂免疫;在每次免疫对应的时间点,对照组小鼠免疫等体积乳化的PBS;在小鼠免疫前后不同时间,尾尖采取小鼠血液并分离血清,以rBfr 蛋白作为包被抗原,利用间接ELISA 方法检测小鼠血清中抗体的效价,以阴性血清OD450平均值加3 倍标准差作为阴阳性判定标准。
1.2.7 哈维氏弧菌感染斑马鱼实验
将60 尾斑马鱼随机分成6 组,实验组5 组,分别以不同浓度的哈维氏弧菌腹腔接种斑马鱼,接种剂量为10 μL/尾,接种菌量分别为1010cfu、109cfu、108cfu、107cfu 和106cfu,测定哈维氏弧菌VHCL-1菌株对斑马鱼的致病力。
2 结果与分析
2.1 bfr 基因扩增及同源性分析
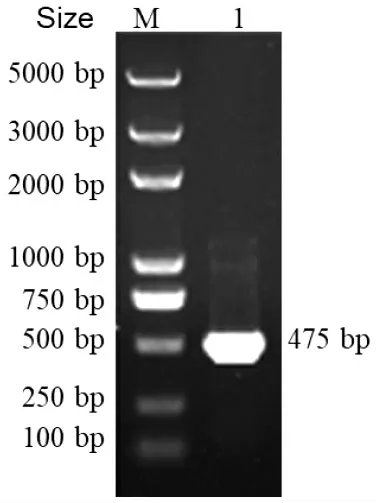
图1 bfr 基因的克隆Fig.1 Cloning of bfr gene
PCR 扩增bfr 基因的结果见图1。由图1 可知,于475 bp 处出现特异性条带,条带大小与预测的bfr 基因开放阅读框大小一致。将bfr 基因片段克隆到pMD18-T 载体上进行测序。由图2 可知,弧菌属各成员细菌间bfr 氨基酸同源性均在80%以上,其中与沙门菌Salmonella 和大肠杆菌Escherichia coli的氨基酸序列同源性分别达67%和68%,表明Bfr蛋白高度保守。
2.2 重组蛋白rBfr 的表达验证
SDS-PAGE 凝胶电泳分析重组蛋白显示,在约25 ku 处表达出rBfr 目的蛋白,而空载对照组在该位置处无明显条带(图3-A),Western blot 分析结果也同样于25 ku 处出现目的条带(图3-B),表明rBfr 重组蛋白成功表达。
2.3 rBfr 重组蛋白可溶性分析及纯化
对rBfr 重组蛋白进行可溶性分析,结果显示(图4-A),菌体超声破碎上清和沉淀中rBfr 均有表达,表明表达的rBfr 蛋白部分可溶。而取诱导表达上清进行纯化,在25 ku 处纯化出目的蛋白(图4-B),测定蛋白浓度为0.36 mg/mL。
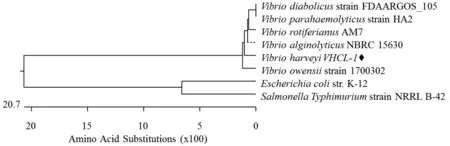
图2 不同菌株bfr 氨基酸同源性分析Fig.2 Homology analysis of bfr from Vibrio harveyi and other bacterial strains
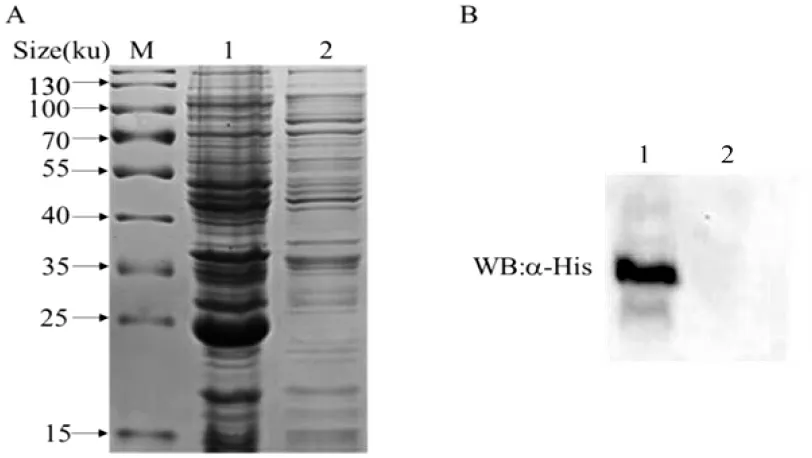
图3 rBfr 蛋白的表达验证Fig.3 Analysis of prokaryotic expression of rBfr
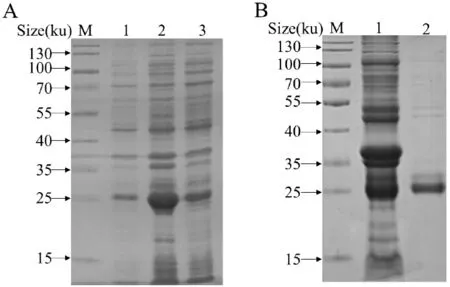
图4 rBfr 蛋白的纯化Fig.4 Analysis of purification of rBfr from E.coli
2.4 rBfr 蛋白免疫小鼠实验结果
将rBfr 蛋白免疫小鼠4 次采集的血清按1∶100 进行稀释,以500 ng/mL 重组蛋白包被酶标板,羊抗鼠IgG-HRP 二抗进行1∶5000 倍稀释。结果显示(图5),在二免后,免疫小鼠即产生较高水平的特异性抗体,在加强免疫后达到最高水平,表明rBfr蛋白具有优良的免疫原性。
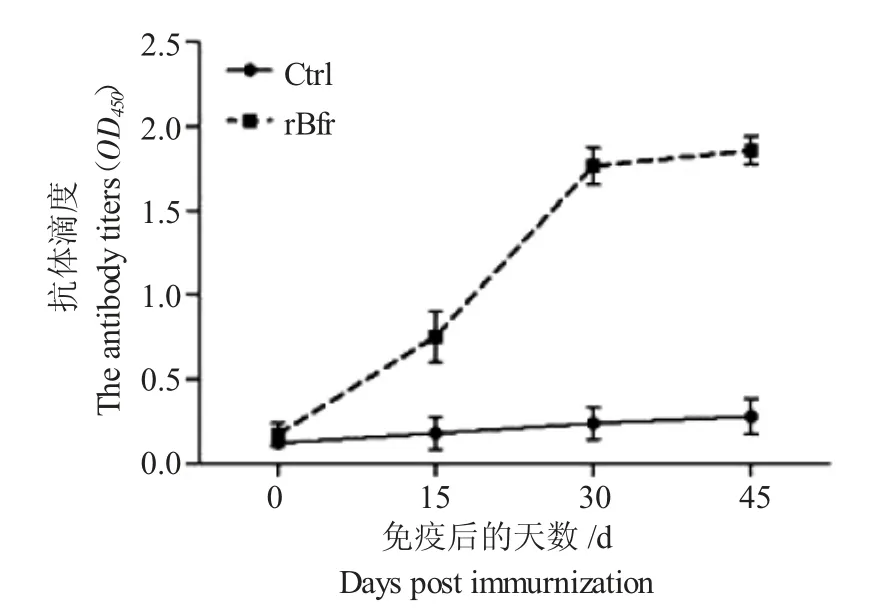
图5 免疫小鼠抗体水平变化Fig.5 The changes in specific antibody levels of mice induced by rBfr
2.5 哈维氏弧菌感染斑马鱼实验结果
将不同浓度的哈维氏弧菌腹腔感染斑马鱼,结果仅有最高剂量组即1010cfu 接种剂量组斑马鱼死亡2 尾,其余组均无死亡,表明哈维氏弧菌对斑马鱼的致病力较低。
3 讨论
哈维氏弧菌对水产养殖业危害十分严重,感染宿主范围广泛,日益引发关注[13]。然而,目前对哈维氏弧菌的研究尚处于起步阶段,远不如对迟缓爱德华菌Edwardsiella tarda、鳗弧菌Vibrio anguillarum以及嗜水气单胞菌Aeromonas hydrophila 的研究深入[14]。疫苗的应用能够使免疫动物获得针对特定病原的免疫力,是疫病防治的高效手段,在水产疫病防控中,迟缓爱德华菌、鳗弧菌和嗜水气单胞菌等疫苗的使用证实了疫苗在水产养殖业的应用前景[15]。针对哈维氏弧菌尚无商品化疫苗这一现状,本研究借鉴其它病原的研究成果,以哈维氏弧菌储铁蛋白为研究对象,尝试利用原核表达和动物模型评估其免疫效力。
Bfr 蛋白的免疫特性已在大肠杆菌和沙门氏菌等诸多细菌中得到证实[16]。本研究中,首先对该蛋白的保守性进行分析,发现Bfr 蛋白在弧菌属细菌成员间高度保守,与其它肠杆菌科细菌也具有较高的同源性(可达67%以上),揭示了该蛋白可作为弧菌属致病菌的疫苗候选蛋白。Bfr 蛋白成功在原核中表达和纯化,表达的Bfr 蛋白重组菌培养物经过离心后,菌体沉淀为棕红色,而空白对照组菌体为黄白色,猜测可能与Bfr 蛋白结合有色三价铁离子有关[17]。
本研究将纯化的Bfr 蛋白免疫小鼠,激发小鼠产生高水平的特异性抗体,表明该蛋白具有较高的免疫原性。在接下来的研究中,笔者尝试建立哈维氏弧菌感染小鼠模型以评估rBfr 蛋白的免疫保护效果。然而,接种哈维氏弧菌的小鼠并无死亡和疾病症状,表明哈维氏弧菌对小鼠不具有致病性,与前人研究一致[13]。斑马鱼是渔业疾病的经典模型,在多种病原致病机制研究中得到广泛应用[18,19]。本研究试图建立哈维氏弧菌感染斑马鱼模型,结果并不理想,接种斑马鱼并未有明显的死亡和病变。但是,用哈维氏弧菌过夜培养物上清成分接种斑马鱼,发现接种的斑马鱼全部死亡,表明哈维氏弧菌胞外产物具有致病性,与已有的研究一致[20,21]。针对此现象分析认为,哈维氏弧菌是海水病原,生长和增殖需要一定的盐度,所以其致病力和试验结果也会受外界环境因素的影响[22],有待于进一步研究确认。
本研究确定了哈维氏弧菌Bfr 蛋白具有优良的免疫原性和潜在的应用价值,为研制哈维氏弧菌疫苗提供了参考。

