不同密度的卵形鲳鲹与凡纳滨对虾混养效果研究
虞为,李欣,林黑着,黄小林,杨育凯,黄忠,李涛
(1.中国水产科学研究院南海水产研究所深圳试验基地,广东 深圳 518121;2.中国水产科学研究院南海水产研究所,农业农村部南海渔业资源开发利用重点实验室,广东省渔业生态环境重点实验室,广东 广州 510300;3.广州大学生命科学学院,广东 广州 510006)
2018 年我国凡纳滨对虾Litopenaeus vannamei养殖总量达108 万t,占对虾养殖总量的80.6%[1]。我国凡纳滨对虾主要以单养为主,近年来面临着严重的危机[2],对高产量的追求,密度和投饵量不断增加,残饵和代谢产物大量积累,养殖水环境污染和传染性疾病大规模爆发[3,4]。为解决凡纳滨对虾单养所面临的问题,开展了凡纳滨对虾混养模式的研究,以提高饲料利用率,优化养殖水体环境,减少疾病发生。
对虾池塘混养草食和杂食性鱼类,如罗非鱼Oreochromis niloticus、草鱼Ctenopharyngodon idella、褐篮子鱼Siganus fuscessens 和鲫Carassius auratus等,能改善养殖水质、降低水体的弧菌数量、提高饲料利用率和对虾存活率及养殖的生态效益和经济效益[3,5-8]。对虾池塘混养肉食性鱼类,如点带石斑鱼Epinephelus malabaricus、鲈Lateolabrax japonicus、河鲀Fugn rubripes、革胡子鲶Clarias fuscus 和真鲷Pagrosomus major 等鱼类,可捕食死虾、病虾及体质较弱的虾,切断病害传播途径,提高对虾养殖的成活率[9-13]。
卵形鲳鲹Trachinotus ovatus 俗称金鲳,经济价值高,生长速度快,当年可达到上市规格,已成为我国南方沿海养殖的首选鱼类,其养殖方式主要以鱼排网箱和抗风浪深水网箱为主[14,15]。经数年的高速发展之后,由于布局不合理,养殖密度过高,已造成了养殖水环境和生态环境的恶化,导致卵形鲳鲹病害日渐严重,产品质量和养殖效益下降[16,17]。卵形鲳鲹能适应对虾养殖池塘的生长环境,与对虾用水体空间上具有互补性,是对虾池塘很好的混养对象。因此,在凡纳滨对虾池塘中混养卵形鲳鲹,可以促进凡纳滨对虾和卵形鲳鲹养殖产业结构调整,解决目前凡纳滨对虾单品种养殖和深水网箱高密度卵形鲳鲹养殖所遇到的问题。但是,迄今有关凡纳滨对虾与卵形鲳鲹混养的研究报道较少。为此,本文进行了凡纳滨对虾单养和凡纳滨对虾-卵形鲳鲹混养的对比试验,研究卵形鲳鲹混养对主要水环境因子和养殖效果的影响,可为建立凡纳滨对虾-卵形鲳鲹混养模式提供参考。
1 材料与方法
1.1 材料
试验用凡纳滨对虾(下称对虾)购于深圳市海源生物科技有限公司,平均体质量3.4 g;卵形鲳鲹购于深圳市龙岐庄实业发展有限公司。水环境调控剂购自广州市欣海利生生物科技有限公司。对虾饲料购自越群海洋生物科技有限公司。
2019 年7~9 月,试验在中国水产科学研究院南海水产研究所深圳试验基地一口面积为0.2 hm2的池塘中设置3 排围隔进行,每排7 个,各围隔之间没有水体交换。围隔以竹桩及竹竿为支架,以聚乙烯隔水编织布包围并固定在支架上,面积为24 m2(4 m×6 m),水深1.5 m。每个围隔中均匀布置16个增氧气石,由一台功率为3.2 kW 的罗茨鼓风机充气增氧。养殖用水直接从海区抽取,进、排水口分别位于池塘角落和中央。
1.2 方法
1.2.1 确定混养卵形鲳鲹合适规格的预实验
混养实验开始前,先进行了确定卵形鲳鲹适宜混养规格的预实验。在2 m3水体的水泥池中开展体质量3.4 g 对虾和体质量25 g、45 g、65 g、85 g 和100 g 的卵形鲳鲹混养的预实验。结果表明:体质量25 g、45 g 和65 g 的卵形鲳鲹不能捕食对虾,而85 g和100 g 的卵形鲳鲹则不同程度地捕食对虾。然后,给体质量25 g、45 g 和65 g 的卵形鲳鲹投喂体质量3.4 g 的死虾,发现体质量65 g 的卵形鲳鲹能快速摄食死虾,而体质量25 g 和45 g 的卵形鲳鲹口径较小,不能摄食死虾。因此确定混养卵形鲳鲹的合适规格为65 g/尾。
1.2.2 试验设计与管理
试验设7 个处理,每个处理3 个平行,共21 个围隔。2019 年7 月22,各围隔中放养体质量3.4 g/尾的对虾1 728 尾(即7.2 × 105 尾/hm2),放养体质量65 g 的卵形鲳鲹0 尾(C 组)、4 尾(F4 组)、8 尾(F8 组)、12 尾(F12 组)、16 尾(F16 组)、20 尾(F20组)和24 尾(F24 组),9 月19 日收获,试验持续60 d。
2019 年7 月7 日设置试验围隔的池塘进水,7月8 日使用36 kg 茶子饼毒塘,7 月10 日以0.5 ppm二氧化氯进行消毒,7 月15 日施用5 kg“单细胞藻类生长素”、5 kg“肥水王”和0.5 kg“利生菌王”等水环境调控剂。试验期间,各围隔不换水,24 h 连续充气增氧;每天7:00、12:00 和16:00,投喂粗蛋白质质量分数为37%~40%的对虾饲料,投喂量试验前期为对虾体质量的5%~8%,具体投喂量根据对虾的摄食情况和天气情况及时调整,并随着对虾的生长更换适当型号的饲料,以满足对虾对饲料粒径的要求。试验期间,不给卵形鲳鲹投喂饲料。
1.3 样品采集与指标测定
1.3.1 水样的采集与测定
试验期间,每天6:00~7:00 用多参数水质分析仪(美国维赛YSI Pro2030)测定溶解氧含量、水温、盐度和pH;每7 d 在围隔四周及中央水面下0.5 m处各采集水样1 份,充分混匀后,取500 mL 混合水样带回实验室,参照《海洋监测规范GB 17378.4-2007》立即测定氨氮(ammonia nitrogen)、亚硝态氮(nitrite nitrogen)和化学需氧量(COD)[18]。
1.3.2 弧菌样品的采集与测定
试验期间,每7 d 8:00~9:00 在围隔四周及中央水面下0.5 m 处各采集水样1 份,充分混匀后,取100 mL 混合水样放入250 mL 无菌三角玻璃瓶中,低温保存,迅速带回实验室进行处理。根据样品检测分析需要,水样按10 倍稀释法制成10-1、10-2、10-3稀释水样,用移液枪吸取0.1 mL 稀释液进行平板涂布,每个梯度3 个重复,28℃培养24 h 后,用TCBS琼脂平板计数法计数弧菌数。TCBS 琼脂培养基由广东环凯微生物科技有限公司生产。
1.4 计算公式和数据处理
对虾、卵形鲳鲹的增重率(Weight gain rate,WGR)、特定生长率(Specific growth rate,SGR)、存活率(Survival ratio,SR)和饲料系数(Food conversion ratio,FCR)分别按以下公式计算:


其中W2和W1表示虾或鱼终末体质量和起始体质量,T 为试验天数,N2和N1为收获和放养时虾或鱼的数量,C 为投喂饲料的重量,W2总和W1总分别为虾和鱼终末及起始体质量。
实验所得数据以“平均值±标准差”表示,用Excel 2013 作图,通过SPSS 18.0 进行统计分析,P<0.05 表示差异显著。
2 结果与分析
2.1 试验期间水质指标变化
2.1.1 水温和盐度
由图1 可知,试验期间围隔水温随天气状况,变动在27.6~33.6℃间,在7 月31 日—8 月3 日(强降雨)和8 月24 日—8 月29 日(强降雨)期间水温大幅度下降,形成两个低温时间段。试验期间,围隔早晨最低水温为27.6℃,最高为32.0℃;下午最低水温为28.4℃,最高为33.6℃。
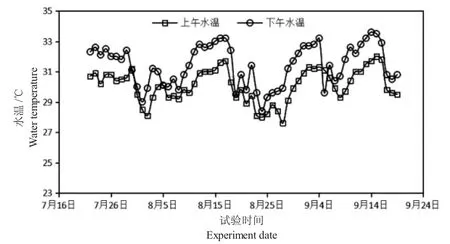
图1 试验期间水温的变化Fig.1 Fluctuation of water temperature during the experiment
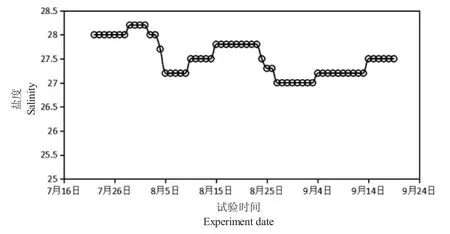
图2 试验期间盐度的变化Fig.2 Fluctuation of water salinity during the experiment
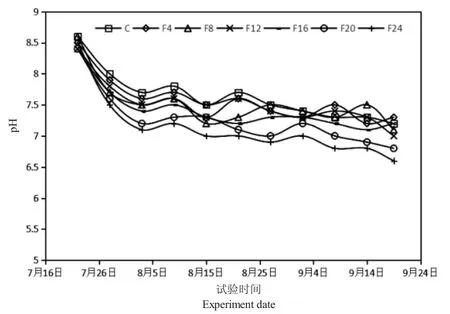
图3 试验期间pH 的变化Fig.3 Fluctuation of water pH during the experiment
由图2 可知,试验周期各围隔水体的盐度变化完全一致。养殖期间没有进排水,水体盐度总体呈下降趋势,在两次强降雨后各下降了1‰,其他时间保持平稳。
2.1.2 pH 和溶氧
由图3 可知,试验期间围隔水体pH 呈下降趋势,前期下降较快,后期相对稳定。单养组和混养组水体pH 波动范围分别为7.2~8.6 和6.6~8.6,混养组中F20 组和F24 组的pH 较其他组低。由图4可知,试验期间围隔水体溶氧量呈下降趋势,前期单养组和混合组的差别不大,后期混养组中F20 组和F24 组的溶氧量较其他组低。单养组和混养组水体溶氧波动范围分别为6.25~7.57 mg·L-1和5.48~7.62 mg·L-1。
2.1.3 氨氮和亚硝氮
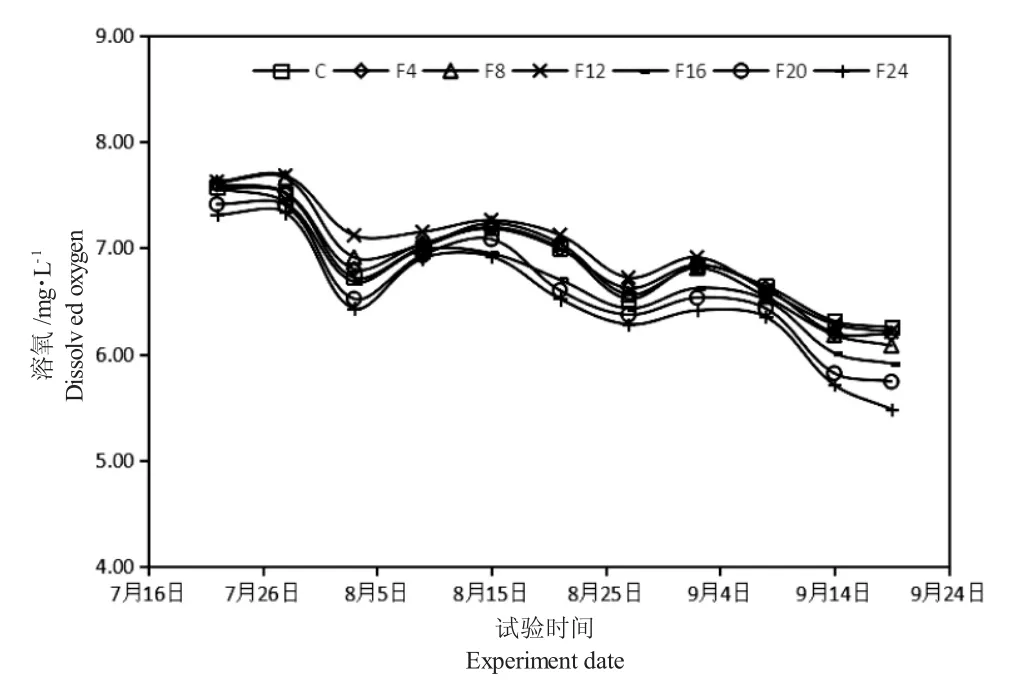
图4 试验期间水体溶解氧含量的变化Fig.4 Fluctuation of water dissolved oxygen levels during the experiment
由图5 可知,试验期间各组水体氨氮浓度逐步上升。第7 d 和第14 d 各组水体氨氮浓度差异不大;在第21~49 d,F8 组、F12 组、F16 组、F20 组和F24 组的氨氮显著低于单养组(P<0.05),而F4 组和单养组差异不显著(P>0.05);第49~60 d,混养各组的氨氮含量显著低于单养组(P<0.05)。各组水体亚硝氮浓度变化如图6 所示。第7 d 各组水体亚硝氮浓度差异不大(P>0.05);第14 d 时,F12 组、F16组、F20 组和F24 组的亚硝氮浓度显著低于单养组;第21~42 d,F8 组、F12 组、F16 组、F20 组和F24 组的亚硝氮浓度显著低于单养组(P<0.05);第49~60 d,各组混养组亚硝氮浓度显著低于单养组(P<0.05)。
2.1.4 化学需氧量
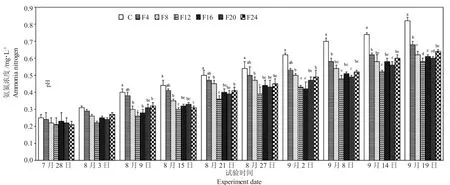
图5 试验期间水体氨氮浓度的变化Fig.5 Fluctuation of water ammonia nitrogen concentrations during the experiment
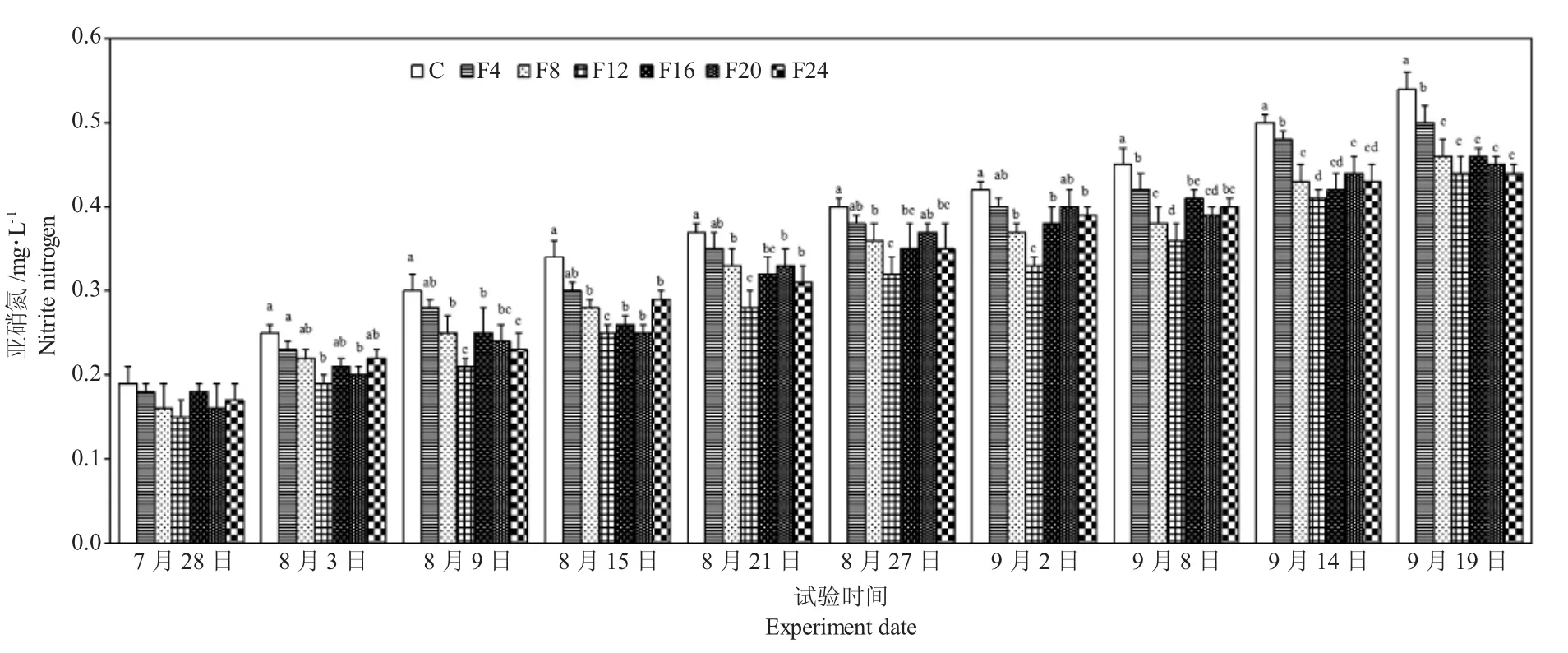
图6 试验期间水体亚硝氮浓度的变化Fig.6 Fluctuation of water nitrite nitrogen concentrations during the experiment
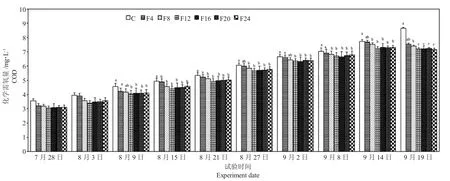
图7 试验期间水体化学需氧量的变化Fig.7 Fluctuation of water COD during the experiment
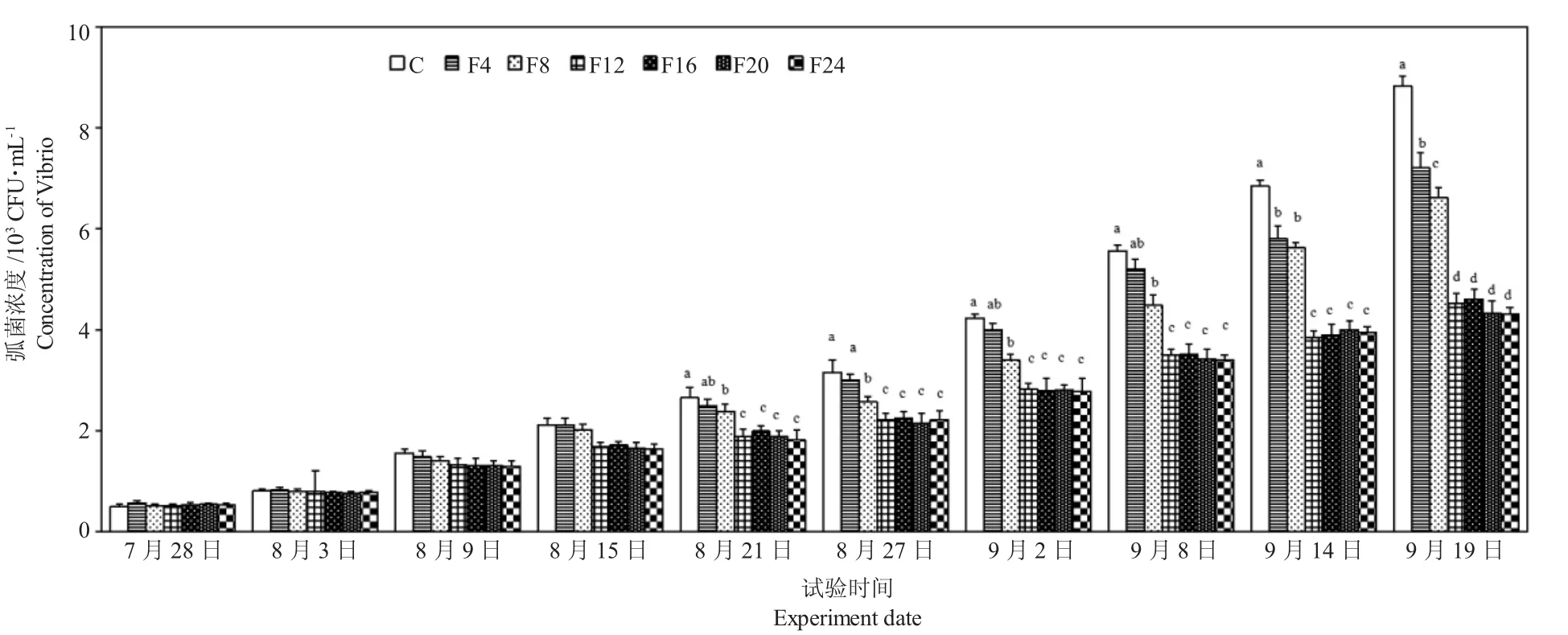
图8 试验期间水体弧菌浓度的变化Fig.8 Changes in Vibrio concentration in water during the experiment
由图7 可知,试验期间各组水体COD 值逐渐上升,单养组和各混养组水体中COD 值波动范围分别为3.3~8.64 mg·L-1和3.05~7.53 mg·L-1。第7 d 和第14 d 各组水体COD 值差异不显著(P>0.05);第28 d 和第60 d 时,混养各组的COD 值均显著低于单养组(P<0.05);其余时间,F8 组、F12组、F16 组、F20 组和F24 组的COD 值均显著低于单养组(P<0.05),而F4 组则和单养组差异不显著(P>0.05)。
2.1.5 弧菌
由图8 可知,试验前期各组水体弧菌浓度较稳定,后期增加幅度较大。单养组和混养组水体中弧菌的数量分别维持在0.5×103~8.82×103CFU·mL-1和0.51×103~7.2×103CFU·mL-1。从第35 d 开始,F8 组、F12 组、F16 组、F20 组和F24 组水体弧菌浓度均显著低于单养组(P<0.05)。试验后期,单养组、F4 组和F8 组水体弧菌浓度均显著高于其他混养组(P<0.05)。
2.2 凡纳滨对虾和卵形鲳鲹的生长
由表1 可知,混养组中F8 组和F12 组对虾增重率和特定生长率均显著大于单养组(P<0.05),F4组和F16 组对虾增重率和特定生长率与单养组差异不显著(P>0.05),而F20 组和F24 组对虾增重率和特定生长率均显著小于单养组(P<0.05)。混养各组对虾存活率均高于单养组,其中F12 组显著高于单养组(P<0.05)。F4 组、F8 组和F12 组对虾产量显著高于单养组(P<0.05),而F24 组的产量显著小于单养组(P<0.05)。
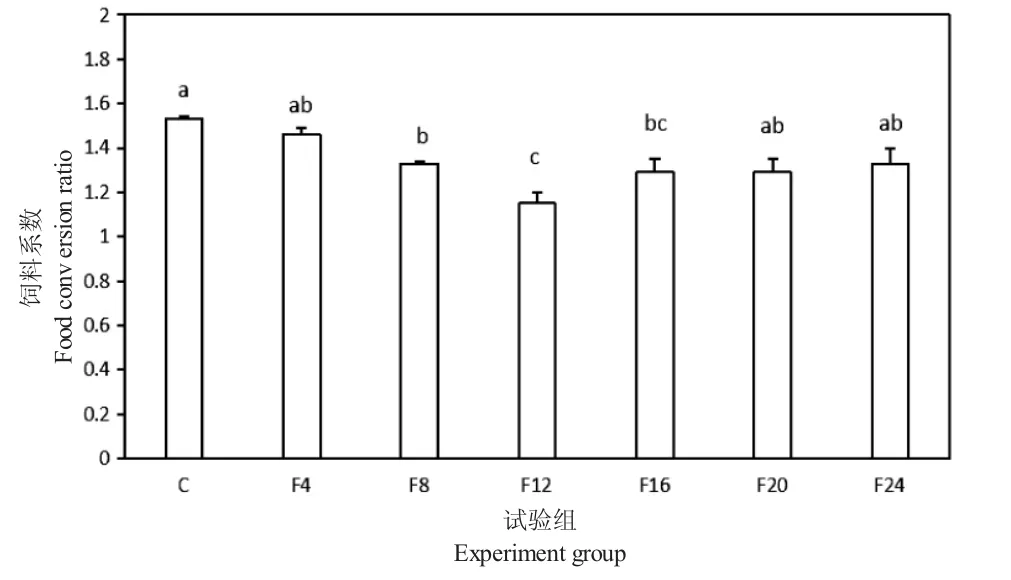
图9 试验期间各试验组凡纳滨对虾和卵形鲳鲹的饲料系数Fig.9 Food conversion ratio of Pacific white leg shrimp Litopenaeus vannamei and golden pompano Trachinotus ovatus in each group during experiment
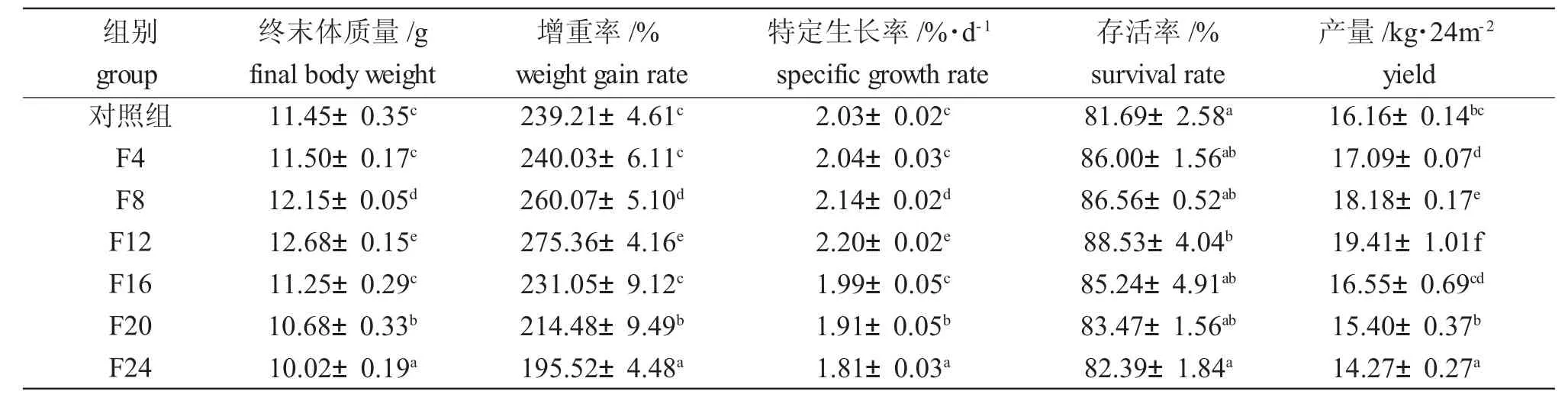
表1 试验期间凡纳滨对虾的生长情况Tab.1 The growth performance of Pacific white leg shrimp Litopenaeus vannamei during the experiment
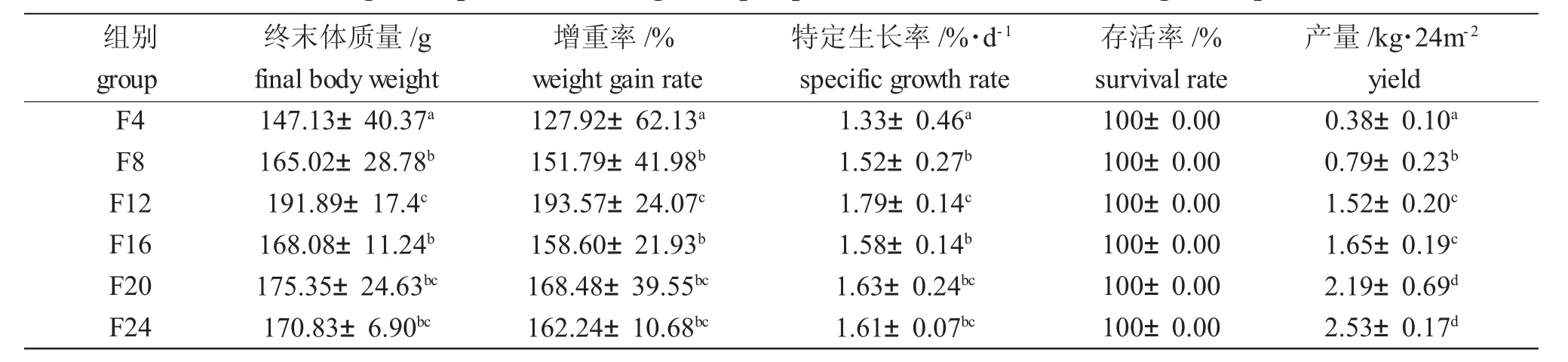
表2 试验期间卵形鲳鲹的生长情况Tab.2 The growth performance of golden pompano Trachinotus ovatus during the experiment
试验期间,卵形鲳鲹的生长情况如表2 所示,鱼的增重率和特定生长率随着密度的增大而显著增加(P<0.05),当鱼的密度超过F12 组时,鱼的增重率和特定生长率随密度的增大而显著减小(P<0.05);各组的存活率均为100%;鱼的产量与放养密度呈正相关。
试验期间,各组鱼虾的饲料系数(图9),各混养组的饲料系数均小于单养组,其中F8 和F12 组显著小于单养组(P<0.05)。
3 讨论
3.1 混养对水质指标的影响
主要受天气情况影响,单养组和混养组水体的温度和盐度变化趋势一致。混养组中F20 组和F24组的水体溶氧含量较单养组低,这可能是混养的卵形鲳鲹密度过大,更多地消耗了水体中的溶氧。对虾养殖过程中水体氨氮和亚硝氮浓度随养殖时间延长而升高[19,20],这与本研究的结果一致。相关研究表明,对虾池塘分别混养草鱼、罗非鱼和鲢Hypophthalmichthys molitrix、鳙Aristichthys nobilis 后,水体的氨氮和亚硝酸氮浓度一般低于或显著低于单养组[5,21,22]。本研究结果与以上研究相似,混养组水体的氨氮和亚硝氮浓度均低于单养组,这是由于混养的卵形鲳鲹摄食水体底部的残饵及病虾,减少了底部有机物质的堆积和饵料溶失,降低水体氨氮和亚硝氮浓度[23]。
化学需氧量(COD)是反映水体中有机物含量的指标。养殖过程中,投饵及养殖动物排泄物积累等,水体中的有机物含量不断升高,因而COD 常随养殖进程而升高[3]。本研究中,养殖初期各组的COD 差异不大,养殖中后期混养组的COD 低于单养组,其中F12、F16、F20 和F24 组均显著低于单养组,这可能是混养组中的卵形鲳鲹摄食了残饵,使得水体中有机物含量较单养组低。
弧菌是对虾养殖环境中常见的一类条件致病菌,当水体或底泥弧菌数量大于一定阈值时,对虾极容易突发疾病[24]。研究表明:虾池中混养罗非鱼可以有效降低水体中弧菌的含量,一是因为鱼类分泌的黏液和产生的其他代谢产物可能抑制弧菌[25];二是与鱼类有关的微生物群可能对弧菌有竞争作用[26]。本研究中,自从试验开始第35 d 起F8 组、F12组、F16 组、F20 组和F24 组水体弧菌浓度均显著低于单养组,这表明对虾池混养卵形鲳鲹可以抑制水体中的弧菌数量,但其具体的抑制机制有待进一步研究。
3.2 混养对对虾生长的影响
近年来,对虾与不同鱼类混养已有较为深入的研究。研究表明,对虾池塘中混养不同密度的鱼类可不同程度地影响对虾的生长速度和存活率。张嘉晨等发现,混养0.2 尾·m-2的点带石斑鱼Epinephelus malabaricus 可以提高凡纳滨对虾的特定生长率和存活率,当混养点带石斑鱼密度超过0.4 尾·m-2时,凡纳滨对虾的特定生长率和存活率随着混养鱼密度的升高而下降[9]。笔者前期研究发现,凡纳滨对虾特定生长率和存活率随着罗非鱼混养密度增大而呈现下降趋势[3]。
本研究中,F12 组(混养卵形鲳鲹密度为5 000尾/hm2)中凡纳滨对虾的特定生长率最大,当混养卵形鲳鲹密度超过5 000 尾/hm2时,凡纳滨对虾的特定生长率随着混养卵形鲳鲹密度增大而下降。其原因可能是混养过多的卵形鲳鲹加剧了鱼虾对食物、溶解氧和空间竞争,导致凡纳滨对虾摄食的饲料不足,降低了特定生长率[27]。因此以对虾为主的养殖模式中,混养卵形鲳鲹的密度不宜过高。
各混养组对虾存活率均高于单养组,其中F12组显著高于单养组。卵形鲳鲹是肉食性鱼类,可快速捕食死虾和病虾,切断病害传播途径,提高对虾的存活率[28-30]。许多鱼类黏液具有抗菌、抗真菌和细胞毒(杀伤带抗原的靶细胞)活性,与对虾混养后可以降低水体致病菌的数量,有助于改善养殖环境,提高对虾存活率[31,32]。先前的研究均表明:混养过多的鱼会导致对虾存活率比单养组低[3,5,9],但本研究中混养组凡纳滨对虾的存活率均大于对虾单养组,这是由于混养的卵形鲳鲹规格合适,其口径小,不能捕食对虾。
综上所述,养殖1 个月的凡纳滨对虾(3.4 g/尾,放养密度为7.2×105尾/hm2)和卵形鲳鲹(65 g/尾,放养密度为5 000 尾/hm2)混养,可以改善池塘的水质,提高凡纳滨对虾的生长性能和产量。
——奇妙的蛋

