超微血管成像背景下超声造影在甲状腺乳头状癌患者颈侧区淋巴结中的鉴别诊断价值
黄媛婧,康亚宁,沈润辉,崔可飞,董 刚
(郑州大学第一附属医院超声科,河南 郑州 450052)
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是起源于甲状腺滤泡上皮的恶性肿瘤[1]。也是甲状腺癌中最常见的分型,大约占甲状腺癌病例数量的80%[2]。虽然PTC进展缓慢,但颈部淋巴结早期即可出现转移,其中颈侧区淋巴结转移发生率可达64.2%。颈侧区淋巴结转移是甲状腺癌患者复发率增高和存活率降低的危险因素[3],其超声检出对临床手术方式的选择至关重要。目前应用于淋巴结血流显像的主要为彩色多普勒(color doppler flow imaging,CDFI),研究[4-5]证实评估淋巴结血管模式对鉴别良恶性淋巴结有较大意义。超微血管成像(superb microvascular imaging,SMI)和超声造影(contrast-enhanced ultrasound,CEUS)的应用可更好显示细小血管及血流走形,本研究旨在通过两者结合,更好显示淋巴结的血管分布及走形,以提高超声判断良恶性淋巴结的准确性。
1 资料与方法
1.1 研究对象收集2018年6月至2019年8月在郑州大学第一附属医院行行PTC手术及颈部淋巴结清扫术的63例患者,年龄18~73岁,男36例,女27例。每例患者选取1~2枚肿大淋巴结,共计98枚,淋巴结长径范围约5.5~25.1 mm,短径范围约3.1~14.2 mm。入选淋巴结均行CDFI、SMI及SMI+CEUS等检查,并在超声引导下行细针穿刺,最终淋巴结诊断结果由细针穿刺或手术病理获得。
1.2 仪器与方法
1.2.1 仪器与检查方法 采用日本Toshiba公司Apli0500彩色超声诊断仪,频率5~14 MHz,内置SMI和CEUS成像软件。患者取仰卧位,观察颈侧区淋巴结的结构,启动CDFI,观察淋巴结的血管模式,随后启动SMI成像技术,调整取样框,切面血流显示最清晰时存储图像,观察淋巴结的血流分布及走形,在同一切面下行SMI模式下造影,即在SMI模式下经肘静脉注入声诺维2.0 mL,切面血流显示最好时存储。全部图像存储后脱机分析并记录。
1.2.2 检测标准 CDFI、SMI、SMI+CEUS评价淋巴结血管模式的标准:良性淋巴结多表现为无血流或淋巴门型血流,转移性淋巴结多表现为边缘型或混合型。淋巴结血管模式[6]分为:1)淋巴门型血管:血流信号沿淋巴结内线状高回声分布,不考虑淋巴门位于中央区域还是边缘区域,有规律呈树枝状分布;2)中央型血管:血流信号位于淋巴结中央,但没有显示淋巴门线状高回声;3)边缘型血管:血流信号来源于淋巴结边缘或淋巴结周围相连组织的血管;4)混合型血管:血流信号同时出现在边缘及内部,可以表现为边缘型+中央型血管,也可表现为边缘型+淋巴门型血流,也可表现为淋巴门型+中央型。
1.3 统计学处理采用SPSS 25.0和Medcalc 19.1进行统计学分析。计数资料以百分数表示,比较用2检验。以细针穿刺或术后病理为参照,构建受试者工作特征曲线(receiver operating characteristic curve,ROC),得出曲线下面积(area under the curve,AUC),进行诊断效能评估。检验水准α=0.05。
2 结果
2.1 3种方法评估淋巴结血管模式与诊断结果比较本研究共纳入98个淋巴结,其中17个良性,81个转移性。CDFI检出无血流淋巴结21个,淋巴门型26个,边缘型16个,混合型35个;SMI检出无血流淋巴结13个,淋巴门型18个,边缘型27个,混合型40个;SMI+CEUS检出无血流淋巴结9个,淋巴门型12个,边缘型32个,混合型45个。
2.2 3种方法鉴别淋巴结的诊断效能比较绘制CDFI、SMI、SMI+CEUS等3种检查方法的ROC曲线,计算各项诊断指标。3种方法的AUC分别为0.719(95%CI:0.619~0.805)、0.807(95%CI:0.715~0.880)、0.869(95%CI:0.785~0.928)。SMI+CEUS对淋巴结良恶性的诊断价值高于单纯使用SMI(Z=2.586,P=0.010)、CDFI(Z=3.512,P<0.001),SMI对淋巴结良恶性的诊断价值优于CDFI(Z=2.210,P=0.027)。SMI+CEUS的敏感性优于单纯使用SMI(χ2=4.891,P=0.027)、CDFI(χ2=26.625,P<0.001),SMI的敏感性优于CDFI(χ2=10.123,P=0.001)。3种检查方法的特异性进行两两比较,SMI+CEUS与CDFI(χ2=0.234,P=0.628),SMI+CEUS与SMI(χ2=0.000,P=1.000),SMI与CDFI(χ2=0.234,P=0.628),比较差异均无统计学意义。见图1、表1。
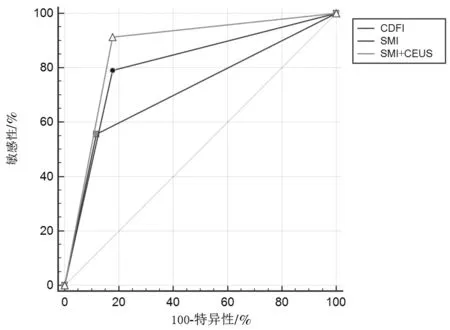
图1 3种方法的ROC曲线比较

表1 3种方法评估淋巴结性质的诊断效能比较
3 讨论
高频超声作为鉴别淋巴结良恶性的首选检查方法,不仅可以观察淋巴结的结构,还可直观显示淋巴结的血管模式,其可作为鉴别淋巴结良恶性的重要参考[7]。转移性淋巴结中的肿瘤细胞由皮质侵入淋巴结实质,可破坏淋巴门血管,形成走行不规则、管径粗细不均的新生血管,并向淋巴结内走形,故血流分布于淋巴结周边,内部分支走行杂乱,不显示门型血流。但CDFI技术有限,只能显示直径>2 mm、流速高的血管[8],不能显示低速、细小血管,且当淋巴结出现钙化或坏死时,运用CDFI技术显示的血流不真实,因此CDFI鉴别淋巴结良恶性存在一定的限制性。
SMI作为一种全新的血流成像技术[9-10],可识别并显示微小及低速血流信号。本研究中,有8个良性淋巴结因其内血流速度较低,CDFI仅显示点状血流,而SMI显示细分支门型血流,进而提示诊断。本研究表明,SMI对淋巴结良恶性的鉴别诊断优于CDFI。
在临床中,SMI、CEUS技术均有一定的局限性。SMI能够显示淋巴结内的血流微灌注,诊断转移性淋巴结的敏感性、特异性、准确性更高[11-12]。通过观察造影剂进入淋巴结的方式可显示淋巴结的血管走形,但观察淋巴结的小血管分布仅在达峰前可识别,观察时间窗较短,且对于淋巴结周边的小血管不易识别。SMI技术可识别微小低速血管,但当淋巴结较深、体积较小时,运用SMI检测真实血流状态较困难;当淋巴结位于颈总动脉周围时,受搏动影响,易产生伪彩;另外对操作者依赖性强,不能重压淋巴结,避免压迫其内微小血管;且SMI技术不能观察到淋巴结中的微灌注。
鉴于SMI、CEUS的局限性,在本研究中,采用了SMI背景下进行CEUS,两者联合使得SMI技术对非血管成分的滤过效应加强,对小血管的显示效果更好。在整个造影周期,大、小血管均直接显影,可以清晰观察到淋巴结周边及内部的血管分布及走形。
总之,SMI联合CEUS对于PTC患者颈侧区淋巴结转移的诊断优于单纯SMI及CDFI,在临床工作中,可作为一种评价淋巴结血管模式的全新技术。

