重离子束辐射对海带配子体克隆的影响
赵聚萍,罗世菊,李晓捷,武瑞娜
(山东东方海洋科技股份有限公司,国家海藻与海参工程技术研究中心,山东省海藻与海参技术创新中心,山东省海藻遗传育种与栽培技术重点实验室,山东 烟台 264003)
海带作为一种大型经济海藻,在工业、食品、医药等领域都有着非常广泛的应用。我国是较早进行比较系统的遗传育种研究的国家, 配子体克隆技术的运用,使海带的种质得以长久保存,并且通过配子体杂交技术培育海带新品种,解决了传统育苗育种选育周期长、优良性状容易退化等问题。为了丰富育种素材,采用物理诱变等方式诱导海带配子体产生变异,能缩短获得优良变异植株的时间。
目前在农业生产上主要育种方式有:杂交育种、诱变育种、单倍体育种、多倍体育种以及基因工程育种。其中诱变育种根据作用机理的不同,主要分为化学诱变和物理诱变。X 射线、γ 射线、ARTP、紫外线和重离子等是目前进行物理诱变的主要方法。早在20 世纪80 年代就利用重离子诱变开展初步试验。重离子辐射属于电离辐射的一种,其基本作用机理同X 射线和γ 射线相同,但是重离子束单位剂量的诱变效率是X 射线和γ 射线等低LET 方法的10 倍[1]。重离子辐射的突出优势主要表现在生物品种改良及选育。目前,在农作物、微生物等方面已经利用重离子辐射筛选获得多个有利突变体[2-4];重离子束辐照在条斑紫菜、海带等大型海藻遗传育种方面取得初步研究效果[5-7]。
现利用12C 重离子束对种质库保存的8 个配子体克隆系进行3 次辐射试验,通过观察辐射后海带配子体细胞状态及细胞死亡情况,判断重离子束辐射对海带配子体的作用范围,以确定海带配子体重离子辐射的适合剂量范围,为丰富育种素材,进一步进行海带重离子束辐射育种提供依据。
1 研究方法
1.1 试验材料
试验选用的材料为山东东方海洋科技股份有限公司种质库中保存的海带配子体克隆。第一次辐射材料分别为:019601016、019601001、169901002、169901003、2503 ♀混、2503 ♂混、481003002 和YDJ491004006,共8 个克隆系;第二次辐射材料分别为:019601016、019601001、2503♀混、2503♂混、481003002 和YDJ491004006 共6 个克隆系;第三次辐射材料分别为:019601016 和169901002,共2个克隆系。
1.2 试验设备
超声波细胞粉碎仪、400 目筛绢、500 mL 烧杯、玻璃板、3.5 cm 培养皿、9 cm 培养皿、2 mL 冻存管、200 μL 离心管、100 mL 锥形瓶、显微镜等。
1.3 试验方法
第一次试验:将8 个克隆系的克隆用超声波细胞粉碎仪打碎,超声波设定功率为200 W,共超声6 次,10 s/次,间隔时间6 s。将打碎后的克隆经400 目筛绢过滤,得到1~4 个细胞的细胞段滤液,倒入直径9 cm 的培养皿中,预培养10 d。将预培养后的克隆进行收集,装入2 mL 的冻存管运输,每个克隆系各装12 支。辐射剂量为10,20,40,50 和60 Gy,每个辐射剂量2 支,对照组2 支。
第二次试验:将6 个克隆系克隆团直接装入200 μL 离心管运输,每个克隆系各装12 管,12 管一组装于直径3.5 cm 的塑料培养皿内,两皿底对扣封口膜密封。辐射剂量为80、120、160、200 和240 Gy,每个辐射剂量2 管,对照组2 管。
第三次试验:将2 个克隆系克隆团直接装入200 μL 离心管运输,每个克隆系各装12 管,12 管一组装于直径3.5 cm 的塑料培养皿内,两皿底对扣封口膜密封。辐射剂量为60、80、120、160 和200 Gy,每个辐射剂量2 管,对照组2 管。
试验流能量为80 Mev,剂量率为50 Gy/min。辐射完成后,材料运回实验室,转入100 mL 锥形瓶内,放入冷藏箱内自然光下培养。冷藏箱温度为8~12 ℃,每周换水、镜检1 次,观察克隆状态。
2 结果分析
2.1 第一次辐射试验
辐射完成后,定期观察辐射克隆。前期细胞形态、色泽与对照组比较,没有明显变化,不同辐射剂量之间也没有明显差别;170 d 镜检观察辐射组细胞形态色泽,与对照组比较有变化,辐射组细胞生长不如对照组舒展,稍有些圆。180 d 镜检发现辐射对雌细胞影响较大,其中2 个60 Gy 雌克隆系个别细胞膨大、不分裂直至死亡(图1),或者一个细胞分裂成含10 多个细胞球状体,色素正常;雄克隆系变化不明显;对照组克隆细胞生长状态均正常。
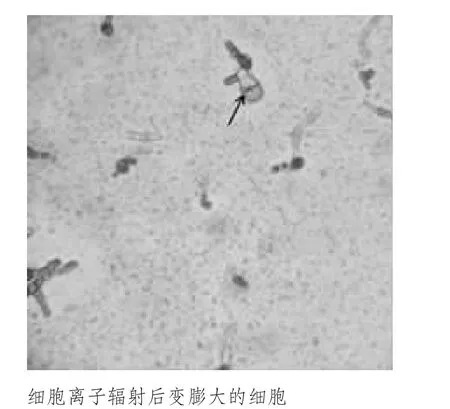
图1 海带配子体克隆雌性
2.2 第二次辐射试验
辐射完成后,定期观察辐射克隆。前期细胞形态、色泽与对照组相比没有明显差别,各试验组不同辐射剂量之间也没有明显差别。50 d 镜检,出现细胞膨大、死亡,对照组克隆细胞生长状态好。83 d镜检,不同克隆系各辐射组死亡细胞明显增多,不同克隆系间表现稍有差别,辐射剂量越大细胞死亡越多,160 Gy 辐射剂量下克隆系除少部分细胞生长正常,大部分细胞膨大、趋于死亡或死亡,200 和240 Gy 辐射剂量下克隆系细胞几乎全部膨大、趋于死亡或死亡;对照组克隆细胞生长状态均正常。180 d镜检,有存活细胞的辐射组逐渐恢复生长。第二批克隆存活情况见表1。
2.3 第三次辐射试验
辐射完成后,定期观察辐射克隆。前期细胞形态、色泽与对照组相比没有明显差别,不同辐射剂量的各试验组之间也没有明显差别。75 d 镜检,辐射克隆细胞膨大、死亡,对照组克隆细胞生长状态好。90 d 镜检,不同克隆系各辐射组死亡细胞明显增多(图2 和图3)。110 d 镜检,随辐射剂量的增大,克隆死亡情况逐渐增加,160 Gy 辐射剂量下除少部分细胞还存活,大部分细胞膨大、死亡或趋于死亡;辐射剂量200 Gy 下的克隆细胞几乎全部膨大、死亡或趋于死亡。120 d 镜检,辐射剂量60 Gy 下细胞存活率约为80%~90%,辐射剂量80 Gy 下细胞存活率约为50%~60%。180 d 镜检,除编码为169901002的海带配子体克隆细胞在200 Gy 辐射剂量下没有细胞存活,其余剂量下辐射材料均逐渐恢复生长;对照组克隆细胞生长状态均正常。
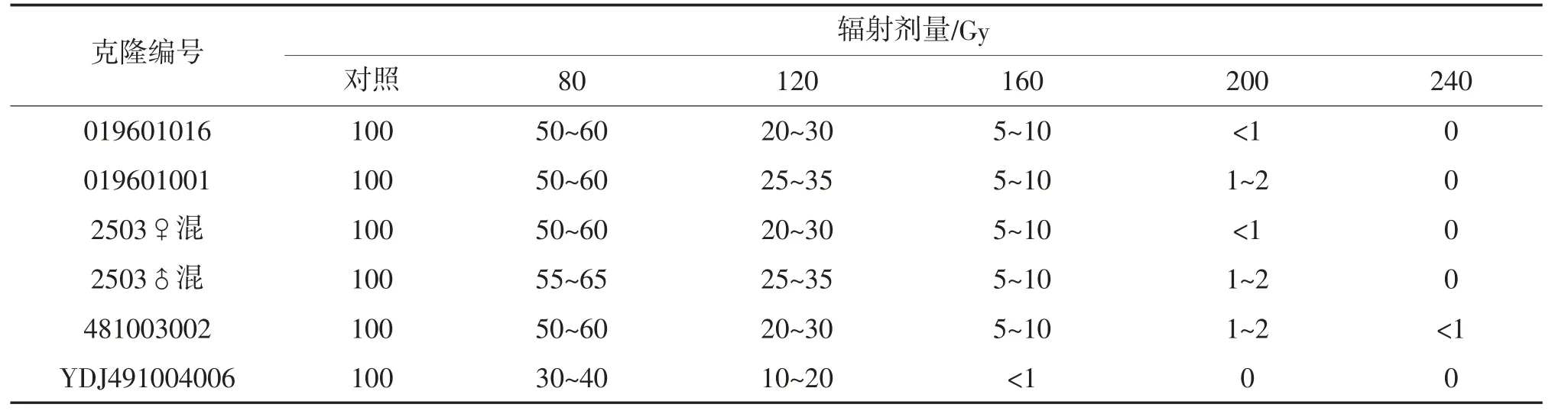
表1 第二批海带配子体重离子辐射后细胞存活情况

图2 编码为019601016 的海带配子体细胞在不同辐射剂量下90 d 镜检结果

图3 编码为169901002 的海带配子体细胞在不同辐射剂量下90 d 镜检结果
3 讨论
第一次试验考虑到重离子辐射的穿透性,先将海带配子克隆利用超声波打碎,预培养10 d,待克隆状态恢复后进行辐射。而第二、三次试验为了避免超声波打碎影响海带配子体细胞的状态而直接对克隆团进行辐射。
由试验结果可见,利用12C 重离子束对海带配子体克隆进行辐射,使配子体细胞发生变化的最低辐射剂量为60 Gy;随着辐射剂量的增大,细胞死亡增多;240 Gy 辐射剂量下,仅编码为481003002 的海带配子体的一个克隆系有存活,80 Gy 辐射剂量下细胞存活率约为50%~60%。
不同海带配子体克隆系对于重离子辐射的耐受力也有差别,海带雄配子体比雌配子体耐受力稍强。第二次试验中编码为YDJ491004006 的海带配子体克隆各辐射剂量下细胞存活率略低于其他同辐射剂量下的海带配子体克隆系,这可能与海带配子体自身的状态有关,运输时间、温度等因素可能对试验结果有一定的影响。
定期观察辐射后海带配子体细胞的状态。前期,海带配子体细胞无论形态还是色泽方面与对照组相比都没有明显变化。约2 个月后,差异逐渐表现出来,有的细胞膨大、趋于死亡或死亡,而有的细胞镜检一直无明显变化,细胞形态、色泽均正常,但能因辐射受到损伤不分裂不生长,最终死亡。
4 结论
通过3 次重离子束辐射海带配子体克隆试验,可大体判断重离子束辐射对海带配子体起作用的剂量为60~240 Gy。
重离子辐射可能诱导海带配子体产生大量变异,对辐射后的海带配子体克隆进行扩增培养、育苗,期待能在较短时间内获得具有优良性状的变异植株,分离、保存与优良性状相关的新基因;还可以结合海带配子体克隆细胞杂交技术获得数量多、种类多的突变植株[7]。同时,利用海带配子体克隆培养方法分离和培养目标植株的配子体细胞,可以作为新的海带遗传资源进行保存,丰富海带种质资源库。

