旋覆花治疗胃食管反流病作用机制的网络药理学研究*
张渊,喻斌
1.湖南中医药大学,湖南 长沙 410208; 2.湖南中医药大学第一附属医院,湖南 长沙 410007
胃食管反流病(gastroesophageal reflux disease,GERD)是指胃内容物反流造成的一系列症状及并发症,通常反流至食管、咽喉,也有部分患者可反流至气管和肺[1]。临床多表现为反酸、胃灼热、吞咽困难等消化道症状[2],也有表现为慢性咳嗽、哮喘,或咽部异物感、声嘶等,也可导致食管及胃食管癌变[3]。由于现代社会工作节奏快,饮食习惯、生活习惯不规律,精神压力大,导致该病在城市发病率明显升高[4]。该病起病隐匿,发病机制复杂,临床上以抑酸护胃为主,因临床症状多,用药常伴随药物不良反应,患者依从性低等问题。
中医根据临床症状,将GERD归属于“食管瘅”“噫醋”“吐酸“等范畴[5]。《临证指南医案·脾胃》曰:“脾宜升则健,胃宜降则和”。若因饮食、劳倦、情志所伤,致使中焦土虚木旺、或痰阻气逆、脾胃气机升降失调、胃气不降反逆,出现反酸、胃灼热等,发生GERD。该病关键病机主要在于胃失和降、胃气上逆[6],治疗多以“和胃降逆”为主,并随症加减。临床常用旋覆花、枳壳、厚朴、代赭石等降胃气,或用大黄、沉香、乌药等通降腑气的中药。名中医周亨德在治疗GERD时常取旋覆花配合代赭石、姜半夏等和胃降逆[7]。笔者在跟随导师喻斌教授学习过程中发现,老师运用旋覆花治疗胃气逆导致的嗳气、呕吐、反酸等及肝气逆导致的胁痛有一定疗效。
旋覆花为菊科植物旋覆花或欧亚旋覆花的头状花序,在《神农本草经》中称之为“金沸草”,味苦、辛、咸,性温,归肺、大肠经,具有降气、消痰、行水的功效。清代黄元御《长沙药解》中言:“凡草木之味,咸者绝少。咸皆治下,咸而能治上焦者尤少。惟此味咸而治上,为上中二焦之药”。运用旋覆花降之特性来治疗胃气上逆之证,符合中医辨证施治的特点。旋覆花的化学成分主要有倍半萜类、黄酮类和糖类,其具有抗炎、抗细胞增殖、抗氧化等药理作用。但旋覆花治疗GERD的具体作用机制少见报道。因此,本文采用网络药理学方法分析旋覆花治疗GERD作用机制,为其在临床的应用提供理论基础。
1 资料与方法
1.1 资料网络图像化软件Cytoscape(3.7.0版);蛋白质相互作用平台(UniProt数据库,https://uniprot.org/);中药系统药理学数据库和分析平台(TCMSP,http:tcmspw.com/tcmsp.php);功能性蛋白连接网络数据库STRING(11.0版本,https://string-db.org/cgi/input.pl);注释、可视化和整合发现数据库(DAVID 6.8,https://david.ncifcrf.gov/);药物银行(DrugBank,https://www.drugbank.ca/);在线人类孟德尔遗传数据库(OMIM);治疗靶点数据库(TTD);Genecards数据库(https://www.genecards.org/)。
1.2 方法
1.2.1 旋覆花的活性成分筛选及其作用靶点预测 在TCMSP数据库,以“旋覆花”为关键词进行检索,设置口服生物利用度(oral bioavailability,OB)值≥30%、药物类药性(drug-likeness,DL)值≥0.18,获得旋覆花的活性成分。点击进入“Related Targets”界面,获得旋覆花活性成分对应的作用靶点。在Uniprot数据库中将作用靶点的名称转化为基因名。运用Cytoscape软件构建中药活性成分-预测靶点网络图,以“节点”表示活性成分和预测靶蛋白,以“边”表示成分与靶点之间的作用关系,可视化分析活性成分-预测作用靶点相互作用的关系。
1.2.2 检索GERD的相关靶点 以“Gastroesophageal Reflux”和“Gastro esophageal Reflux Disease”为关键词,在DrugBank、OMIM、TTD、GeneCards数据库检索当前已知的与GERD发病明确相关的基因靶点。
1.2.3 构建旋覆花-GERD靶点蛋白互作网络(PPI)和筛选关键基因(Hub) 将1.2.1所得的药物预测作用靶点和1.2.2所得的GERD疾病靶点分别导入STRING数据库,选择对象为“Homo sapiens”,对蛋白互作拓扑结构基因节点进行拓展,建立PPI互作网络。运用Cytosecape软件中的“merge”功能,将上述得到的两个网络提取交集,得到旋覆花治疗GERD直接或间接靶标蛋白及其互作网络。运用Cytoscape软件中的“cytohubba”插件,对旋覆花治疗GERD直接或间接靶标蛋白互作网络采用MCC、MNC、中心度值及中介中心性值算法,选“Top10”,分别获得得分前10的基因,并对这4组基因取交集,即为旋覆花治疗GERD的关键靶点(Hub基因)。
1.2.4 旋覆花治疗GERD靶标蛋白GO分析及KEGG通路富集分析 在DAVID数据库,对1.2.3所得Hub基因进行GO功能分析及KEGG通路分析(P<0.01),筛选显著性的基因并作图。运用Cytoscape将符合条件的通路可视化,得到Hub基因-通路网络图,运用“merge”将此图与1.2所得的活性成分-预测靶点网络图合并,得到中药活性成分-关键靶点-通路网络。
2 结果
2.1 旋覆花的药物活性成分在TCMSP数据库,搜索得到符合条件的旋覆花活性化合物共19种,预测作用靶点393个,主要包括红车轴草素(Pratensein)、异鼠李素(isorhamnetin)、β-谷甾醇(beta-sitosterol)、棕榈酸香树脂醇酯(amyrin Palmitate)、异热马酮(isoramanone)、柽柳黄素(tamarixetin)、旋覆花次内酯(inulicin)3-[(3aS,4R,5R,8aR)-4-羟基-5,7-二甲基-3-亚甲基-2-氧代-4,5,8,8a-四氢-3aH-环庚基[b]呋喃-6-基]乙酸丙酯(3-[(3aS,4R,5R,8aR)-4-hydroxy-5,7-dimethyl-3-methylene-2-oxo-4,5,8,8a-tetrahydro-3aH-cyclohepta[b]furan-6-yl]propyl acetate)、[(3aR,4R,7aR)-5-[(1S)-4-乙酰氧基-1-甲基丁基] -6-甲基-3-亚甲基-2-氧代-3a,4,7,7a-四氢苯并呋喃-4-基]乙酸酯[(3aR,4R,7aR)-5-[(1S)-4-acetoxy-1-methyl-butyl]-6-methyl-3-methylene-2-oxo-3a,4,7,7a-tetrahydrobenzofuran-4-yl] acetate等(表1)。
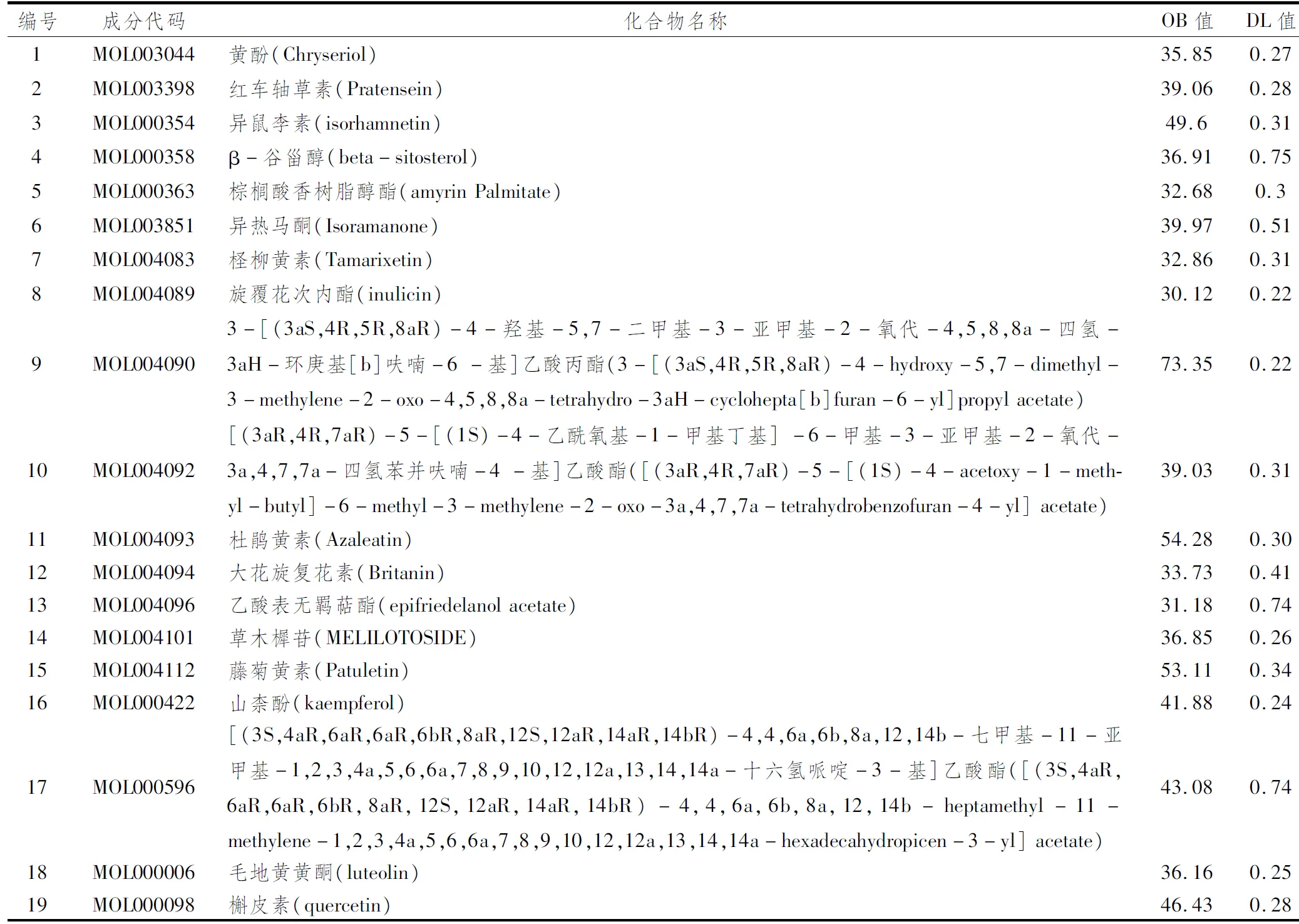
表1 旋覆花的活性成分
2.2 旋覆花活性成分及其预测靶点可视化分析运用Cytoscape软件构建活性成分-预测靶点网络图(图1)。该图显示共203个节点(活性成分节点共16个和预测靶共187个)和393条边,其中粉色代表活性成分,蓝色代表预测靶点,每条边表示活性成分与预测靶点相互作用关系。预测靶点按度值排列分为3圈(由外向内,度值由小到大)。度值作为网络中关键节点的标准之一,表2列举了图2 网络中的重要节点(度值>10)及其拓扑参数。
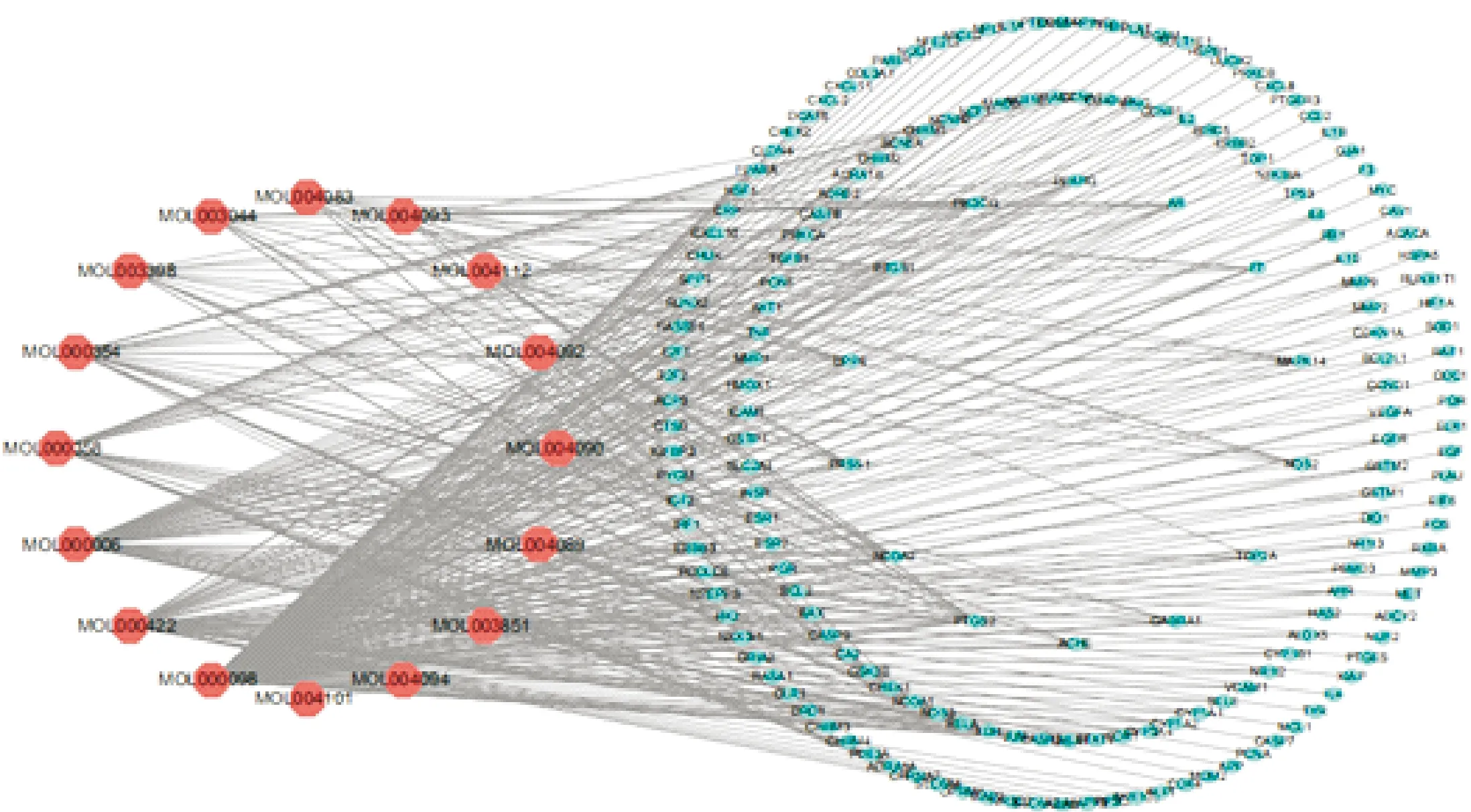
注:粉色代表活性成分,蓝色代表预测靶点图1 中药活性成分-预测靶点网络图

表2 活性成分-预测靶点网络图关键节点及其拓扑学参数
2.3 构建旋覆花治疗GERD的靶点蛋白互作网络(PPI)在DrugBank、OMIM、TTD及Genecards数据库分别搜索与疾病发病相关基因分别为109、394、7、181个,剔除重复基因后,筛选得到353个与GERD发病密切相关的靶点。将旋覆花活性成分对应的预测作用靶点和GERD发病相关靶点产STRING数据库中进行拓扑结构扩展,得到预测作用靶点PPI网络和与GERD发病相关靶点PPI网络。前者显示拓展后直接或间接预测作用靶点有706个,相互作用关节有8 543个;后者显示拓展后与GERD发病相关直接或间接作用靶点有846个,相互关系为7 851个。运用Cytoscape软件提取两个网络的交集,得到旋覆花治疗GERD作用靶点PPI 网络(图2),删除与主网络不关联的靶点后,网络显示靶点数有138个,相互作用关系数为859条。图中靶点按度值分度(最外圈为1~9,左侧小圈为10~39,右侧小圈为40~60,度值越大,靶点节点直径越大)。
2.4 筛选旋覆花治疗GERD的Hub基因运用Cytoscape软件的“Cytohubba”插件中的MCC、MNC、中心度性及中介中心性值算法,分别获得靶点互作网络图(图2)的关键网络,提取4个网络的交集(表3),获得8个节点和28个相互作用关系(图3)。图示的8个靶点即为旋覆花治疗GERD的关键靶点(Hub基因)。
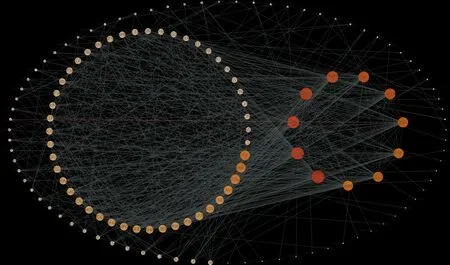
图2 旋覆花治疗GERD作用靶点网络图
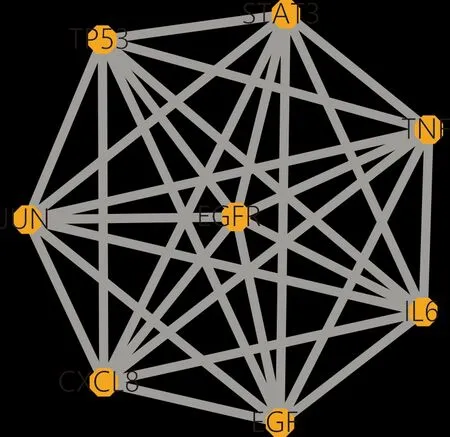
图3 旋覆花治疗GERD的关键靶点网络

表3 Cytohubba插件筛选Hub基因表格
2.5 Hub基因的GO功能分析及KEGG通路分析对Hub基因进行GO功能分析和KEGG通路分析显示,8个靶点共与80个生物学过程和57条信号通路有关,根据P<0.01进行筛选,得到37个生物学过程与36条信号通路。旋覆花治疗GERD主要涉及调节转录、细胞增殖、ERK1和ERK2级联、改善基因表达、一氧化氮生物合成过程、MAP激酶活性、蛋白激酶B信号传导、RNA聚合酶II启动子转录、细胞凋亡、衰老、调节脂质贮存、血管生成、线粒体膜通透性的调节、MAPK级联、连环蛋白进入细胞核及对脂多糖反应等生物学过程(图4)。
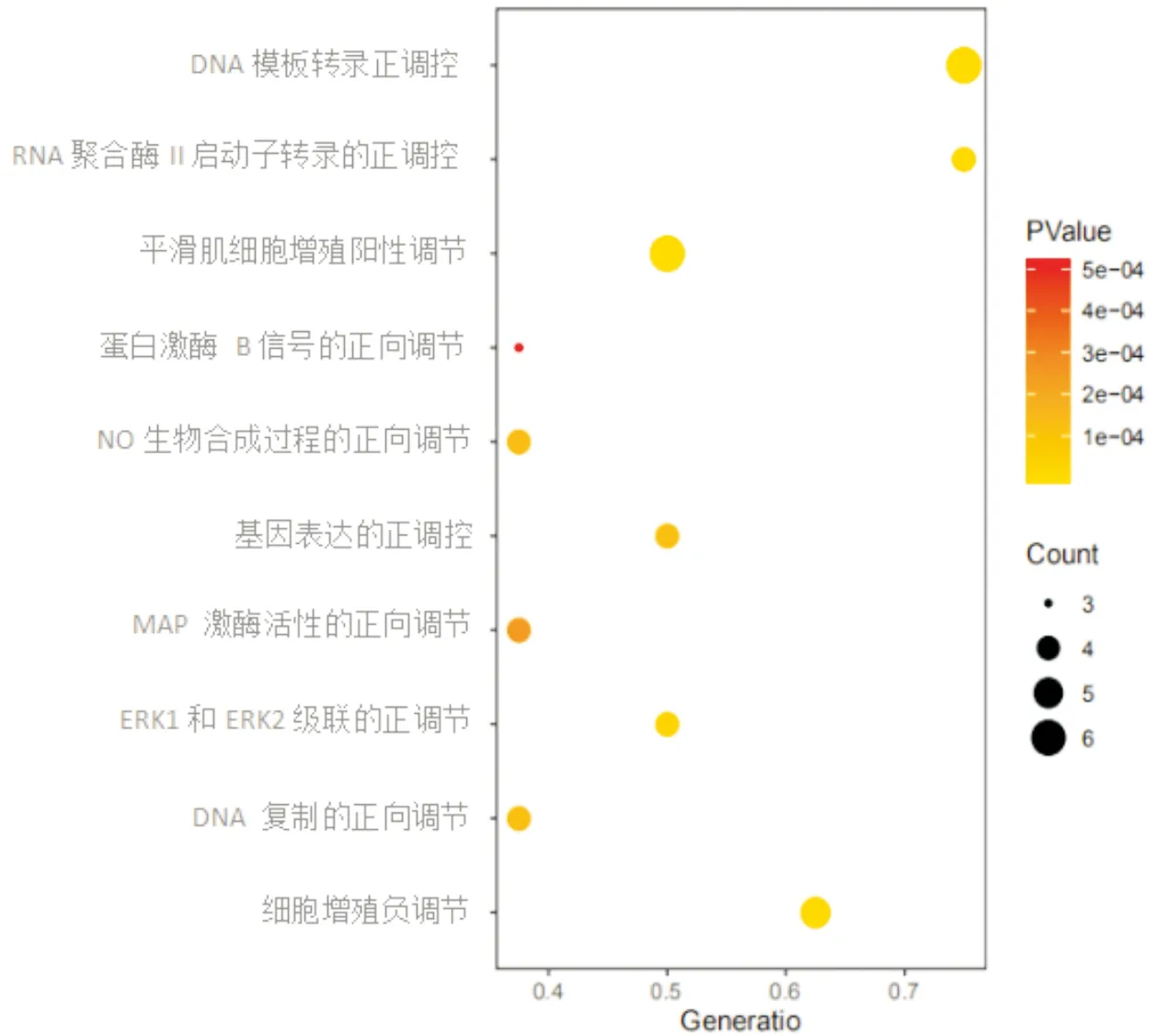
注:X轴是Generatio,Y轴是生物过程名称,气泡颜色代表P值,气泡大小代表富集基因数Count图4 GO功能富集分析-生物过程气泡图
KEGG通路分析结果主要富集在丙型肝炎、乙型肝炎、癌症信号通路、膀胱癌、炎症性肠病、胰腺癌、百日咳、MAPK信号通路、类风湿性关节炎、HIF-1 信号通路、美洲锥虫病、Toll样受体信号通路、FoxO 信号通路、非酒精性脂肪肝、甲型流感、单纯疱疹感染、癌症中的蛋白多糖、疟疾、子宫内膜癌、军团菌感染、NOD样受体信号通路、非小细胞肺癌、人嗜T淋巴细胞病毒感染、胶质瘤、幽门螺杆菌感染的上皮细胞信号转导等方面,与旋覆花治疗GERD的潜在靶标的相关性明显。
运用Cytoscape软件绘制通路-靶点网络,将之与预测2.2所得的活性成分-预测靶点合并,得到中药活性成分-关键靶点-通路网络(图5),图中显示8个作用靶点,4个活性成分与36个通路及150条相互作用关系。

注:蓝色代表通路名;绿色代表活性成分;红色代表关键靶点图5 中药成分-靶点-通路网络图
3 讨论
本研究运用网络药理学的方法对旋覆花治疗GERD的作用机制进行研究,通过对中药活性成分-关键靶点-通路网络进行分析发现,旋覆花的有效活性成分是槲皮素、毛地黄黄酮、β-谷甾醇、山柰酚等。槲皮素和山柰酚都属于植物类黄酮,且都具有降低损伤引起的氧化应激的特性[8-9]。β-谷甾醇是植物甾醇类成分之一,有研究表明[10],其可增强机体清除氧自由基的能力,可抑制炎性因子的释放与聚集来保护胃食管黏膜。毛地黄黄酮,又称木犀草素,其可下调NF-κB等多种炎症因子的表达[11]。NF-κB信号通路的激活及上调各种炎症因子水平,是导致GERD发生的一个重要原因。故笔者推测,旋覆花可能是通过抑制食管黏膜下炎症因子表达,提高胃食管黏膜防御能力从而阻止反流发生。
旋覆花治疗GERD的治疗的关键靶点分别为JUN、STAT3、TP53、TNF、IL-6、CXCL8、EGFR和EGF。肿瘤坏死因子(TNF)参与多种炎症疾病,能通过多种效应激活 NF-κB信号通路,使炎症活跃,导致食管和胃食管黏膜癌变[12]。白细胞介素-6(interleukin-6,IL-6)可在胃食管反流等慢性炎症环境中协同白细胞介素-8(IL-8)、表皮生长因子(EGFR)、表皮生长因子(EGF)等炎症因子构建炎症网络[13];信号传导蛋白和转录激活物(STAT3)在炎症网络中起关键作用—催使慢性炎症肿瘤化及促进肿瘤内血管新生与转移[14];JUN在控制细胞恶变方面具有重要作用;TP53突变是胃癌最常见的基因突变之一[15]。相关研究发现,旋覆花中分离出的倍半萜内酯二聚体(XFH-31)可以阻断TNF-ɑ激活 NF-κB、MAPKs信号通路[16],下调 IL-6 等炎症因子并阻止STAT3介导的肿瘤发生和转移。
根据GO分析的结果,旋覆花抗GERD的作用机制主要集中于抑制炎性细胞增殖、促进凋亡、改善基因表达、抑制一氧化氮合成和调节免疫应答等,同时还与炎症细胞的代谢密切相关。除化学损伤、炎症反应与免疫反应外,胃食管交界产生的一氧化氮到达细胞毒性浓度也可能促使GERD发生与恶化[17]。为进一步了解旋覆花治疗GERD可能性的通路,继续对关键靶点行KEGG通路分析。结果显示,在所有通路中,富集基因较多且与胃食管反流病机制关系较密切的有HIF-1信号通路、MAPK信号通路、Toll样受体信号通路、与癌症相关的通路、NOD样受体信号通路和幽门螺杆菌感染的上皮细胞信号转导通路等。
胃酸或胆汁反流可导致胃食管黏膜血管受损,局部缺氧、缺血,易引起黏膜糜烂和溃疡,血管再生对于损伤部位的修复尤为重要。缺氧诱导因子-1(HIF-1)可维持细胞在低氧环境内存活,在胃食管疾病中HIF-1可激活血管内皮生长因子(VEGF),加速血管新生,促进损伤黏膜的愈合[18];另在肿瘤疾病中HIF-1也可加速肿瘤微环境内的血管新生,加速肿瘤侵袭与转移[19]。Calvino等[20]研究发现,旋覆花提取物具有抗肿瘤微环境内新血管生成的作用。故笔者推测,旋覆花可能通过调控HIF-1通路影响相关因子,起到修复胃食管黏膜及阻止黏膜病变恶化的作用,但具体机制有待进一步研究。丝裂原活化蛋白激酶(MAPK)具有促进炎性细胞增殖、抑制凋亡等作用,包括ERK、JNK和p38三个亚族。在胃食管反流病发病机制中,p38MAPK信号通路被TNF-ɑ、酸性环境刺激或上游Toll样受体信号通路激活后,上调IL-6、IL-8、IL-33、TNF-ɑ等炎症因子,刺激诱导性一氧化氮合酶合成一氧化氮,导致GERD发生与恶化[21]。Toll 样受体(TLRs)与NOD样受体(NLRs)都是模式识别受体(PRRs)家族成员,TLRs分布于膜表面,参与细胞凋亡及免疫激活。NOD样受体在人体上皮细胞和免疫细胞的胞质中广泛存在,可介导多种免疫和炎症反应发生。Nadatani等[22]研究发现,胃食管反流病程中,属于癌前病变的Barrett食管形成机制中,NLRP3炎性小体的形成发挥重要作用。TLRs可激活NF-κB通路,介导相关因子聚集形成炎症小体,形成Caspase-1,上调IL-8等炎症因子,从而引起炎症效应。Abdel-Latif等[23]研究发现,幽门螺旋杆菌提取物(HPE)能诱导食管上皮细胞内NF-κB和AP-1高表达,可能间接引起贲门和食管远端的炎症。GERD的发生与NF-κB通路的激活导致炎症因子上调密切相关;王笑晴[24]研究发现,旋覆花中分离出的化合物JEUD-38可显著抑制ERK、JNK和p38磷酸化,阻断NF-κB和MAPK通路激活从而减少微生物脂多糖诱导的一氧化氮合酶表达和炎症因子分泌。而笔者在研究过程中,发现在旋覆花治疗GERD相关通路中富集靶点最多是与癌症相关的通路。GERD可引起食管上皮中细胞周期调控基因及抑癌基因(尤其是P35)的突变,从而导致细胞增殖、分化异常[25],引起食管及食管癌变。TOKGUN等[26]发现,旋覆花提取物可通过P35引起细胞凋亡,对人乳腺癌MCF-7细胞产生毒作用,从而抑制肿瘤。故笔者推测,旋覆花可能通过调控癌症相关通路,影响p35基因表达,从而影响胃食管反流发生或阻断胃食管黏膜癌变。
综上所述,本研究运用网络药理学分析预测旋覆花治疗GERD作用机制,筛选药物与疾病相互作用关键靶点,运用关键靶点分析作用机制,一定程度上减少了数据处理的工作量,且使网络可视化更加清晰简洁。本研究通过构建“活性成分-关键靶点-通路网络”,发现旋覆花治疗GERD可能通过槲皮素、山柰酚、β-谷甾醇、毛地黄黄酮等活性成分作用于 JUN、STAT3、TP53、TNF、IL6、CXCL8、EGFR 和EGF等关键靶点及调节HIF-1信号通路、MAPK 信号通路、Toll 样受体信号通路、NOD样受体信号通路及与癌症相关等信号通路发挥直接或间接的治疗作用,主要集中于促进细胞凋亡、下调炎症因子、调控血管生成、抑制细胞增殖和一氧化氮生成、阻止黏膜病变恶化等方面。

