EV71、CA16、CA10 三价 VP1 蛋白疫苗的有效性和安全性研究
牛栋赵彬彬武婧彭婉君张丽红刘江宁
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,卫健委人类疾病比较医学重点实验室,北京 100021)
手足口病(hand,foot,and mouth disease,HFMD)是由多种肠道病毒引发的常见病毒性传染病,其主要传播途径为粪口传播,多发于婴幼儿及5 岁以下儿童[1-5]。手足口病传染性强,通常是自限性的,但少数患儿可迅速发展为重症的神经系统并发症,如急性弛缓性麻痹、脑脊髓炎、无菌性脑炎、暴发性神经性肺水肿等,病死率较高[6-7]。2008 年手足口病在我国开始暴发流行,此后发病病例呈逐年上升趋势,到 2014 年至 2016 年累计已达 730 万例病例[8-11]。人类肠道病毒(human enteroviruses)是手足口病的主要病原, 属于小 RNA 病毒科(Picornaviridae)肠道病毒属(Enterovirus),为单股正链RNA 病毒,由蛋白外壳和核酸组成。人类肠道病毒EV71 (enterovirus 71) 和CA16 (coxsackievirus A16)是手足口病的主要流行病原;近年来,由CA10(coxsackievirus A10)、CA6(coxsackievirus A6)等病毒引起的手足口病病例有所增加[7-12]。其中,EV71和CA10 感染都可引起严重的神经系统疾病,如无菌性脑膜炎和病毒性脑膜炎,以及神经源性肺水肿和心肺功能障碍等,最终可能导致死亡。CA16 感染症状虽多为轻症或无症状病例,但有研究表明EV71 与CA16 混合型感染更易导致中枢神经系统并发症[13]。
目前在我国已上市了针对EV71 的灭活疫苗,然而EV71 疫苗并不能预防手足口病的其他病原,如CA16 和CA10[14-18]。因此,开发一种多价手足口病疫苗是更为有效的策略。由于肠道病毒感染可能与自身免疫性疾病有关[19-21],灭活病毒免疫有引起自身免疫性疾病的潜在风险[22];而重组蛋白疫苗可以去掉有害抗原表位,自由编辑、重组抗原蛋白,具有更好的灵活性。肠道病毒结构蛋白VP1 含有主要的抗原决定簇,在 EV71 和CA16 研究中都得到了证实。本文根据这一特性,将EV71、CA16 和 CA10 病毒的 VP1 蛋白制成三价蛋白疫苗,每隔2 周对 ICR 小鼠进行1 次免疫,并定期检测小鼠血清中特异性抗体的组成及中和活性,鉴定T 细胞的特异性免疫反应,并评估对乳鼠的免疫保护效果。结果表明:三价VP1 蛋白疫苗能够有效地诱导出病毒特异的体液免疫和细胞免疫,能够保护乳鼠抵御EV71 病毒感染,同时具有良好的安全性;从而说明该蛋白疫苗具有进一步开发的可能性。
1 材料与方法
1.1 材料
1.1.1 实验动物
110 只 6 周龄 SPF 级 ICR 小鼠,其中雌性 90只,雄性20 只,体重约为25 g,购于北京华阜康生物科技股份有限公司【SCXK(京)2019-0008】。于中国医学科学院医学实验动物研究所动物生物安全二级实验室(ABSL-2)中进行实验【SYXK(京)2019-0014】。饲养环境:室内温度22 ~ 25℃,湿度40%~70%,12 h 光照/黑暗循环。动物在笼内自由摄食饮水。本实验得到中国医学科学院医学实验动物研究所实验动物使用和管理委员会的批准(批准号:LJN20013)。本 实验 所用 的 EV71 病 毒为FY0805 毒株经小鼠传代所获得的适应株 MP10(GenBank accession number:HQ712020),CA16 病毒为 shzh05-1 毒株 ( GenBank accession number:262658), CA10 病毒毒株( GenBank accession number:MF688814.1)。EV71 VP1 蛋白、CA10 VP1蛋白经设计由北京义翘神州科技有限公司合成,蛋白浓度分别为0.57 mg/mL 和0.21 mg/mL。CA16 VP1 蛋白购自北京义翘神州科技有限公司,纯度大于85%。
1.1.2 主要试剂与仪器
弗氏完全佐剂(Sigma-Aldrich,F5881-10ML),弗氏不完全佐剂(Sigma-Aldrich,F5506-10ML),山羊抗小鼠IgG H&L(HRP)(Abcam,ab6789),山羊抗小鼠IgM mu chain(HRP)(Abcam,ab97230),单组分TMB 显色液(Solarbio,PR1200),PMA+Ionomycin淋巴细胞刺激物(达优,20304210),Mouse IFN-gamma ELISpot PLUS(ALP),strips(MabTech,3321-4AST-2), PROCARTAPLEX 11 PLEX (Invitrogen,PPX-11), TRIzolTMReagent (Ambion, 15596018)QuantiTect Probe RT-PCR Kit (Qiagen, 204443),RevertAid First Strand cDNA Synthesis Kit(Thermo ScientificTM,K1622),TB Green® Premix Ex TaqTMII(Takara,RR820A)。
多功能发光分析仪(FLUOstar Omega,德国),Mabtech IRIS ELISPOT 读板仪(Mabtech,瑞典),T100TMThermal Cycler(Bio-rad,美国),QuantStudioTM3 Real-Time PCR System,96-well,0.2 mL(Applied BiosystemsTM,美国)
1.2 方法
1.2.1 动物分组及免疫
6 周龄 ICR 母鼠随机分为 5 组,每组 16 只。三价VP1 蛋白疫苗组按照不同剂量分为3 组,CV-2.5组、CV-5 组和 CV-10 组:经腹腔免疫 EV71、CA16、CA10 三种VP1 蛋白等比混合的三价VP1 蛋白疫苗(每种 VP1 蛋白 2.5、5、10 μg)。阴性对照组:腹腔免疫生理盐水。阳性对照组:腹腔免疫 EV71、CA16、CA10 三种等比混合的阳性疫苗。各组在免疫后的14、28 d 时加强免疫,初次免疫用弗氏完全佐剂,加强免疫时用弗氏不完全佐剂。在每次免疫前采血分离血清,免疫后的35 d 无菌取脾。血清用于细胞因子、病毒特异性抗体、中和抗体效价检测,脾用于细胞免疫反应检测。每组的部分小鼠在14 d免疫后与雄鼠按2 ∶1进行合笼。
1.2.2 细胞因子检测
采用Luminex 法检测血清中细胞因子的水平。收集小鼠血液于EP 管中,分离血清,按照试剂盒说明进行 IFN-γ、TNF-α、IL-1β、IL-2、IL-4、IL-5、IL-6、IL-10、IL-12、IL-13 细胞因子的检测。
1.2.3 抗体阳性检测
采用间接ELISA 的方法进行检测,用包被液(0.05 mol/L,PH=9.6 的碳酸盐缓冲液)稀释抗原,并加入到酶标板中(每孔100 μL),4℃过夜;弃去包被液,洗涤后加入含有1% BSA 的PBST 封闭1 h;之后加入稀释好(1 ∶100/1 ∶1000)的血清 37℃孵育2 h;弃去孔内液体,洗涤后加入100 μL HRP 标记的羊抗鼠抗体,37℃孵育1.5 h;洗涤后加入100 μL TMB 显色液37℃显色5 min,加入 50 μL 2 mmol/L的H2SO4终止显色,酶标仪测定A450。根据 P/N 的值来判断抗体是否为阳性,P/N 值(阳性孔/阴性孔OD 值)大于或等于2.1 为阳性;P/N 值小于2.1,但大于1.5 为可疑;P/N 值小于1.5 为阴性。
1.2.4 中和抗体水平检测
采用体外微量中和试验进行检测。将血清放入56℃的金属浴加热30 min,灭活补体后的血清从23开始进行2 倍系列稀释,分别与100 TCID50的病毒进行等体积混合,37℃中和80 min,将孵育好的混合液加入到长有80% RD 细胞的培养板中,正常RD细胞作为空白对照组,病毒感染对照组加入100 μL的100 TCID50病毒液;将细胞培养板置于CO2培养箱中37℃培养 3 d,在显微镜下观察细胞病变(cytopathic effect,CPE),并按照 Reed-Muench 法计算中和抗体的滴度。
1.2.5 脾中特异性分泌IFN-γ 的淋巴细胞检测
第3 次免疫后7 d,每组随机抽取6 只小鼠,无菌取脾并制备细胞悬液,按照每孔3 × 105个细胞放入96 孔板中,并加入PMA + Ionomycin 淋巴细胞刺激剂、灭活的EV71 病毒、灭活的CA16 病毒、灭活的CA10 病毒刺激24 h,按照ELISpot 试剂盒说明书检测细胞分泌IFN-γ 时生成的斑点数。
1.2.6 新生乳鼠的病毒感染实验
经免疫的雌鼠产生的1 日龄ICR 小鼠30 窝,每窝8 ~10 只,分别经腹腔注射 LD50剂量的 EV71、CA16 或CA10 病毒,观察组共观察14 d,期间记录临床评分、生存率、体重;解剖组在3 ~5 d 时取小鼠血液和后肢肌肉用于病毒载量的检测。
1.2.7 RNA 的提取以及qPCR 检测病毒载量
血液与后肢肌肉采用TRIzol 法进行总RNA 的提取,经CA16 感染的小鼠样本需在提取RNA 后利用反转录试剂盒进行反转,并利用染料法qPCR 制备的标准曲线测定样本中CA16 病毒核酸的拷贝数。经EV71 或CA10 感染的组织样本利用探针法qPCR 制备的标准曲线测定其EV71 或 CA16 病毒核酸的拷贝数。
1.3 统计学分析
所有数据均使用 IBM SPSS 23 和 GraphPad Prism 8 软件处理,两组间的比较采用独立样本t检验,实验数据以平均值± 标准差(±s)表示,以P< 0.05表示差异具有显著性。
2 结果
2.1 三价VP1 蛋白疫苗能够诱导产生病毒特异性的中和抗体
本实验采用6 周龄ICR 雌鼠对三价VP1 蛋白疫苗(EV71、CA16 和 CA10 三种病毒的 VP1 蛋白混合疫苗)进行评价,蛋白疫苗按照剂量分为2.5 μg(CV-2.5)、5 μg(CV-5)和 10 μg(CV-10)3 个实验组,并以EV71、CA16 和CA10 三种灭活病毒混合形成的疫苗作为阳性对照(PC)、以生理盐水作为阴性对照(NC)。初次免疫后,分别在14、28 d 进行第2次和第 3 次加强免疫。一免后 14、28、35 d 分别检测血清中IgG、IgM 抗体水平。
三价VP1 蛋白疫苗初次免疫后,在14 ~35 d的检测期内VP1 蛋白特异的IgG 和IgM 抗体均为阳性,同时抗体能与灭活病毒进行特异性的结合(表1)。选取免疫后35 d 的血清来检测抗体的中和滴度(neutralization titer,NT)。从结果可见(图1A):三价VP1 蛋白疫苗的免疫血清对CA10 病毒的中和活性最高,3 种剂量都超过了26;对EV71 病毒中和活性次之,NT 在25~ 26之间;对CA16 病毒的中和能力较差,均不到25。与PC 组相比,蛋白疫苗免疫血清中和活性均下降约4 倍。以上结果证明,三价VP1 蛋白疫苗诱导产生的抗体具有中和活性,对EV71 和CA10 病毒的中和作用尤为明显;同时,三价VP1 蛋白疫苗的不同剂量并未使疫苗血清的中和活性发生显著性的差异。
2.2 三价VP1 蛋白疫苗能够诱导病毒特异的T 细胞反应
根据动物实验和临床数据,EV71、CA16 的灭活病毒疫苗能够有效的激活细胞免疫反应[23-24];在本研究中PC 组也得到了相似的结果,三种病毒特异的T 细胞反应都得到了有效的诱导(图1B、C)。同时,发现三价VP1 蛋白疫苗对T 细胞也具有活化作用:相对于阴性对照,接种过蛋白疫苗的小鼠有更多的脾细胞产生IFN-γ;其中EV71 VP1 蛋白的诱导作用最为突出,检测到的IFN-γ 阳性点均超过130;三种蛋白剂量中CV-5 剂量组相对于NC 组,在不同病毒刺激下其表达的IFN-γ 均具有显著性差异,说明其激活病毒特异的T 细胞反应更为稳定(图1B、C)。研究表明,重组蛋白疫苗可通过被抗原递呈细胞(巨噬细胞、DC 细胞)吞噬、加工,再递呈给T 细胞,产生特异的T 细胞反应。本实验中的中剂量三价VP1 蛋白疫苗能诱导出有效的、病毒特异的T 细胞反应,其中5 μg 的蛋白剂量表现更好;以EV71 VP1 蛋白效果最佳,CA16 VP1 蛋白次之;但是蛋白疫苗均未达到灭活病毒疫苗的诱导活性。
2.3 三价VP1 蛋白疫苗免疫未引发炎症反应
疫苗的安全性是疫苗研究的重要部分,由于在EV71 感染引起的脑干脑炎、肺水肿并发症的患者体内,炎症细胞因子水平明显升高[25-26],因此在疫苗的开发使用中有必要考虑细胞因子的变化情况。基于以上考虑,灭活EV71 疫苗的研究中增加了对免疫前后的炎性细胞因子的检测[27],结果表明接种疫苗引起的免疫应答中未产生炎症反应,从而支持了疫苗的安全性。同理,检查了三价VP1 蛋白疫苗免疫后小鼠血清中10 种炎症相关细胞因子的变化情况(图2)。蛋白疫苗组血清中大部分炎症相关细胞因子(IFN-γ、TNF-α、IL-1β、IL-4、IL-5、IL-6、IL-10、IL-12p70)的水平与同期采集的阴性对照组无显著性差异;CV-2.5 组的IL-2 在14 d 时有短暂的升高,而到35 d 时又恢复到免疫前水平;IL-13 作为抑制炎症的细胞因子,在蛋白免疫组(CV-2.5 组、CV-10组)检测到了高水平的表达。PC 组免疫后IFN-γ 和TNF-α 的水平有短暂的升高,但最终降回至阴性对照水平。此外,在免疫后的小鼠日常观察中未发现疫苗组小鼠与NC 组存在明显差异。以上数据表明,三价VP1 蛋白疫苗以及灭活病毒疫苗均不会使机体产生强烈的炎症反应,也未影响小鼠的正常生长,这些数据提示该疫苗具有良好的安全性。
表1 三价VP1 蛋白疫苗三次免疫血清中抗体持续阳性情况检测结果Table 1 Test results of continuous positive antibodies in the three immunized serums of the trivalent VP1 protein vaccine
注:A:免疫35 d 后小鼠血清的中和抗体滴度变化情况,n=3;B:免疫35 d 后小鼠脾细胞中病毒特异性T 细胞免疫反应分泌IFN-γ 结果,n=4;C:免疫 35 d 后小鼠脾细胞中病毒特异性 T 细胞免疫反应分泌 IFN-γ 结果;与 PC 组相比,*P< 0.05,∗∗P < 0.01,∗∗∗P < 0.001;与 NC 组相比,#P< 0.05,##P < 0.01,###P < 0.001。图1 三价VP1 蛋白疫苗免疫血清中中和抗体滴度变化情况及病毒特异性T 免疫细胞反应检测结果Note. A. Changes of neutralizing antibody titers in mouse serum after 35 d of immunization, n=3. B. IFN-γ secreted by virus-specific T cell immune response in mouse spleen cells after 35 d of immunization, n=4. C. The results of IFN-γ secreted by virus-specific T cell immune response in mouse spleen cells after 35 d of immunization,n=4. Compared with the PC group, *P < 0.05, ∗∗P < 0.01, ∗∗∗P < 0.001. Compared with the NC group,#P < 0.05, ##P < 0.01, ###P < 0.001.Figure 1 Changes of neutralizing antibody titers in the immune serum of the trivalent VP1 protein vaccine and the detection results of virus-specific T immune cell responses
2.4 三价VP1 蛋白疫苗对新生乳鼠的免疫保护作用
由于免疫母鼠的母源抗体可以通过乳汁转移到新生乳鼠中,从而使乳鼠具有抵抗病毒侵染的能力[28-29]。实验证实灭活病毒疫苗(PC 组)对母鼠的免疫使其后代免受病毒的感染,且对三种病毒均有效(图3)。与之相比,三价 VP1 蛋白疫苗只在EV71 病毒感染时表现出明显的保护作用:5 μg 的VP1 蛋白剂量(CV-5)的保护效果最为显著,其乳鼠的死亡率为0;临床评分在感染后3 ~10 d 之间有短期的上升,而到第11 天即恢复正常;乳鼠的体重也接近于PC 组;在抑制病毒复制方面,CV-5 组的乳鼠血液和肌肉组织中的病毒载量也显著降低。三价VP1 蛋白疫苗虽然激活了母鼠体内对CA16 和CA10 的病毒特异性体液免疫和细胞免疫,但这些免疫反应并未给乳鼠提供免疫保护作用,从生存率、临床评分到病毒载量都没有显著改善。对三种病毒的不同反应,说明三价VP1 蛋白疫苗提供的免疫保护作用存在病毒差异,这可能是不同病毒VP1蛋白免疫原特性存在差异。
图2 三价VP1 蛋白疫苗免疫血清中细胞因子变化情况(n=4)Figure 2 Changes of cytokines in the immune serum of trivalent VP1 protein vaccine(n=4)
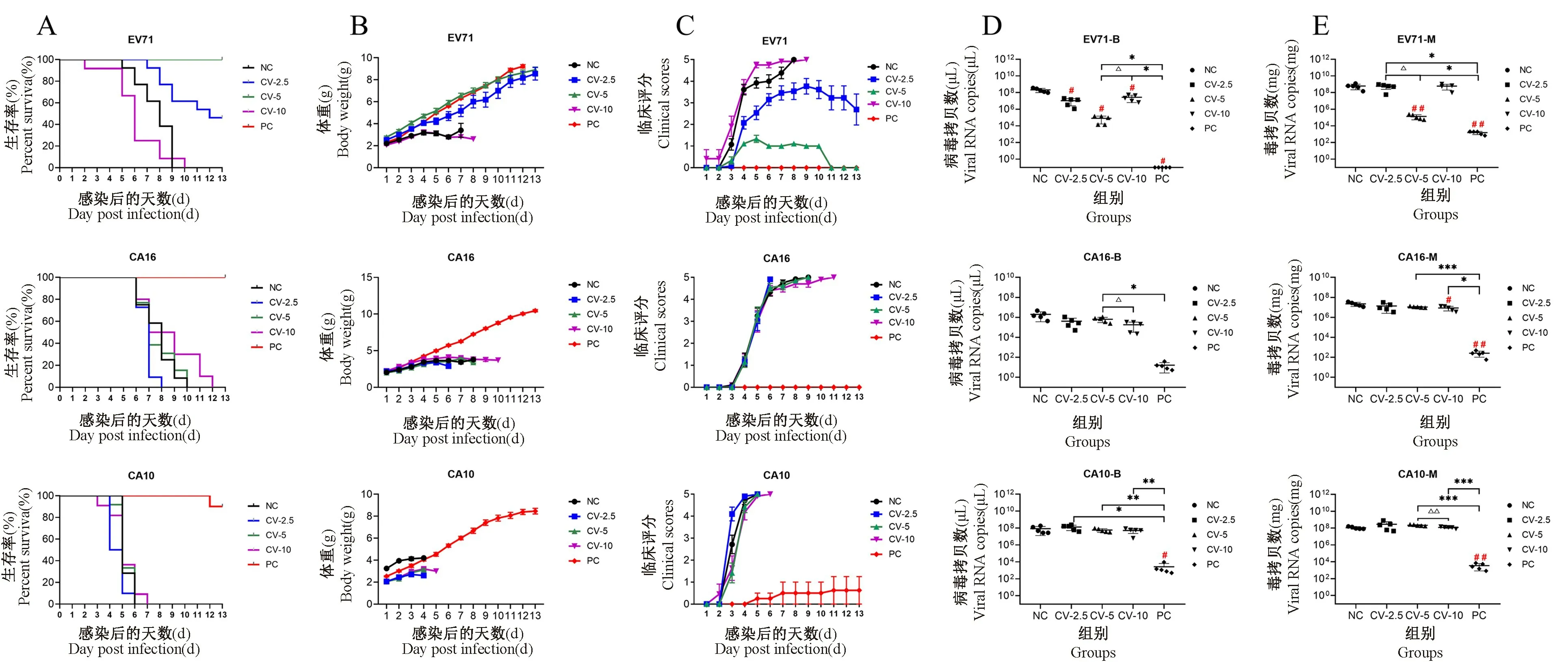
注:A:1 日龄小鼠感染LD50病毒生存率变化结果,每种病毒感染乳鼠数量n=10;B:1 日龄小鼠感染LD50病毒体重变化结果,每种病毒感染乳鼠数量n=10;C:1 日龄小鼠感染LD50病毒临床评分结果,每种病毒感染乳鼠数量n=10;D:1 日龄小鼠感染LD50病毒濒临死亡时血液病毒载量结果,每种病毒感染乳鼠数量n=5;E:1 日龄小鼠感染LD50病毒濒临死亡时肌肉病毒载量结果,每种病毒感染乳鼠数量 n=5;与 CV-5 组相比,△P< 0.05,△△P < 0.01;与 PC 组相比,*P< 0.05,∗∗P < 0.01,∗∗∗P < 0.001;与 NC 组相比,#P< 0.05,##P< 0.01。图3 三P 价VP1 蛋白疫苗对新生乳鼠的免疫保护作用Note. A. Results of the survival rate of 1-day-old mice infected with LD50 virus, the number of neonatal mice infected by each virus was n=10.B. Results of the body weight changes of 1 d mice infected with LD50 virus, the number of neonatal mice infected by each virus was n=10. C.Results of clinical scoring of 1 d mice infected with LD50, the number of neonatal mice infected by each virus was n=10. D. Results of blood viral load when 1 d old mice were infected with LD50 virus and were dying, the number of neonatal mice infected by each virus was n=5. E.Results of muscle viral load when 1 d old mice were infected with LD50virus and were dying, the number of neonatal mice infected by each virus was n=5. Compared with the CV-5 group, △P < 0.05, △△P < 0.01. Compared with the PC group, *P < 0.05, ∗∗P < 0.01, ∗∗∗P <0.001. Compared with the NC group, #P <0.05, ##P <0.01.Figure 3 Immunoprotective effect of trivalent VP1 protein vaccine on neonatal mice
3 讨论
预防性疫苗一直是防止传染性疾病流行的重要手段,手足口病疫苗的研发也一向是我国疫苗研究的重要方向。目前,我国已上市了三种针对EV71病毒C4 亚型的灭活疫苗,分别由中国医学科学院医学生物研究所、北京科兴生物制品有限公司和武汉生物制品研究所研发和生产,临床数据也证实了这些疫苗的有效性和安全性[14-18]。但是EV71 疫苗只针对EV71 感染有中和活性,对其他肠道病毒并无显著的交叉反应,而作为多病原的手足口病还需要多价疫苗来实现更广泛的保护作用。因此,近些年对于二价、三价、四价的手足口疫苗的研究越来越多,涉及的病毒包括流行最为广泛且具有高重症率的 EV71、CA16、CA10 和 CA6 病毒;疫苗类型常采用灭活病毒疫苗、 重组病毒样颗粒(virus-like particle,VLP)疫苗、多肽疫苗等[19-20,23-24,28-29]。根据文献报道并结合前期工作,发现肠道病毒的VP1蛋白含有病毒重要的抗原决定簇[21-22,30-31],因此合成了 EV71、CA16 和 CA10 病毒的 VP1 蛋白作为疫苗的候选蛋白,按照低剂量(2.5 μg,CV-2.5)、中剂量(5 μg,CV-5)和高剂量(10 μg,CV-10)对 ICR 小鼠进行3 次免疫,并以灭活病毒疫苗作为阳性对照(PC)、以生理盐水作为阴性对照(NC)。
从疫苗免疫后血清的抗体检测结果看来,三价VP1 蛋白疫苗能够持续性的诱导机体产生VP1 蛋白特异的IgG、IgM 抗体和病毒特异的IgG、IgM 抗体,并且这些抗体对病毒具有中和活性,其中对EV71 和CA10 病毒的中和能力较强;不过蛋白疫苗抗体的中和活性仍弱于灭活病毒疫苗,两者中和抗体滴度相差约4 倍。除了诱导病毒特异性体液免疫反应,三价VP1 蛋白疫苗也能激活病毒特异的T 细胞反应,其中对EV71 病毒的反应最为明显。通过检测免疫小鼠脾细胞中病毒特异的IFN-γ 分泌T 细胞,我们发现CV-5 蛋白疫苗组具有有效、稳定的T细胞免疫反应,对三种病毒的刺激都能产生显著反应。从这些体外实验的结果可见,三价VP1 蛋白疫苗既能诱导机体产生病毒特异的抗体,又能活化病毒特异的T 细胞反应,其中中剂量的VP1 蛋白效果最佳。
除了疫苗的有效性,安全性也是疫苗关注的另一个重要方面。在临床上,手足口患儿、尤其是重症病人血液和脑脊液中能检测到高水平的促炎细胞因子,例如 IFN-γ、IL-6 和 TNF-α;因此经常将促炎因子与病程重症性联系在一起[25-26]。通过检测10 种主要的、与炎症反应相关的细胞因子在免疫血清中的水平,发现除了IL-2 和IL-13 其他细胞因子(IFN-γ、 TNF-α、 IL-1β、 IL-4、 IL-5、 IL-6、 IL-10、 IL-12p70)在蛋白疫苗免疫后并未发生显著变化。而IL-2 只有短暂的上升,35 d 时已恢复到免疫前的水平;IL-13 是唯一在35 d 时表达水平仍处于高位的细胞因子,其作用常与IL-4 联系在一起,具有抑制炎性反应的作用[32]。另外,在小鼠免疫后的日常观察中也未发现蛋白疫苗组小鼠的异常,这些结果提示三价VP1 蛋白疫苗具有良好的安全性。
与已上市的三家EV71 灭活疫苗相比[33],在动物实验中三价VP1 蛋白疫苗对EV71 保护有效性方面略低于灭活疫苗,但在中和抗体滴度方面三价VP1 蛋白疫苗表现出了对CA16、CA10 的保护作用,体现出了三价VP1 蛋白疫苗的优势。
对于三价VP1 蛋白疫苗的体内功能,本文利用了乳鼠感染模型。免疫后母鼠的母源抗体通过乳汁转移到新生乳鼠中,观察乳鼠对病毒感染的抵抗能力可以判断蛋白抗体的免疫保护作用[28-29],灭活疫苗的这种被动免疫保护作用非常显著。根据存活率、临床评分、乳鼠体重、以及血液和肌肉组织中病毒载量的数据,发现三价VP1 蛋白疫苗对乳鼠的被动免疫保护作用只针对EV71 感染有效,VP1 蛋白免疫剂量为5 μg 时不仅能使乳鼠全部存活,而且能够有效抑制EV71 病毒的复制。但是,VP1 蛋白疫苗对CA16 和CA10 并未表现出足够的免疫活性,未能使乳鼠对这两种病毒的感染产生抵抗能力。综上所述,三价VP1 蛋白疫苗能够诱导产生病毒特异的中和性IgG、IgM 抗体,同时能激活病毒特异的T 细胞免疫反应;中剂量的VP1 蛋白可达到稳定的免疫效果;此外,蛋白疫苗免疫并未造成炎性细胞因子的剧烈变化,其安全性也得到了证实;从而表明三价VP1 蛋白疫苗对开发手足口多价疫苗具有一定的启示性。但是,蛋白疫苗的免疫活性仍低于灭活病毒疫苗,尤其对乳鼠的免疫保护作用只发生在EV71 感染时,对其它两种病毒保护作用较低。这些缺陷说明:对于 CA16 和 CA10 病毒,简单的VP1 蛋白并不能提供有效的免疫原性,有必要结合其他免疫决定簇,以形成更为完善的蛋白疫苗。

