2 型糖尿病气阴两虚病证结合动物模型的制备及评价指标的建立
张译心王鑫刘博纪凤兰温富春丁涛徐惠波∗
(1. 吉林省中医药科学院,长春 130012; 2. 长春中医药大学,长春 130117)
糖尿病(diabetes mellitus,DM)是一种以糖脂代谢紊乱为特征的慢性代谢病,属于中医“消渴”范畴,临床上可将2 型糖尿病分为气阴两虚证、阴阳两虚证、血瘀气滞证和阴虚热盛证4 个证型[1-2]。为了在基础研究中实现对糖尿病的不同证型进行对证治疗,以更好地了解并诠释中药治疗的机制,采用“拟临床研究”的原则制备病证结合动物模型不失为一种较好的研究方法之一。病证结合动物模型的建立,一方面可为临床治疗提供可靠有效的实验依据,从而进一步了解临床疾病的发生发展规律;另一方面,它既能反映中医证候特点,又能体现疾病的病理变化,与单一疾病模型比较,在研究中药作用时能更充分地突显传统医学对疾病治疗的优势[3-4]。本文通过高糖高脂喂养结合腹腔注射链脲佐菌素(steptozocin,STZ)制备2 型糖尿病气阴两虚证大鼠模型,通过采集大鼠体征变化和实验室指标,对气阴两虚证大鼠模型进行评价,为2 型糖尿病气阴两虚证模型的评价标准的建立提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
48 只健康 6 周龄雄性 SPF 级 SD 大鼠,体重(160 ± 10)g,购自辽宁长生生物技术股份有限公司【SCXK(辽)-2020-0001】,饲养于吉林省中医药科学研究院屏蔽环境动物室【SYXK(吉)2020-0009】,室温18 ~25℃,相对湿度50% ~60%,每天12 h光照,12 h 黑暗循环,大鼠适应性饲养1 周,用于实验。本实验经过吉林省中医药科学院动物伦理委员会批准实施(伦理审批号:JLSZKYDWLL2019-001)。
1.1.2 饲料
高糖高脂KK 饲料购自北京华阜康生物科技股份有限公司,维持饲料购自辽宁长生生物技术股份有限公司。
1.1.3 主要试剂与仪器
链脲佐菌素(Sigma 公司,WXBC7268 V),柠檬酸(北京化工厂,20150925),柠檬酸钠(北京化工厂,20180103),肝素钠(北京鼎国昌盛生物技术有限责任公司,151809086A),甲醛(天津市北联精细化学品开发有限公司,20170305)葡萄糖试剂盒(中生北控生物科技股份有限公司,193691),cAMP、cGMP 试剂盒(美国 RD 公司,201912),CD4、CD8 试剂盒(美国RD 公司,202006)。
BGM506 型血糖仪(深圳市家康科技有限公司,中国),HS11 型数码相机(富士公司,日本),PowerLab/8S 型多导生物记录仪(AD Instruments,日本),ELx800 型酶标仪(BioTek Instruments Inc,美国),GF-D800 型半自动生化分析仪(山东高密彩虹分析仪器有限公司,中国),CS-600B 型全自动生化分析仪(长春迪瑞实业有限公司,中国),YLS-13 A型大鼠抓力测定仪(山东省医学科学院济南益延科技发展有限公司,中国),DT5-3 型低速台式自动平衡离心机(北京时代北利离心机有限公司,中国),Leica RM2255 型石蜡切片机(Leica,德国),Leica EG1140 型石蜡包埋机(Leica,德国),OlympusBX51型光学显微镜(Olympus,日本),NIS-ELEMNT BR 型图像分析系统(NIKON,日本)。
1.2 方法
1.2.1 动物分组、造模
SD 大鼠 48 只随机分为空白组(A 组 12 只)、病证模型组(B 组20 只)和高糖高脂组(C 组16 只),A 组喂饲普通饲料,其余两组喂饲高脂饲料。饲养4 周后,B 组大鼠禁食12 h 以40 mg/kg 剂量腹腔注射STZ(在4℃冰浴中,以0.1 mol/L 浓度 pH=4.4柠檬酸-柠檬酸钠缓冲液新鲜配制),A 组和C 组腹腔注射同体积柠檬酸-柠檬酸钠缓冲液。注射1 周后测定B 组大鼠空腹血糖,空腹血糖值大于11.1 mmol/L 即视为糖尿病造模成功,继续饲养至14 周试验结束。
1.2.2 模型评估标准
《中药新药临床研究指导原则》中2 型糖尿病气阴两虚证候表现如下:咽干口燥、倦怠乏力、多食易饥、口渴喜饮、气短懒言、舌红少津液、脉细数无力[5]。以气阴两虚证候的临床表现为依据,设计“大鼠体征采集表”,采集相关指标作为模型评价标准(见表1,2)。
1.2.3 大鼠一般状态
每周观察大鼠体征变化,对照评分表记录每只大鼠的运动、精神状态的分值,分值越高,运动、精神状态越差,表明大鼠体征越符合气阴两虚证候表现。
1.2.4 体重、进食量、饮水量测定
每周称量大鼠体重,记录大鼠24 h 进食量和饮水量1 次,进食量=(每笼饲料添加量-24 h 后饲料剩余量)/每笼动物只数,饮水量=(每笼饮水添加量-24 h 后饮水剩余量)/每笼动物只数。
1.2.5 抓力测定
每4 周测定1 次:先用右手将大鼠按放在抓力板上,左手向前推抓力板,然后右手滑至鼠尾部,左手松开抓力板,待大鼠用力抓住抓力板时,及时加力后拉,以得到最大抓力,各组每只大鼠连续测量3次,取平均值。
1.2.6 呼吸、脉搏测定
于实验第14 周测定大鼠呼吸、脉搏:大鼠麻醉状态下背部朝上放在置于桌面上(自然俯卧状态),将呼吸传感器的压力带自然平铺在于大鼠背腹部上;将脉搏传感器对准大鼠尾根处的静脉血管,缠绕压力带时注意力度适中,连接多导生理记录仪,使用Lab Chart7 软件记录各组大鼠的呼吸频率及脉搏幅度。
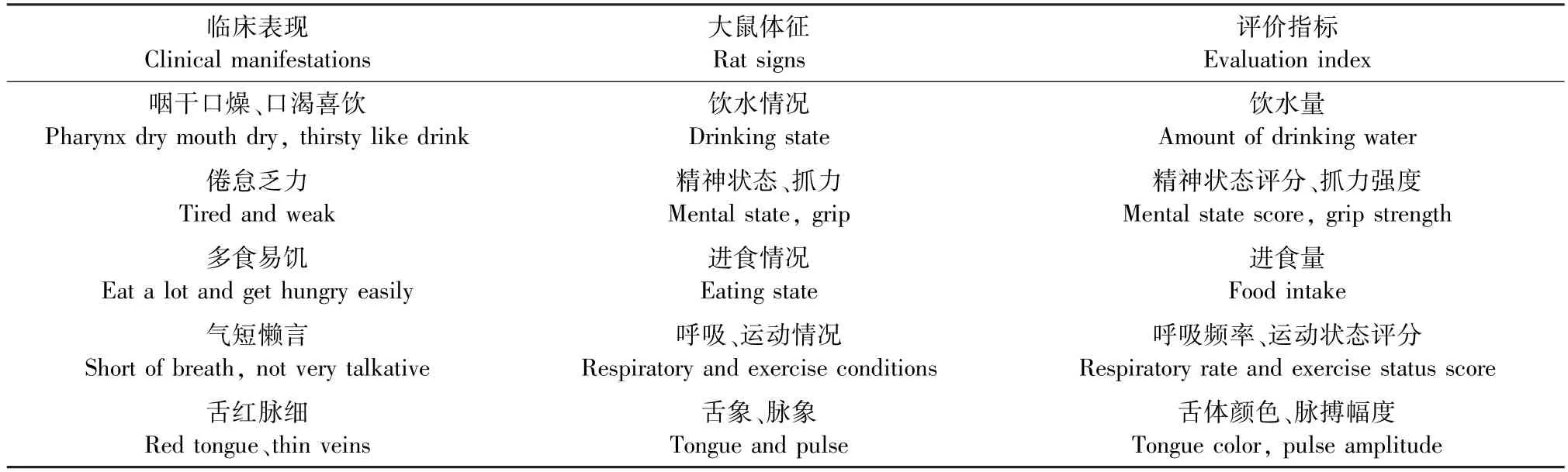
表1 大鼠体征采集表Table 1 Evaluation criteria for collecting rat signs
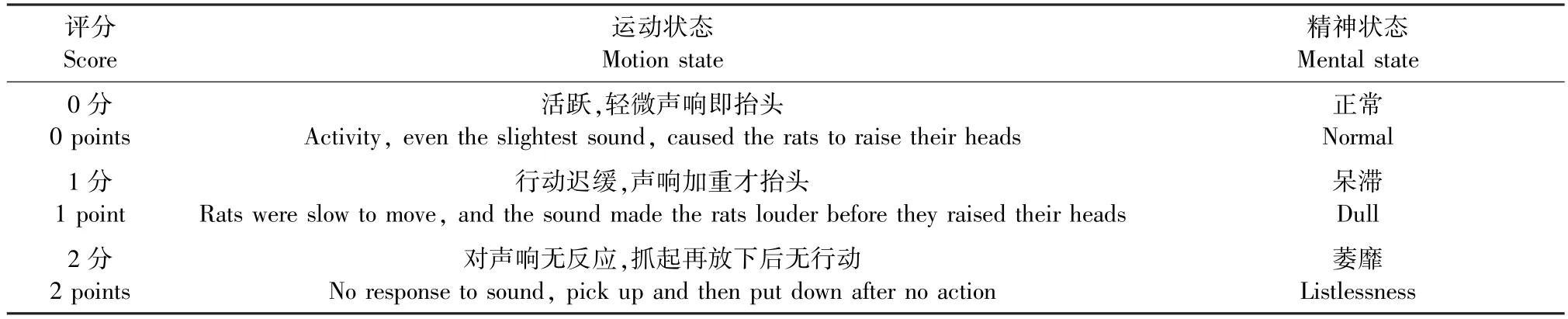
表2 运动、精神状态评分表Table 2 A rating scale for state of motion and state of mind
1.2.7 舌象分析
于实验第14 周采集大鼠舌象信息:大鼠麻醉状态下,轻背位固定,皮筋牵拉大鼠口腔,使舌体自动暴露,数码相机关闭闪光灯,近景拍摄模式下,将大鼠舌面与标准色卡对照拍摄。分析采用Photoshop 7.0 软件,设定色阶:黑色:L:22,a:0,b:0;灰色:L:58,a:0,b:0;白色:L:93,a:0,b:0。使用套圈工具,选定舌面(从舌尖到舌面中部),利用Photoshop 7.0软件中“直方图”工具,计算该区域的红色值(R值)、绿色值(G 值)、蓝色值(B 值)。R、G、B 值均为0 时为纯黑色,均为255 时为纯白色,提示舌象R、G、B 值减小,表明舌体颜色越暗,越接近纯黑色,血瘀证时舌体颜色呈暗紫色[6]。
1.2.8 血糖测定
从第4 周开始,每隔1 周测定1 次大鼠的随机血糖、空腹血糖(禁食12 h),尾静脉采血,采用血糖仪测定血糖值。
1.2.9 尿糖检测
于实验第 8、12、14 周,每组随机选取 10 只大鼠,收集尿液,进行尿糖检测。
1.2.10 糖耐量测定
实验第14 周最后1 d,每组随机选取8 只大鼠禁食12 h,灌胃葡萄糖溶液(2 g/kg),尾静脉取血,测定大鼠服糖后0、30、60、120 min 的血糖值,绘制糖耐量曲线。采用近似梯形法计算口服糖耐量试验过程中血糖曲线下面积(area under curve,AUC)。
1.2.11 凝血功能检测
实验结束,大鼠腹腔麻醉,每组随机选取8 只大鼠,腹主动脉取血0.5 mL,3.8%柠檬酸钠抗凝,全自动生化分析仪进行活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)检测。
1.2.12 血清 TC、TG、LDL-C 指标检测
每组随机选取8 只大鼠,腹主动脉取血,全自动生化分析仪分析胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)。
1.2.13 血清 cAMP、cGMP 含量测定及 cAMP/cGMP 计算
每组随机选取8 只大鼠,腹主动脉取血,分离血清,-80℃保存备用。用酶联免疫吸附测定法(ELISA)检测血清中环腺苷酸(cAMP)、环鸟甘酸(cGMP)的含量,并计算cAMP/cGMP 值。
1.2.14 血清CD4、CD8 含量测定及CD4/CD8 计算
每组随机选取8 只大鼠,腹主动脉取血,分离血清,-80℃保存备用。用酶联免疫吸附测定法(ELISA)检测血清中环腺苷酸(cAMP)、环鸟甘酸(cGMP)的含量,并计算cAMP/cGMP 值。
1.2.15 胸腺指数测定
每组随机选取8 只大鼠,称量大鼠麻醉前体重,腹主动脉取血,称取胸腺重量,计算胸腺指数,胸腺指数=胸腺重量/体重×100%。
1.2.16 胰腺组织HE 染色观察
每组随机选取8 只大鼠,摘取胰腺,将其固定于10%福尔马林溶液中,HE 染色,做光镜下胰腺组织形态学观察。
1.3 统计学分析
运用SPSS 22.0 软件统计,数据以平均值 ± 标准差(±s)表示,统计学处理方法采用SPSS 22.0 One-way ANOVA 最小显著性差异法(LSD)作两两比较,以P< 0.05 表示差异具有统计学意义。
2 结果
2.1 大鼠一般状态的观察
结果显示,第0 ~14 周时A 组大鼠精神状态良好、活跃好动、反应灵敏迅速;与A 组比较,第8 ~14 周 B 组大鼠精神、运动评分均显著升高(P<0.01),从第8 周开始精神、运动评分均逐渐升高,说明B 组大鼠精神状态逐渐由正常转为呆滞,行动逐渐变得迟缓,14 周时大鼠对外界刺激无反应或反应迟钝;C 组大鼠精神、运动评分与A 组比较始终无显著性差异,表明大鼠精神状态良好,行动活跃(图1)。
2.2 大鼠不同时间体重、进食量、饮水量测定结果
结果显示,与A 组比较,B 组大鼠体重从第4 周开始显著降低(P< 0.05 或P< 0.01),进食量和饮水量均从第8 周开始显著增加(P< 0.05 或P< 0.01);C组大鼠体重在第14 周时显著增加,进食量在第12 周时显著降低,饮水量在第4、12 周时显著降低,均具有显著性差异(P< 0.05 或P< 0.01)(图2)。
2.3 大鼠不同时间抓力测定结果
结果显示,B 组大鼠第 0 周、4 周、8 周的抓力值与A 组比较无显著性差异,从第8 周开始抓力呈降低趋势,第12、14 周时大鼠抓力显著低于A 组(P<0.01);C 组大鼠第 0、4、14 周的抓力与 A 组比较无显著性差异,第8、12 周的抓力显著低于与A 组(P<0.01)(图3)。
2.4 大鼠呼吸频率和脉搏幅度测定结果
结果显示,从第0 周开始至第14 周,B 组大鼠呼吸频率逐渐减弱,第14 周时呼吸频率显著低于A 组(P< 0.01);与A 组比较,B 组大鼠脉搏幅度在第8周、14 周时显著降低(P< 0.01)。C 组大鼠第0 ~ 12周时呼吸频率逐渐降低,第14 周时升高,与A 组比较始终无显著性差异;第4 周时大鼠脉搏幅度降低,第8~14 周保持不变,与A 组比较,第14 周时C 组大鼠脉搏幅度显著高于A 组(P< 0.05)(图4)。
2.5 大鼠舌象分析结果
结果显示,与A 组比较,B 组大鼠舌象的R、G、B值均显著降低(P< 0.05 或P< 0.01);C 组大鼠舌象的 R 值显著低于 A 组(P< 0.05),G、B 值与 A 组比较无显著性差异(图5)。
2.6 大鼠血糖测定结果
结果显示,第4 周时(STZ 注射前),B 组大鼠的随机血糖、空腹血糖与A 组比均无显著性差异;第6~14 周,B 组大鼠的随机血糖、空腹血糖均显著高于A 组(P< 0.01)。与 A 组比,第 6 ~ 12 周时,C 组大鼠随机血糖显著升高(P< 0.05 或P< 0.01);第10 周时空腹血糖显著升高(P< 0.05),其余时间与A 组大鼠空腹血糖比较均无显著性差异(图6)。
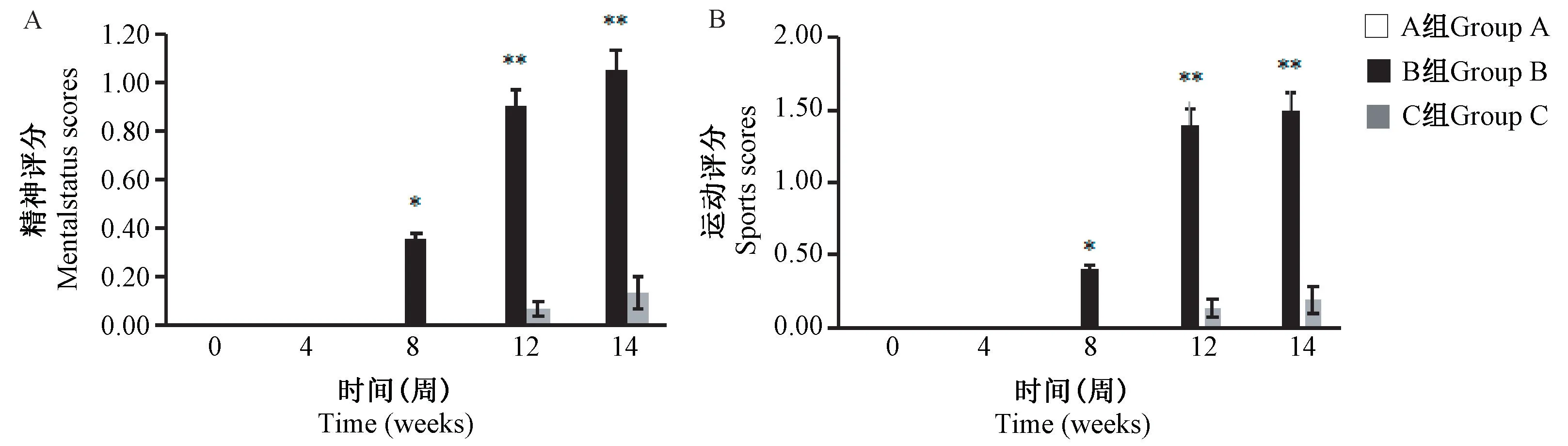
注:与 A 组比较,*P< 0.05,∗∗P< 0.01。(下图同)图1 大鼠一般状态评分观察Note. Compared with group A, *P< 0.05, ∗∗P< 0.01. (The same in the following figures)Figure 1 Observation of general status score of rats
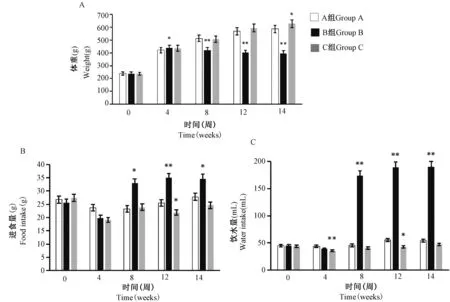
图2 大鼠不同时间体重、进食量和饮水量测定结果Figure 2 Measurement results of weight, food intake and water intake of rats at different times
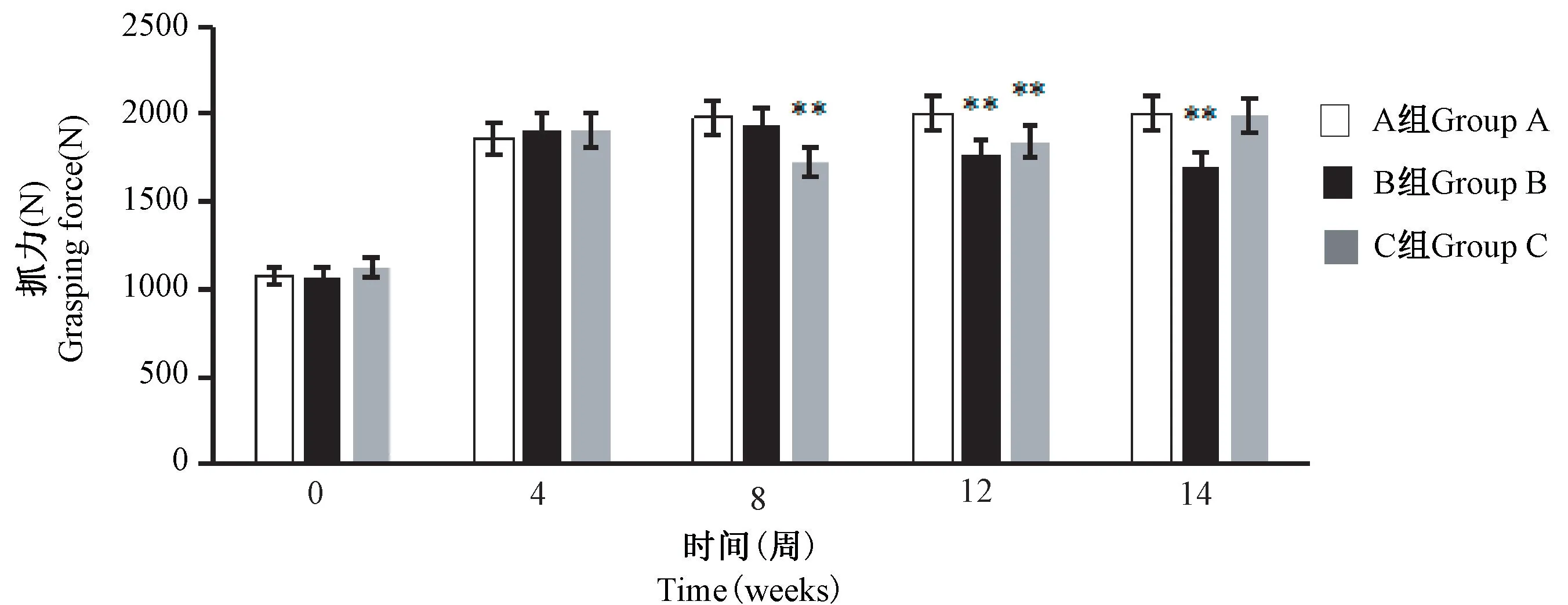
图3 大鼠不同时间抓力测定结果Figure 3 Grasping force measurement results of rats at different times
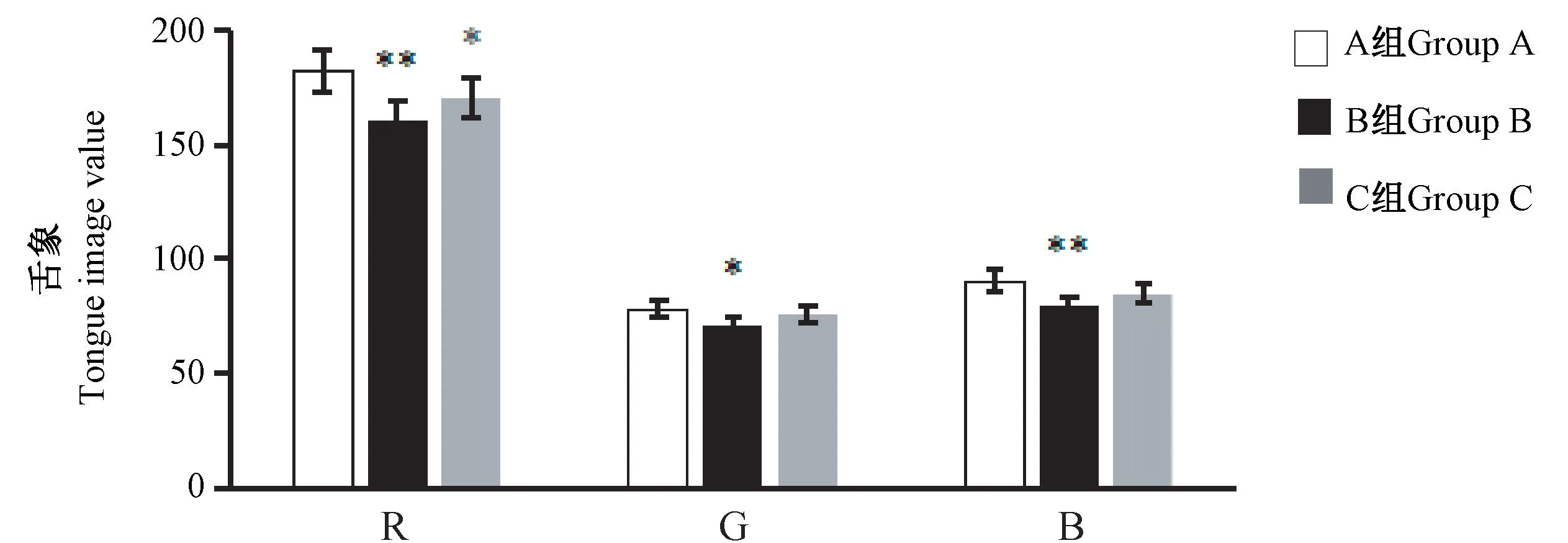
图5 大鼠舌象分析结果Figure 5 Analysis results of tongue image of rats
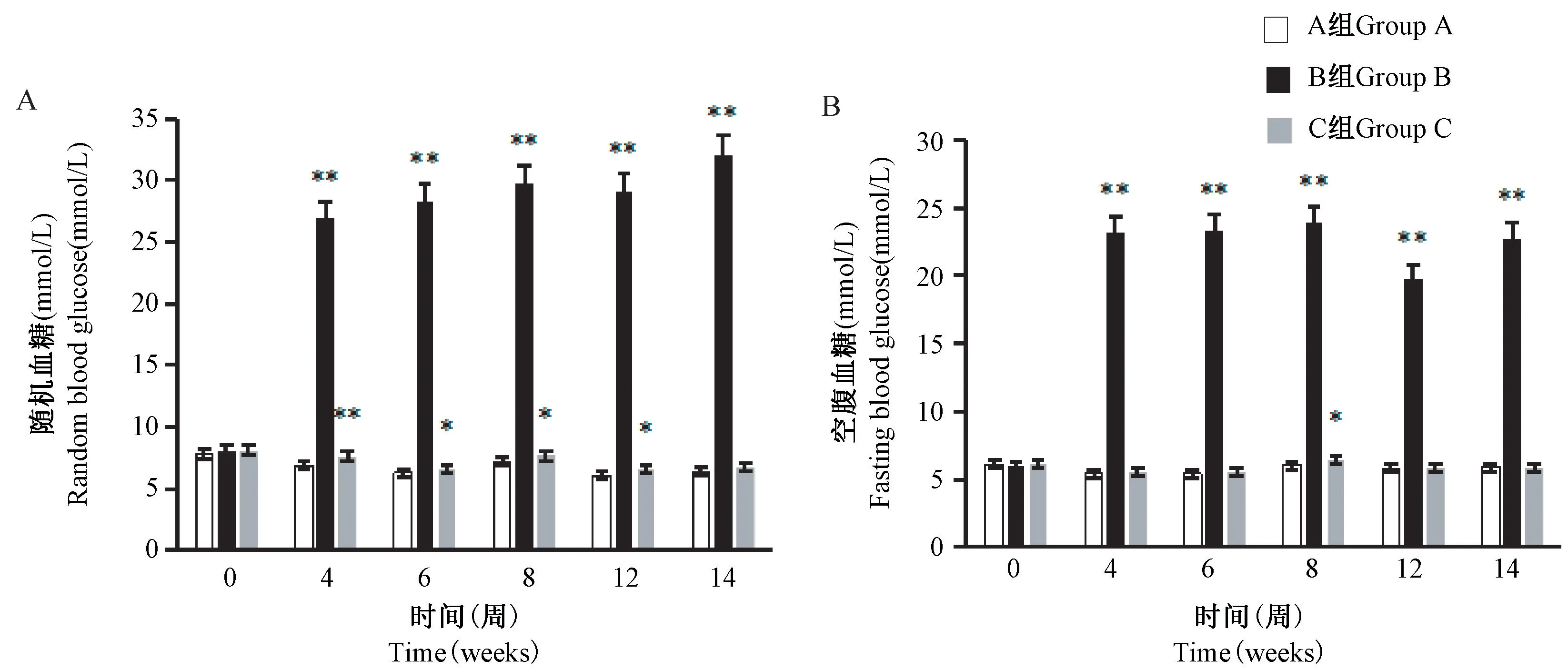
图6 大鼠血糖测定结果Figure 6 Measurement results of blood glucose in rats
2.7 大鼠尿糖检测结果
结果显示,与A 组比较,B 组大鼠3 次尿糖检测结果均显著升高(P<0.01);C 组大鼠3 次尿糖检测结果与A 组比较均无显著性差异(图7)。
2.8 大鼠糖耐量测定结果
结果显示,与A 组比较,B 组大鼠灌胃葡萄糖后各时间点血糖值均显著升高(P< 0.01),B 组AUC 显著高于 A 组(P< 0.01);C 组大鼠灌胃后120 min 血糖值显著高于A 组(P< 0.01),其余时间点的血糖值及AUC 与A 组比较均无显著性差异(图8)。
2.9 大鼠凝血功能指标测定结果
结果显示,与 A 组比较,B 组大鼠 PT、APTT 均显著减少(P< 0.05 或P< 0.01),C 组大鼠 PT、APTT 均无显著性差异(图9)。
2.10 大鼠血清TC、TG、LDL-C 指标测定结果
结果显示,与A 组比较,B 组大鼠血清TC、TG、LDL-C 含量均显著升高(P< 0.01);C 组大鼠TG 含量显著升高(P< 0.01),TC、LDL-C 含量无显著性差异(图10)。
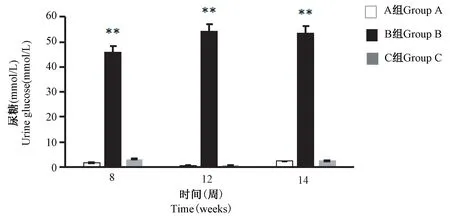
图7 大鼠尿糖检测结果(n=8)Figure 7 Urine glucose detection results of rats(n=8)
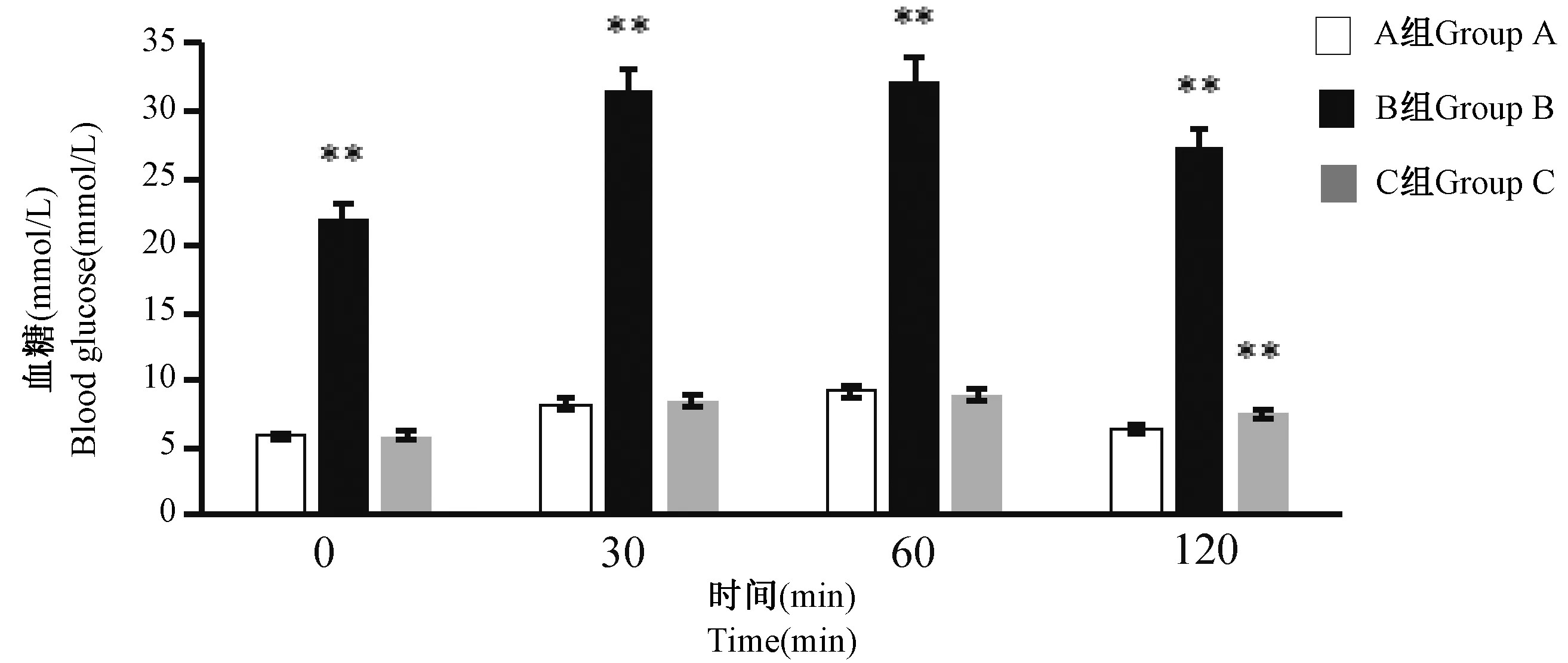
图8 大鼠糖耐量测定结果(n=8)Figure 8 Measurement results of glucose tolerance in rats(n=8)

图9 大鼠凝血功能指标测定结果(n=8)Figure 9 Measurement results of coagulation function indexes in rats(n=8)
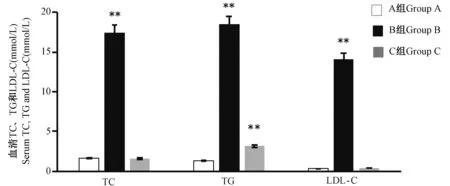
图10 血清TC、TG 和LDL-C 指标测定结果(n=8)Figure 10 Measurement results of serum TC, TG and LDL-C indexes(n=8)
2.11 大鼠血清 cAMP、cGMP 含量及 cAMP/cGMP 测定结果
结果显示,与A 组比较,B 组大鼠血清中cAMP含量和cAMP/cGMP 比值均显著升高(P< 0.05 或P< 0.01);C 组大鼠血清中cGMP 含量显著低于A组,cAMP/cGMP 比值显著高于A 组,均有显著性差异(P< 0.01)(图11)。
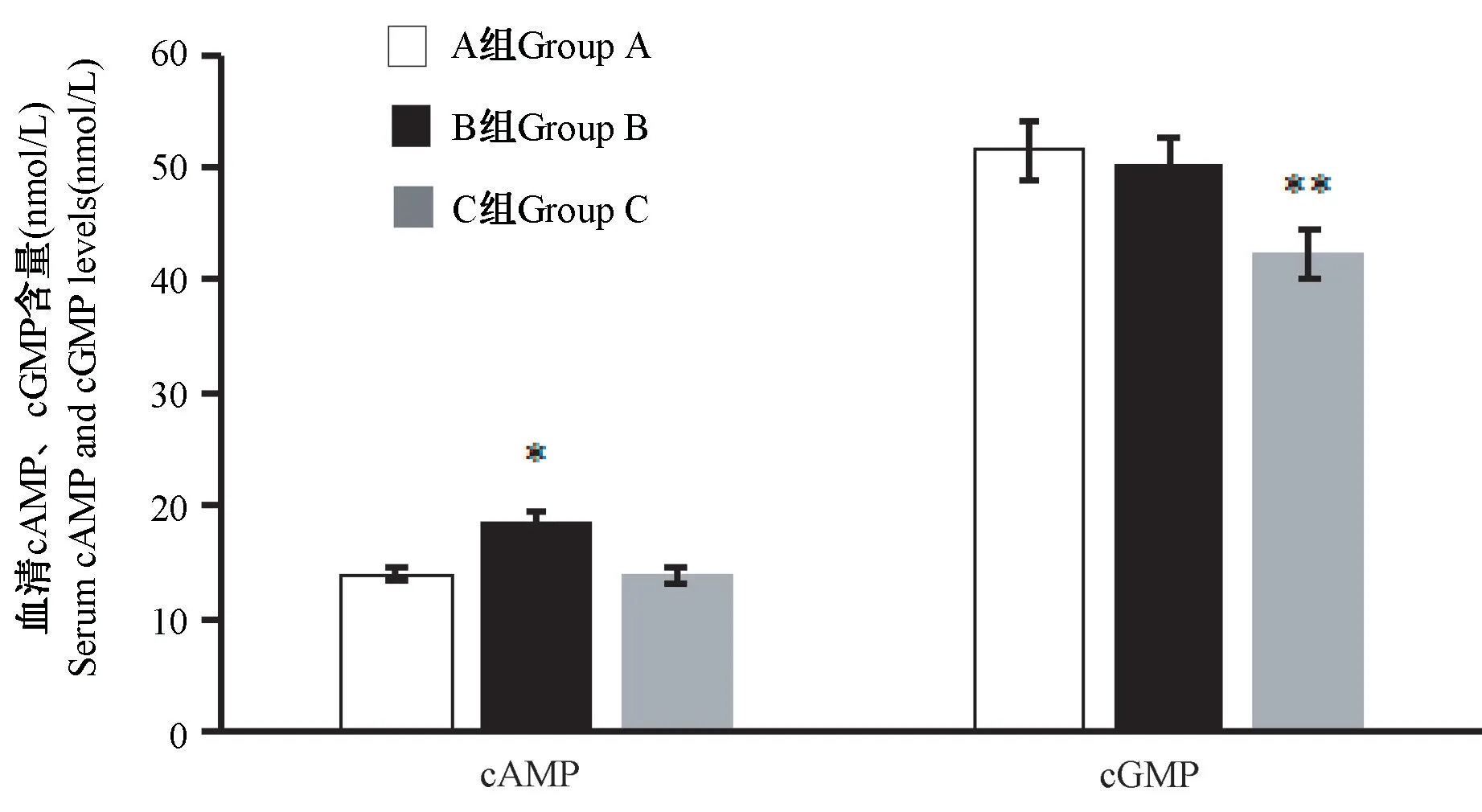
图11 血清cAMP、cGMP 含量测定结果(n=8)Figure 11 Determination of cAMP and cGMP in serum(n=8)
2.12 大鼠血清 CD4、CD8 含量及 CD4/CD8 测定结果
结果显示,与A 组比较,B 组大鼠血清中CD4含量和CD4/CD8 比值均显著降低(P< 0.05 或P<0.01);C 组大鼠血清中 CD4 含量显著降低(P<0.05)(图12)。
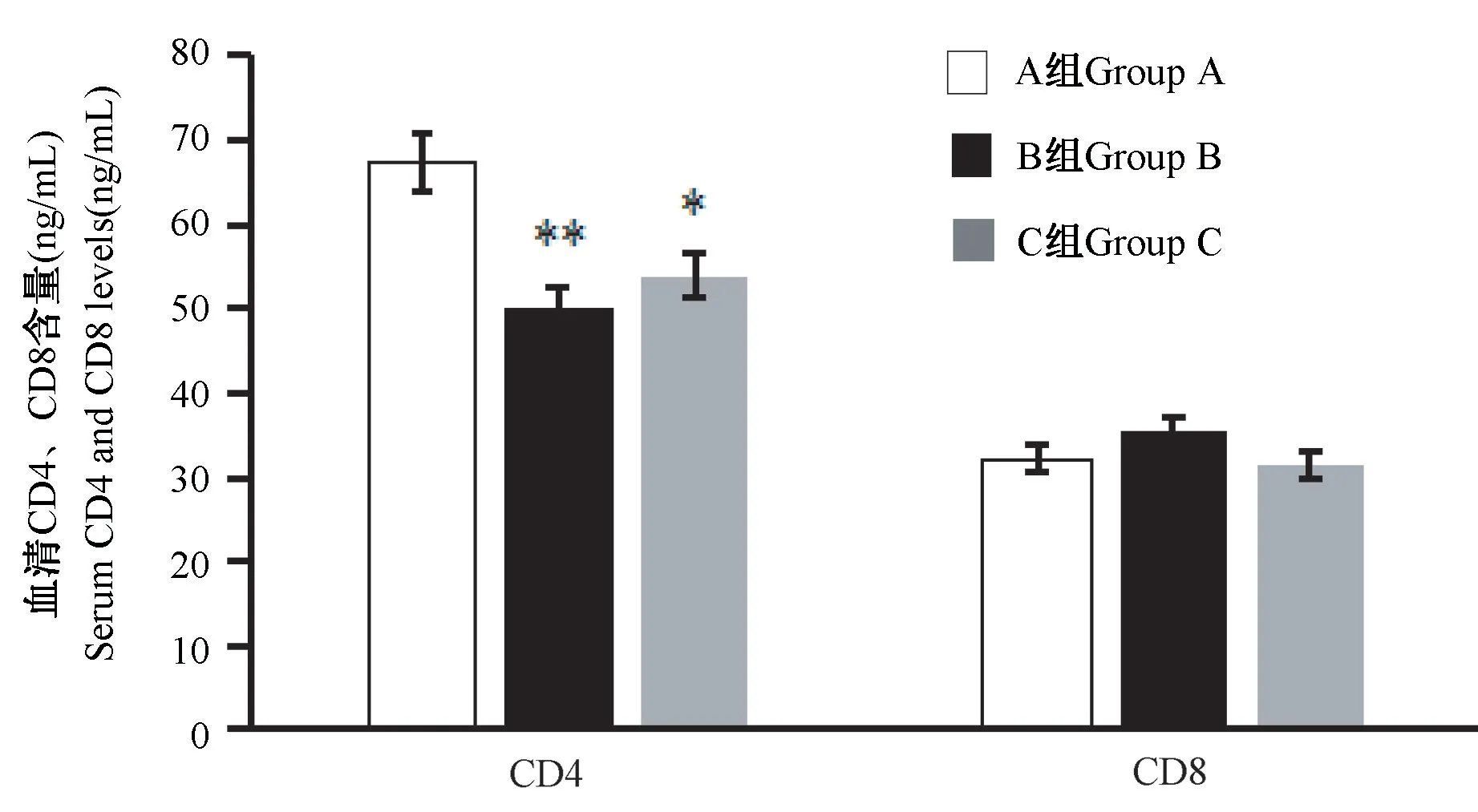
图12 大鼠血清CD4、CD8 含量测定结果(n=8)Figure 12 Determination of CD4 and CD8 in serum of rats(n=8)
2.13 大鼠胸腺指数测定结果
结果显示,与A 组比较,B 组大鼠胸腺指数显著降低(P< 0.01),C 组大鼠胸腺指数无显著性差异(图13)。
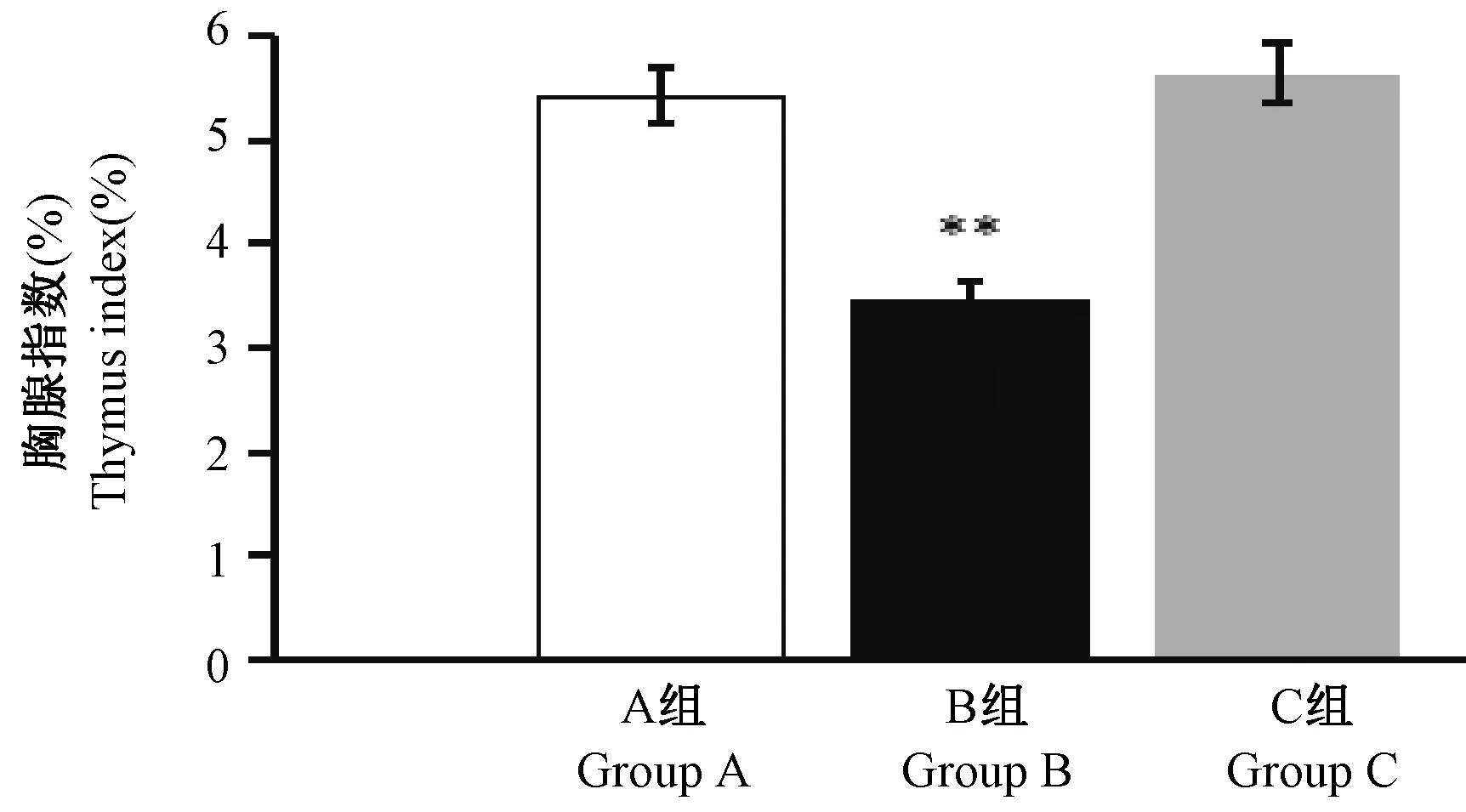
图13 大鼠胸腺指数测定结果(n=8)Figure 13 Measurement results of thymus index in rats(n=8)
2.14 大鼠胰腺组织HE 染色结果
结果显示,A 组大鼠的胰腺组织内可见体积较大的胰岛组织,形态圆,分布数量较多,间质疏松;细胞胞浆充盈正常,未见细胞空泡变性,未见细胞固缩现象。
与A 组比较,B 组大鼠胰腺组织内极少见到胰岛组织分布,胰岛数量显著减少;残存胰岛组织体积较小,其内细胞数量显著减少,细胞胞浆含量显著减少,可见细胞固缩现象,表明STZ 导致动物胰腺内胰岛组织损伤,胰岛形态明显改变,功能明显下降。
与A 组比较,C 组大鼠胰腺组织内胰岛数量显著增多,体积较大,形态圆,细胞胞浆丰富,胞浆量增多;少数胰岛细胞出现空泡变性,提示动物需要增强胰岛功能,增加胰岛细胞分泌量,以满足机体对胰岛所产内分泌激素的需求(图14)。
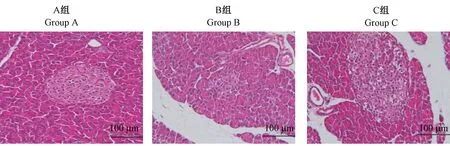
图14 大鼠胰腺组织病理结果Figure 14 Histopathological results of pancreas in rats
3 讨论
辨证施治是传统医学治病的精髓,如何在基础研究中突出中药的治疗特点一直是中药药效研究亟待解决的问题,病证结合动物模型及其评价方法的建立可以较好地解决这一问题。本文通过高糖高脂饲养结合腹腔注射链脲佐菌素制备2 型糖尿病大鼠模型,根据《中药新药临床研究指导原则》中2型糖尿病气阴两虚证候的临床表现,我们尝试设计了相应的动物体征采集表,对动物在糖尿病发展过程中的症状、体征表现尽量做到定量客观化描述,以此建立一个可操作的2 型糖尿病气阴两虚病证结合动物模型及其评价标准。
中医临床通过“望闻问切”的方法对病证进行判断,本实验以模拟中医临床表现为原则,尝试将四诊法转换为大鼠体征的采集方法,并着重于望诊信息的采集。气阴两虚是糖尿病的核心病机,贯穿糖尿病病程发展的始末[7]。糖尿病患者饮食多肥厚油腻,易积食气滞,脾胃郁结,脾胃受损则无以消化精微,致体内运化失常,阴虚阳盛,阳气升而体内热,内热久积而伤阴,阴精亏虚而耗气,消渴日久,循环往复,耗气伤阴,致气阴两虚[8]。临床认为气阴两虚型2 型糖尿病表现为咽干口燥,倦怠乏力,多食易饥,口渴喜饮,气短懒言,舌红少津液,脉细数无力;将临床表现与大鼠体征、评价指标及实验室指标相对应,通过记录客观指标,观察体征变化,对模型进行评价。
首先通过对动物一般状态进行评分反映大鼠运动、精神状态的变化特点,分值越高,动物一般状态越差,以此说明大鼠倦怠懒言的体征特点越明显;通过对抓力、呼吸、脉搏等进行测定,抓力值降低,说明大鼠出现乏力状态,呼吸、脉搏减弱,表明大鼠出现气短、脉细无力等体征改变。
舌象的观察。血液在脉络中的正常运行取决于体内气的充盈和推动,气虚不足则推力弱,致血流不畅;作为血液的载体,脉络还需要阴液的滋养,阴液缺乏会导致脉络阻滞,血液瘀阻,故气阴两虚日久生瘀。试验结果显示,与A 组比较,B 组大鼠舌象的 R、G、B 值均显著降低,R、G、B 值减小,表明舌体颜色变暗;舌体颜色呈暗紫色,表现为瘀证。说明在模型制备过程中,B 组大鼠可能表现为气阴两虚夹瘀[9-11]。
进食量和饮水量的观察。中医临床气阴两虚具有咽干口燥、多食易饥、口渴喜饮的证候表现,我们通过监测进食饮水量来反映这种体征。试验显示,B 组的进食量、饮水量较A 组显著增加,结合血糖、尿糖、糖耐量等糖尿病基础检测指标的测定,也可综合评价2 型糖尿病气阴两虚证动物模型的证候表现。
内源性和外源性凝血功能APTT、PT 的观察。传统医学认为气为血之帅,血为气之母,气不足无以摄血;阴虚则血脉不充,血流运行不畅。气阴两虚则致瘀血阻滞,血凝速度加快。结果显示,B 组APTT、PT 较A 组明显缩短,说明可能出现瘀血阻滞,间接反映机体处于气阴两虚状态[12-13]。
血脂的观察。气阴两虚时脾胃损伤不能升清降浊,可诱发“痰浊”,痰饮内阻致血液粘稠而瘀血内生,血流不畅致气化失常而留滞成痰,故TC、TG和LDL-C 是中医痰浊评价的重要生化指标[14-15]。试验结果显示,B 组 TC、TG 和 LDL-C 值均升高;即在血糖代谢异常同时出现了血脂代谢异常;既反映了2 型糖尿病的特点,又符合气阴两虚,痰浊内生的机体状态。
免疫功能的观察。气虚由于机体元气不足,气的推动、固摄、运化、温煦等功能减退,或脏腑机能减退,在现代医学中表现为免疫功能紊乱[16]。胸腺是机体重要的中枢免疫器官,CD4、CD8 细胞属于机体免疫细胞—T 淋巴细胞的亚群,二者数量及比例平衡是保持体内免疫功能稳定的关键因素。上述指标都是评价机体免疫力的重要指标[17-18]。结果显示,与 A 组比较,B 组大鼠胸腺指数、CD4、CD4/CD8 值均明显降低,从而反映机体可能处于气阴两虚状态。
cAMP 和 cGMP 的观察。cAMP、cGMP 是反映体液免疫功能的重要指标,其含量可影响机体神经内分泌功能[19-20]。研究表明,阴虚时机体交感神经-肾上腺系统功能偏高,表现为第二信使cAMP 活性升高,而cAMP/cGMP 比值升高较单一cAMP 升高更具特异性[21]。结果显示,B 组 cAMP、cAMP/cGMP 值均显著高于A 组,说明机体阴虚状态显现。
总结本实验结果,病证模型动物的体征表现可概括为:精神萎靡,行动迟缓,进食量、饮水量增加,抓力降低,呼吸、脉搏减弱,舌体颜色呈暗紫色等;反映了临床2 型糖尿病气阴两虚证中咽干口燥、多食易饥、口渴喜饮、倦怠乏力、气短懒言、脉细无力、舌色暗紫等证候特点;同时实验室指标也出现了血糖、尿糖、糖耐量及 TC、TG、LDL-C 值均显著升高,PT、APTT、胸腺指数显著下降,cAMP 和 cAMP/cGMP 值显著升高,CD4、CD4/CD8 值显著降低,胰腺内胰岛组织损伤、功能显著下降等变化,也辅助证明了B 组大鼠出现2 型糖尿病气阴两虚证临床表现。而单纯高糖高脂喂养14 周的大鼠各项指标与 A 组比较,随机血糖、TG、cGMP、CD4 及舌象的 R值等指标有显著性差异,其余各项指标检测结果无显著性差异,因此,认为该模型还不能全面地反映出2 型糖尿病气阴两虚证的证候特点。
综上,大鼠高糖高脂喂养4 周后腹腔注射STZ 40 mg/kg,继续高糖高脂饲养至14 周制备的动物模型可较好地反映2 型糖尿病气阴两虚证的特点。由此说明,通过对动物体征指标进行监测可反映中医证候的发展过程,结合实验室指标进行定量化描述可进一步辅助验证病证结合动物模型的成立及证候特点的表达,二者结合有助于模型的评价,同时也使模型评价更为直观、客观、可操作,标准更易于统一。

