S100A7在肝内胆管细胞癌中的表达及其临床意义
陆小亮,吴 彬,陈科济,李爱军,范 飞
海军军医大学附属东方肝胆外科医院特需治疗科三病区,上海 200438
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)也被称为外周型胆管癌、胆管癌之肝内型,是肝内胆管被覆上皮发生的、起源于肝段胆管一直到赫令胆管上皮的一种原发性癌症,被定义为源于Ⅱ级以远的肝内胆管病变[1]。肝内胆管癌恶性程度高、症状隐慝,早期难以被发现,根治性切除机会较少,且发展迅速,预后不佳、死亡率高,近年来其发病率不断上升[2]。肝内胆管癌发生发展的确切机制目前尚不明确。本研究通过免疫组化、免疫印迹、PCR 方法测定S100A7 在肝内胆管癌组织及癌旁组织中的表达,并分析其与肝内胆管癌临床相关指标的关系。
1 材料和方法
1.1 临床资料
收集上海东方肝胆外科医院2018 年1 月—2020年1月收治的30例肝内胆管癌患者患者,男17例,女13 例。按国际抗癌联盟TNM 分期属Ⅰ、Ⅱ期11例,Ⅲ-Ⅳ期19例。所有患者均未行化疗、放疗和靶向、免疫治疗。
纳入标准:临床影像学诊断为肝内胆管癌,首诊于我院。排除标准:无远处转移,无手术禁忌。患者及家属均术前已签订我院标本供医学研究使用告知同意书,本研究经上海东方肝胆外科伦理会审核并批准。患者均行肝内胆管癌根治术。术后标本均经病理检查证实为肝内胆管细胞癌。
1.2 方法
运用免疫组化和real-timePCR、免疫印迹的实验方法检测S100A7 的蛋白和mRNA 在肝内胆管癌组织中的表达情况:新鲜液氮冻存的组织样本,分成2 份,一份提取蛋白,一份提取RNA。采用Invitrogen 公司的免疫组化试剂盒对30 例样本进行蛋白水平的检测;蛋白裂解液裂解组织,4 ℃下离心,获取上清、蛋白变性20 min;与细胞裂解液进行12%的SDS-PAGE 电泳,ECL 发光试剂盒显影、曝光,分析蛋白表达量;TRizol 抽提组织中的总RNA,设计针对S100A7 的特异引物,对反转录cDNA 进行real-time PCR 反应,以β-actin 为内参,检测S100A7的mRNA水平。
1.3 统计学分析
数据用SPSS 16.0 统计软件进行分析。采用Fisher 精确概率法、Linear-by-Linear Association法、Pearson Chi-square 法对S100A7 表达与相关临床相关性进行统计。P<0.05 为差异有统计学意义。
2 结果
2.1 免疫组化
免疫组化检测的30 例肝内胆管癌组织S100A7表达水平。结果显示,癌组织中S100A7 染色强度、阳性百分比和Quickscore 均显著高于癌旁组织,见图1。

图1 S100A7在肝内胆管癌及癌旁组织细胞中的表达(免疫印迹法)Fig.1 The expression of S100A7 in intrahepatic cholangiocarcinoma and the adjacent tissue cells(Western blotting)
2.2 免疫印迹
为验证免疫组化结果,我们用免疫印迹法检测了30 例肝内胆管癌组织标本中S100A7 表达水平。结果癌组织S100A7 蛋白表达水平亦明显高于癌旁组织,见图2。
2.3 qRT-PCR
为进一步验证S100A7 是否在肝内胆管癌高表达,我们用定量PCR检测了30例肝内胆管癌组织标本中S100A7 mRNA 表达。结果癌组织中S100A7 mRNA表达水平显著高于癌旁正常组织。见图3。
2.4 S100A7表达与肝内胆管癌临床病理的相关性
本研究分析了30 例肝内胆管癌S100A7 表达与临床病理因素的相关性。S100A7表达与浸润深度,淋巴结转移和TMN 分级存在显著相关性(P<0.05),但与患者患者的性别、年龄、淋巴管侵犯、肿瘤分化程度、远处转移无关。见表1。
3 讨论
肝内胆管癌是一种恶性程度高,较难早期发现,预后很差的恶性肿瘤。其发生可能与某些因素相关[3]如肝内胆管结石[4]、胆管分支(胆管树)形态异常、慢性感染、放射性核素及石棉、亚硝酸胺等化学性物质[5-6]。目前临床上应用的几个检查指标如癌胚抗原(CEA)、糖类抗原199(CA199)[7-9]、γ-谷氨酰转肽酶(γ-GT)、碱性磷酸酶(ALP)等为肝内胆管癌的肿瘤标志物,虽有一定特异度和灵敏度,但总体而言尚缺乏有效的临床诊治、预后判断的分子靶标,且相关基础研究较少。
我们前期通过高通量基因表达谱筛选、芯片检测及生物信息学分析,筛查出肝内胆管癌细胞存在一个显著变化的分子即S100A7(S100 calcium binding protein A7)。本文在这基础上,应用免疫组化、免疫印迹、实时定量PCR 进一步检测验证,并分析与肝内胆管癌患者的临床病理相关性。免疫组化、免疫印迹、实时定量PCR 的检测结果均显示,S100A7 在肝内胆管癌细胞中表达明显高于癌旁正常组织;而且发现,S100A7 在肝内胆管癌中表达与肿瘤浸润深度(T1、T2对T3、T4,P=0.027)、区域淋巴结转移(N0对N1-2,P=0.014)、TNM 分级(Ⅰ、Ⅱ期对.Ⅲ、Ⅳ期,P=0.021)呈正相关,提示肝内胆管癌S100A7 表达越高,其肿瘤浸润越严重,淋巴结越易转移,TNM 分期越晚,患者预后越差;但与性别、年龄、淋巴管转移、肿瘤分化程度、远处转移无关。
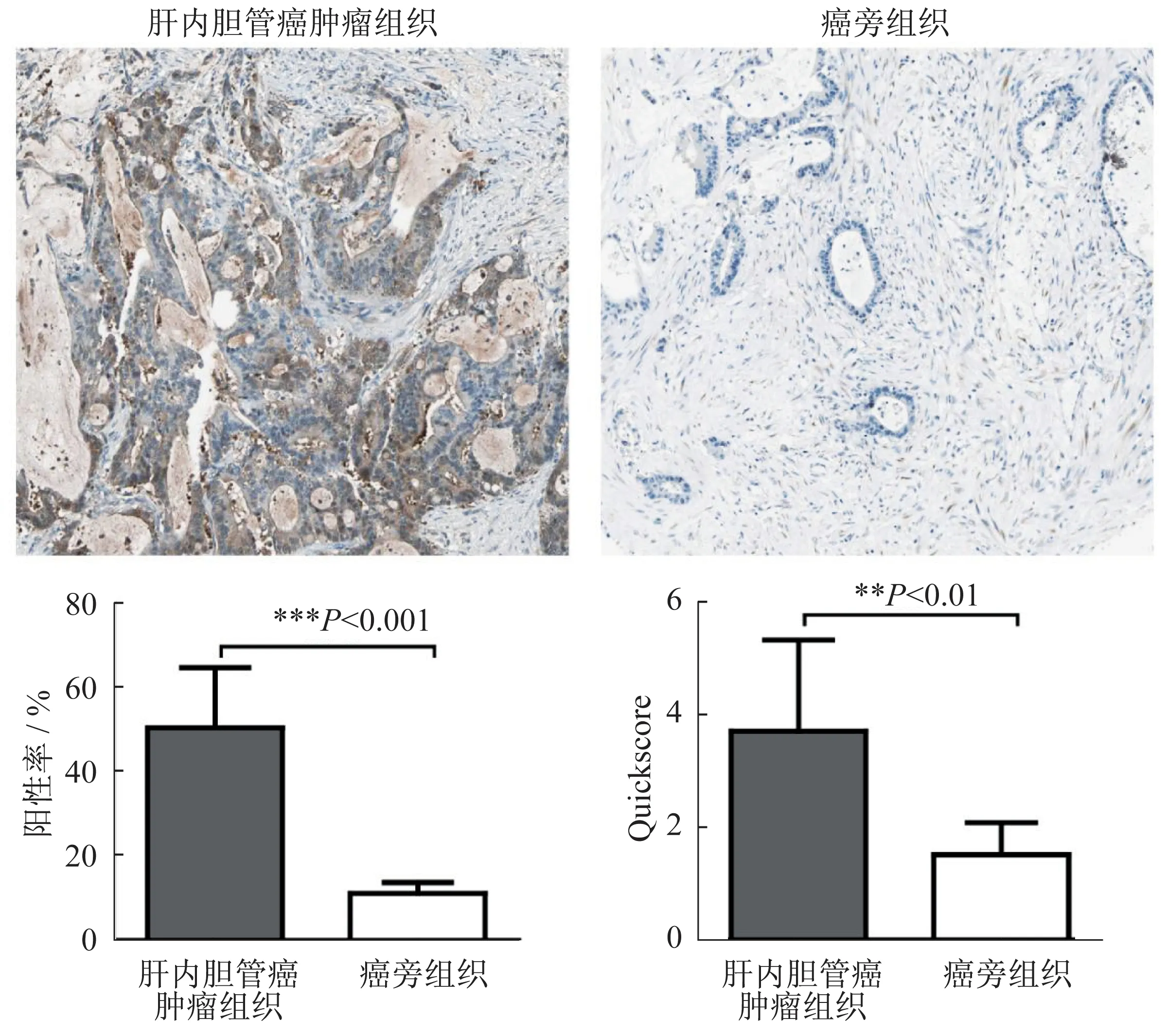
图2 S100A7在肝内胆管癌及癌旁组织细胞中的表达(免疫组化)Fig.2 The expression of S100A7 in intrahepatic cholangiocarcinoma and the adjacent tissue cells(immunohistochemistry)

图3 S100A7 在肝内胆管癌及癌旁组织细胞中的表达(qRT-PCR)Fig.3 The expression of S100A7 mRNA in intrahepatic cholangiocarcinoma and the adjacent tissue cells(qRT-PCR)
S100A7也称银屑病素,最早是在银屑病皮肤病变中被分离和发现的一个相对分子质量约11 400的低分子量蛋白,属S100家族[10]。该家族的典型结构特征是有两个螺旋基元(helix-loop-helix)组成的钙离子结合位点(calcium-binding site)[11]。在S100蛋白家族中,有22个家族成员在1号染色体21位基因座(locus)位置形成基因簇(cluster)[12],其中也包括S100A7。S100家族成员在细胞内、外均起重要的生理功能,包括钙离子平衡、增殖、凋亡、侵袭/运动、细胞骨架变化、转录等[13]。作为S100 家族的成员,S100A7 除了上述两个具有家族特征的钙离子结合位点外,还有一个特有锌结合位点(zinc-binding site),该位点可能是介导S100A7特异性功能的关键结构域[14]。据报道,S100A7参与了众多上皮来源的恶性肿瘤[15]包括子宫癌[16]、乳腺癌、肺癌、前列腺癌等[17-19]的 发 生、发 展 过 程,如S100A7 通 过 调 控Hippo-YAP 通 路 促 进 肺 癌 发 生 发 展[18]。而 且,S100A7 表达受表皮生长因子(epidermal growth factor,EGF)信号通路的调控,并参与该信号通路的调控[20]。我们团队曾报道,microRNA-26b-5p(miR-26b-5p)可通过抑制S100A7的过度表达抑制肝内胆管癌细胞的增殖、转移[21]。然而,关于S100A7 在肝内胆管癌中的功能和分子机制研究以及与临床病理相关性,罕有报道。本文结果,S100A7 在肝内胆管癌细胞高表达,且与肿瘤浸润深度、区域淋巴结转移、TNM 分级相关,提示可能参与了肝内胆管细胞癌的发生发展;在临床上开展检测S100A7 表达,可能助于了解肝内胆管癌患者的预后。如若进一步研究S100A7及其下游信号通路分子抑制剂,有望开发针对性的靶向药以改善患者不良预后。
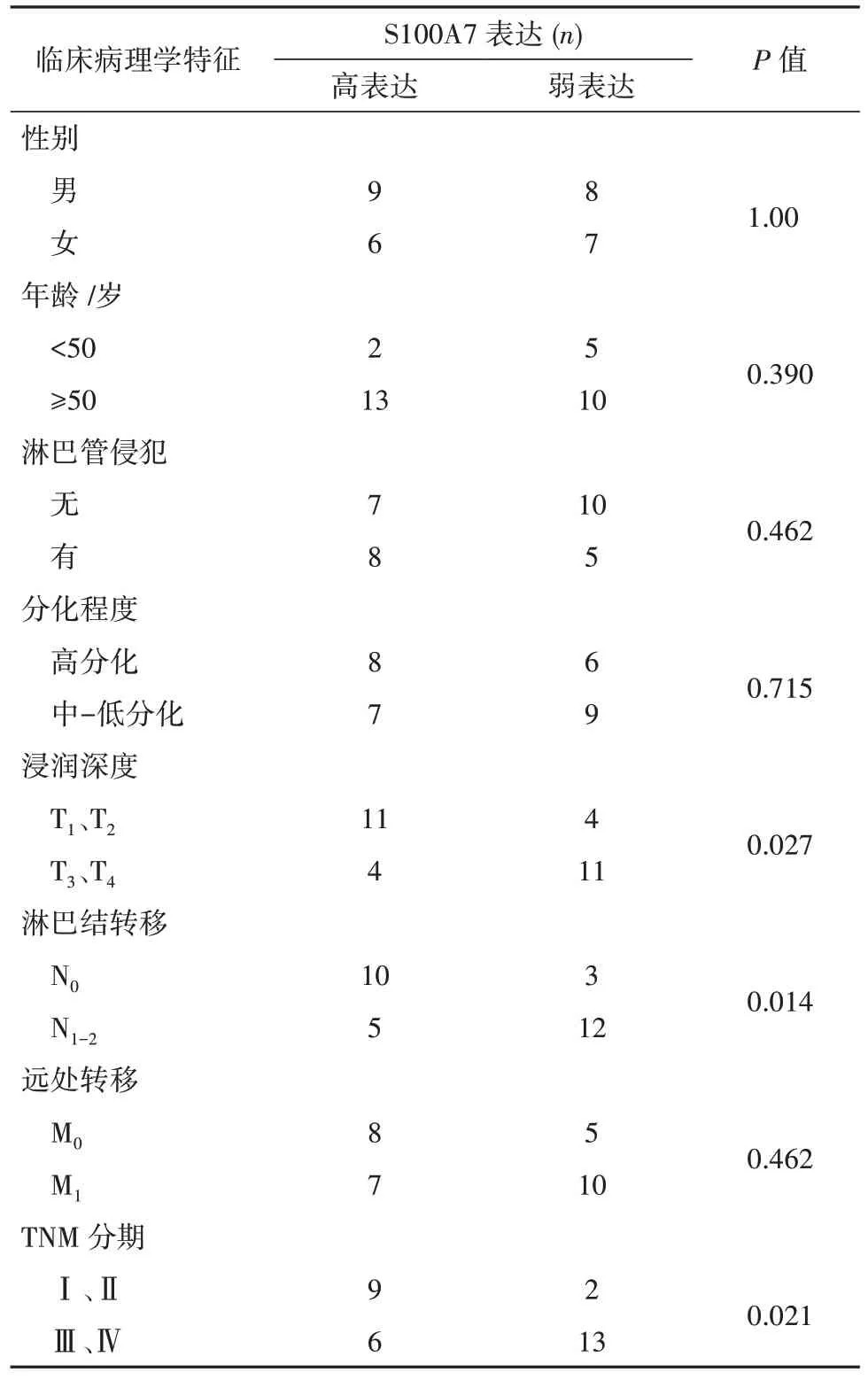
表1 肝内胆管癌S100A7表达与临床病理参数相关性Tab.1 Relationship between S100A7 expression in intrahepatic cholangiocarcinoma and clinicopathological parameters

