大黄对内毒素性肠损伤大鼠PTEN/PI3K/Akt信号通路的影响
汪顺,单聪,朱华贺,谭波,李小茜,杨爱东
1.上海中医药大学基础医学院,上海 201203;2.上海中医药大学附属曙光医院,上海 201203
肠黏膜在防止病原体、毒素和过敏原从外部进入组织起着至关重要的作用。研究表明,脂多糖(LPS)诱导仔猪肠损伤模型中肠黏膜屏障功能被破坏,继而引起促炎因子升高和炎症级联反应,导致肠黏膜损伤加重[1]。因此,改善肠组织损伤是避免炎症反应级联扩大的关键途径。大黄有清热泻火、凉血解毒功效。现代药理研究表明,大黄具有抗炎、抗肿瘤等作用[2],且可通过抑制炎症因子释放,改善大鼠肠源性脓毒症[3]。mTOR信号通路主要调节机体的生长和代谢,在自噬调节中发挥重要作用[4]。研究发现,激活mTOR信号通路可改善大鼠肠缺血再灌注引起的肠组织损伤[5]。本课题组前期研究表明,大黄可下调mTOR下游p70S6K和eIF4E mRNA的表达从而减少白细胞介素(IL)-6和IL-1β的释放[6],但是否与mTOR上游PTEN/PI3K/Akt信号通路有关还有待研究。基于此,本实验通过建立LPS诱导大鼠肠组织损伤模型,观察大黄对模型大鼠PTEN/PI3K/Akt信号通路的影响,探讨其作用机制。
1 实验材料
1.1 动物
清洁级Wistar雄性大鼠30只,体质量(200±20)g,购于上海西普尔-必凯实验动物有限公司,动物许可证号SCXY(沪)2018-0006。饲养于上海中医药大学动物中心SPF级动物房。本实验经上海中医药大学动物伦理会审查批准(PZSHUTCM19012502)。
1.2 药物
生大黄27 g,饮片购自上海中医药大学附属曙光医院,批号170401,常规煎制;LPS,来源于大肠杆菌O55:B5,Sigma公司,批号057M4013V;地塞米松片,上海信谊药厂有限公司,批号015190213。
1.3 主要试剂与仪器
PTEN兔抗鼠单克隆抗体(货号9188)、Akt兔抗鼠多克隆抗体(货号4691)、β-actin兔抗鼠单克隆抗体(货号3700),美国CST公司;PI3K兔抗鼠单克隆抗体(货号ab182651),美国Abcam公司;羊抗兔IgG二抗(货号A0208)、RIPA裂解液(货号P0013C)、BCA试剂盒(货号P0010),上海碧云天;EnVision试剂(货号K400311-2),丹麦Dako公司。电热恒温水浴锅(DK-S22),上海精宏;微波炉(WD800SL-4Ⅱ),格兰仕公司;切片机(RM2145),德国徕卡公司;隔水式恒温培养箱(GNP-9270),上海精宏实验设备有限公司;化学发光成像系统,美国Bio-Rad公司。
2 实验方法
2.1 分组、造模和给药
按随机数字表将大鼠分为正常组、模型组、地塞米松(0.27 mg/kg)组、大黄低剂量(0.8 g/kg)组、大黄高剂量(3.2 g/kg)组,每组6只。适应性喂养1周,造模前地塞米松组、大黄低剂量组、大黄高剂量组给予相应药液灌胃5 d,1次/d。第5日给药后2 h,除正常组外,余各组大鼠尾静脉注射LPS(8 mg/kg)复制肠损伤模型。大黄27 g水煎成84 mL(0.32 g/mL),给药前按4∶1比例稀释成不同剂量,大黄低、高剂量组分别含原药材0.08、0.32 g/mL;取地塞米松片10片,研碎后溶于100 mL纯净水(0.075 mg/mL)。灌胃体积均为2 mL,正常组和模型组给予等体积蒸馏水灌胃。按人与动物间体表面积折算等效剂量[7]。
2.2 取材
大鼠造模7 h后,腹腔注射乌拉坦(2.0 mg/kg)麻醉,75%酒精消毒,打开腹腔,取出大肠组织,经处理后置于4%多聚甲醛中固定,-80 ℃冰箱保存。
2.3 病理观察
取大鼠肠组织,脱水,石蜡包埋,切片(厚度5 μm),常规HE染色,光镜下观察组织病理学变化。
2.4 免疫组化检测肠组织PTEN、PI3K、Akt、mTOR蛋白表达
取大鼠肠组织石蜡切片,常规脱蜡至水,PBS清洗3次×3 min;微波炉加热后自然冷却,清洗3次,0.3%H2O2抑制20 min;清洗3次;依次用20%羊血清、一抗孵育;清洗3次;EnVision试剂(HRP/R)37 ℃孵育30 min;清洗3次;DAB显色;苏木素衬染色,热水蓝化;树脂封片并镜下观察,紫蓝色为背景,棕黄色为阳性产物。采用IMS软件对免疫组化结果进行图像采集并进行半定量分析。
2.5 Western blot检测肠组织PI3K、p-mTOR蛋白表达
称取0.1 g大鼠肠组织,加入1 mL裂解液,4 ℃匀浆,离心后取上清液,用BCA试剂盒进行蛋白定量,定量后组织原液制备成4 μg/μL蛋白样品,Western blot检测肠组织PI3K、p-mTOR蛋白的表达,采用Image J软件分析灰度值。
3 统计学方法
采用SPSS24.0统计软件进行分析。实验数据以±s表示,符合正态分布两组间比较用成组t检验;偏态分布数据以[M(P25,P75)]表示,2组间比较用Mann-WhitneyU检验;多组间比较符合正态分布且方差齐用方差分析,两两比较用LSD检验;如数据不符合正态分布或方差不齐则用非参数检验方法。P<0.05表示差异有统计学意义。
4 结果
4.1 HE染色病理观察结果
正常组大肠组织未见明显病理性改变;模型组肠壁黏膜层广泛变性坏死,大量肉芽组织增生(+++);各给药组病理学改变较模型组减轻。见图1。

图1 各组大鼠肠组织形态(HE染色)
4.2 免疫组化检测结果

图2 各组大鼠肠组织PTEN、PI3K、Akt、mTOR蛋白阳性表达(免疫组化染色,×200)
紫蓝色为背景,棕黄色为阳性产物,肠黏膜上皮细胞呈广泛连续性着色。模型组着色减少,PI3K、Akt着色明显;大黄高剂量组PTEN着色明显增多,各给药组PI3K、Akt着色显著减少;mTOR各组无明显变化。见图2。与正常组比较,模型组大鼠肠组织PTEN蛋白表达显著降低(P<0.001),PI3K、Akt蛋白表达显著升高(P<0.001,P<0.01);与模型组比较,大黄高剂量组大鼠肠组织PTEN蛋白表达显著升高(P<0.01),地塞米松组和大黄低、高剂量组大鼠肠组织PI3K蛋白表达显著降低(P<0.001),Akt蛋白表达显著降低(P<0.05,P<0.001)。结果见表1。
表1 各组大鼠肠组织PTEN、PI3K、Akt、mTOR蛋白表达比较(±s,阳性面积率)

表1 各组大鼠肠组织PTEN、PI3K、Akt、mTOR蛋白表达比较(±s,阳性面积率)
注:与正常组比较,**P<0.01,***P<0.001;与模型组比较,#P<0.05,##P<0.01,###P<0.001
组别 只数 PTEN PI3K Akt mTOR 正常组 6 3.67±0.60 8.65±3.67 6.00(3.87,11.72) 7.00(6.40,12.05) 模型组 6 1.65±0.49*** 13.67±3.22*** 10.69±2.02** 8.08(7.56,10.54) 地塞米松组 6 1.11(0.62,2.51) 9.33±3.70### 7.29(6.05,10.58)# 9.29±6.27 大黄低剂量组 6 1.98±0.51 7.58±1.86### 5.33(4.48,10.18)### 5.19(4.59,11.97) 大黄高剂量组 6 2.38±0.77## 8.08±2.19### 5.74±1.31### 4.91±1.50
4.3 Western blot检测结果
与正常组比较,模型组大鼠肠组织PI3K、p-mTOR蛋白表达显著升高(P<0.05,P<0.01);与模型组比较,地塞米松组和大黄低、高剂量组大鼠肠组织PI3K蛋白表达显著降低(P<0.05,P<0.01),地塞米松组和大黄低、高剂量组大鼠肠组织p-mTOR蛋白表达显著降低(P<0.01,P<0.001,P<0.000 1)。结果见图3。
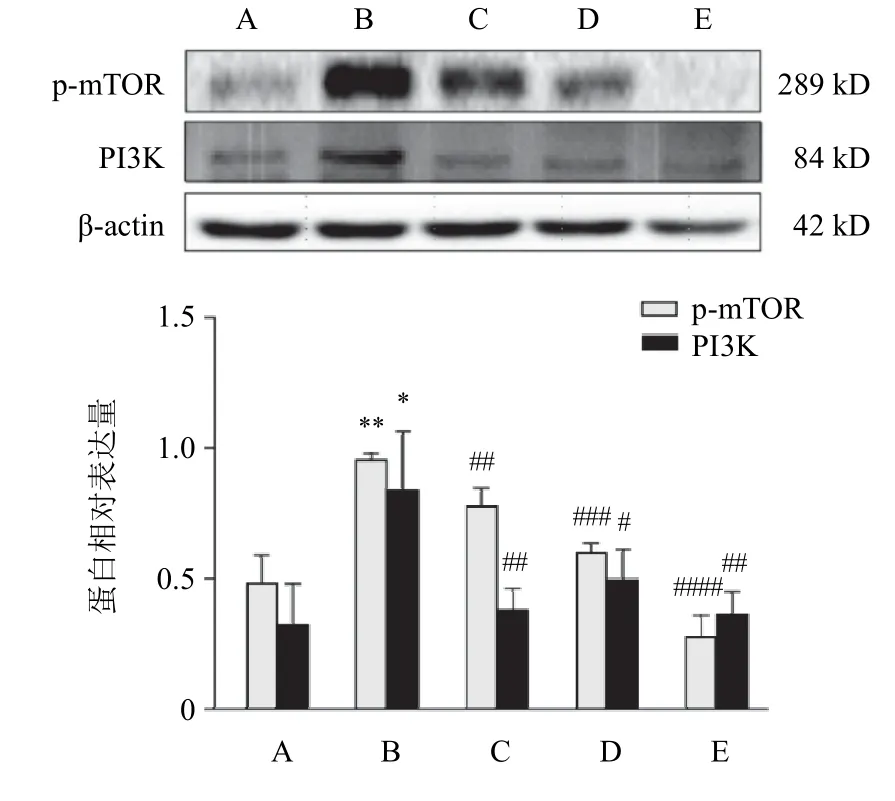
图3 各组大鼠肠组织PI3K、p-mTOR蛋白表达比较(±s,每组6只)
5 讨论
LPS作为内毒素的主要成分,是一种强力的炎症诱导剂[8]。肠道被认为是导致多种严重疾病的始动器官[9],肠道中存在大量革兰阴性菌[10],是内毒素的潜在来源,当机体处于休克、感染等应激状态时,内毒素会透过肠黏膜进入血液,导致内毒素血症、脓毒症及多器官功能障碍综合征等危重症疾病[11-12]。由此可见,改善肠组织损伤,恢复肠黏膜的“屏障”功能是避免由内毒素引起的全身炎症反应和危重疾病的关键一环。
PI3K/Akt信号通路与LPS引起肠黏膜屏障功能密切相关[13-14]。PI3K是一种细胞内磷脂酰肌醇激酶,在细胞的生长、迁移和细胞周期进程中有着重要作用[15],影响细胞多种生物学功能。PI3K通常可被生长因子、细胞因子和激素等细胞外刺激所激活,激活后的PI3K磷酸化下游靶标并激活Akt[16]。活化的Akt可磷酸化哺乳动物mTOR,并发挥自噬调节作用[17]。PTEN参与细胞生长、代谢,以及细胞结构与环境有关的多个细胞过程[18],其最重要的功能是使PI3K下游靶标去磷酸化并抑制Akt的激活,是PI3K/Akt信号传导的主要负调节剂[19]。
本研究发现,模型组大鼠肠壁黏膜层广泛变性坏死,大量肉芽组织增生,提示造模成功。大黄低、高剂量组病理学改变较模型组减轻,表明大黄对LPS导致的肠组织损伤具有保护作用。本实验结果显示,模型组大鼠肠组织PTEN蛋白表达显著降低,PI3K、Akt、p-mTOR蛋白表达显著升高,表明LPS引起的肠组织损伤与PTEN/PI3K/Akt信号通路有关。
Kwon等[20]研究发现,大黄可通过激活核因子E2相关因子2/血红素加氧酶-1抗氧化剂途径,阻断核因子-κB失活导致的促炎因子和介质的释放,从而减轻食管黏膜炎症损伤。彭淑梅等[21]研究发现,大黄可降低肿瘤坏死因子-α水平,改善全身性炎症反应综合征。本实验结果表明,大黄能改善内毒素导致的大鼠肠损伤,且能上调PTEN,下调PI3K、Akt、p-mTOR蛋白的表达。虽然免疫组化结果显示各组大鼠肠组织mTOR蛋白表达无显著差异,但Western blot结果显示模型组大鼠肠组织p-mTOR表达显著升高,大黄低、高剂量组p-mTOR显著降低,表明LPS能磷酸化mTOR,而大黄对此产生抑制,这可能与大黄降低其上游蛋白Akt的表达有关。
PTEN/PI3K/Akt信号通路是细胞内参与增殖调控的信号通路之一,与自噬高度相关[22]。研究表明,Akt磷酸化后mTOR会形成mTORC1,mTORC1能磷酸化多种自噬相关蛋白并抑制自噬体的形成,从而抑制自噬作用[23-24]。此外,结节性硬化复合物1和2(TSC1/2)可将有活性的GTP酶转化成无活性的GDP并负性调控mTORC1[25]。我们前期研究表明, 大黄可下调mTOR下游p70S6K和eIF4E mRNA的表达,但并未验证其上游其他蛋白或基因的表达。本研究发现,大黄可降低模型大鼠肠组织p-mTOR表达,除与上游Akt表达降低有关外,可能还与TSC1/2复合物有关,我们将在以后的实验中深入研究。
综上,大黄对内毒素性肠损伤大鼠具有保护作用,其作用机制可能与其上调PTEN和下调PI3K、Akt、p-mTOR蛋白表达有关。

