咖啡腐皮镰孢黑果病病原鉴定及其生物学特性测定
朱孟烽 吴伟怀 贺春萍 梁艳琼 陆英 习金根 莫丽珍 谭施北 易克贤

摘 要:本文针对云南咖啡园在雨季出现的一种咖啡果实变黑的黑果病害进行病原菌分离,获得CPE5和CPE12菌株。这2个菌株在PDA培养基上菌落呈圆形,毡状,菌丝体灰白色,表面稀疏,背面出现浅黄色色素。分生孢子具1~8个隔膜,长6.08~65.3 ?m,宽2.76~9.03 ?m。小型分生孢子呈肾形,大型分生孢子镰刀型。致病性测定表明,无论是接种健康新鲜的咖啡离体叶片还是果实,产生的症状以及再分离后获得的分生孢子形态特征均与初始接种菌株的一致。分子鉴定结果表明,无论是ITS、β-tubulin、TEF、28S rDNA单个基因聚类树,还是ITS-TEF加合基因序列聚类结果均一致,表明菌株CPE5与CPE12均属于腐皮镰孢(Fusarium solani)。这是国内腐皮镰孢危害咖啡果实的首次报道。病原菌的生物学特性研究表明,咖啡腐皮镰孢菌最适宜生长的培养基是PDA和玉米粉琼脂培养基;最适生长温度为28 ℃;完全光照有利于病原菌的生长。病原菌对碳源甘露醇以及氮源牛肉浸膏、甘氨酸、尿素利用率最高;菌株在75 ℃,10 min条件下即可致死。咪鲜胺锰盐和戊唑醇2种药剂的EC50值分别为1.8352 ?g/mL和1.4826 ?g/mL,对菌株CPE5菌丝体生长具有十分显著的抑制效果。
关键词:咖啡;腐皮镰孢;分子鉴定;生物學特性
中图分类号:S435.712 文献标识码:A
Identification and Biological Characteristics of Fusarium solani Causing Coffee Black Berry Disease
ZHU Mengfeng1, WU Weihuai2*, HE Chunping2, LIANG Yanqiong2, LU Ying2, XI Jingen2, MO Lizhen3, TAN Shibei2, YI Kexian2*
1. School of Life Science and Pharmacy, Hainan University, Haikou, Hainan 570288, China; 2. Environment and Plant Protection Institute, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Integrated Pest Management on Tropical Crops, Ministry of Agriculture and Rural Affairs, Haikou, Hainan 571101; 3. Yunnan Puer Tea and Coffee Industry Development Center, Puer, Yunnan 665000, China
Abstract: In this study, the pathogen was isolated from an unknown disease in the coffee garden in Yunnan, which can darken the coffee berry. Two strains, CPE5 and CPE12 were obtained. The strains had a round, felt-like colony on PDA medium, the mycelium was off-white, the surface was sparse, and light yellow pigment appeared on the back. The conidia had 1-8 septums, its length was 6.08-65.3 ?m and width was 2.76-9.03 ?m. Small conidia were kidney-shaped and large conidia were sickle-shaped. The pathogenicity test showed that no matter whether inoculating healthy fresh coffee leaves or fruits, the symptoms and the morphological characteristics of the conidia obtained after re-isolation were consistent with the original inoculated strains. Molecular identification results showed that ITS, β-tubulin, TEF, 28S rDNA, four single gene clustering tree, and ITS-TEF adduct gene sequence clustering results were consistent, indicating that CPE5 and CPE12 belong to Fusarium solani. This is the first report that Fusarium solani harms coffee berry. Studies on the biological characteristics of the pathogen showed that the most suitable growth media were PDA and corn flour agar medium, the optimum growth temperature was 28 ℃, full light was conducive to the growth. The strains had the highest utilization rate of carbon source mannitol and nitrogen source beef extract, glycine, and urea. The strains could be sterilized at 75 ℃ for 10 minutes. The EC50 values of prochloraz manganese salt and tebuconazole were 1.8352 g/mL and 1.4826 g/mL, respectively, which had a very significant inhibitory effect on the growth of CPE5 mycelium.
Keywords: coffee; Fusarium solani; molecular identification; biological characteristics
DOI: 10.3969/j.issn.1000-2561.2021.03.030
咖啡曾经作为世界贸易价值仅次于石油的商品[1],与可可、茶叶并称为世界三大饮料。咖啡具有很高的经济价值和营养价值,居世界三大饮料之首[2]。目前,我国咖啡种植区域主要集中于云南省和海南省,西藏、福建、四川、广西、广东等省(区)也有少量种植。据农业农村部统计,2018年我国咖啡总面积12.27万hm2,其中云南占99.22%,海南占0.37%。与此同时,近年来我国也逐渐成为咖啡消费大国,咖啡消费量正以每年超过20%的速度增长[3]。目前,我国咖啡消费市场规模约1000亿元,与美、日等发达国家相比,我国的咖啡消费仍处于初期阶段。2016年,我国咖啡出口创收5.28亿美元[4],可见我国咖啡产业具有良好的发展前景。
然而,随着咖啡种植面积的扩大,以及品种、种苗的不断引进与调运,导致咖啡生产过程中病害频繁发生,严重影响和制约咖啡产业的健康发展[5-9]。咖啡黑果是小粒种咖啡产区普遍出现的一种症状,严重影响小粒种咖啡的产量与质量[10-11]。产生黑果的原因也有多种,既有生理因素引起的枝枯干果,也有虫害、病害所引起的黑果[10-12]。而在病害方面,根据对云南省普洱市思茅区咖啡黑果病的调查结果表明,咖啡生尾孢菌、咖啡炭疽病菌以及拟束梗镰刀菌(Fusarium stilboides)均可导致咖啡黑果[10],但该文中未见柯赫氏法则等相关内容。
2018年夏季,云南普洱由于连续降雨,导致大量咖啡果实变黑,严重影响产量,初步判断是由病害引起,但未鉴定其病原菌。为了鉴定该病害的病原及其发生规律,本研究在分离获得病样分离物的基础上,通过致病性测定、形态学观察并结合多基因序列的分子鉴定,以明确引起咖啡黑果的病原菌,并对其生物学特性进行研究,为该病害的预测与防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株 从云南普洱南岛河咖啡种植区收集典型病样,通过分离纯化获得单孢菌株CPE5与CPE12,菌株保存于中国热带农业科学院环境与植物保护研究所。
1.1.2 试剂 本研究所用的PCR扩增引物由英潍捷基(上海)贸易有限公司使用普通脱盐方法合成;Premix Taq购自TaKaRa;真菌DNA提取试剂盒、质粒提取试剂盒为OMEGA公司试剂产品;用于连接转化的大肠杆菌Trans-T1感受态细胞以及pEASY-T1 Cloning Kit均购自北京全式金生物试剂公司。所用其余试剂均为国产分析纯。
1.2 方法
1.2.1 病原菌分离与形态观察 从种植地采集的病果经过表面清洗后,将果皮剪成4~6 mm2大小,在超净工作台进行表面消毒,然后转移至PDA培养基。待长出新鲜菌丝后,转入新的PDA培养基。纯化培养7 d后对其菌落形态进行拍照。用无菌铁勺刮去培养基表面气生菌丝,于超净台晾晒2 d后用无菌水冲洗表面,制成孢子悬浮液,并在显微镜(日本Nikon NI/E)40倍镜下对200个分生孢子形态、大小等进行观察、测量与记录。
1.2.2 病原菌致病性测定 采用2种方式进行致病性测定。(1)摘取健康咖啡新鲜嫩叶,通过微刺伤后接种2个菌丝块,并以无菌PDA为对照,各接种3片叶;25 ℃保湿培养,6 d后观察发病情况;(2)取田间健康的咖啡果实洗净,通过微创伤后接种孢子悬浮液(1×107个/mL),并以接种清水为对照。各接种3个果实。25 ℃保湿培养,定期观察。待发病后进行拍照保存,并对发病部位组织进行再分离。
1.2.3 菌丝体培养、收集以及DNA提取 将病原菌在PDA平板上预培养3 d,在超净工作台挑取3个约0.5 cm2大小的新鲜菌丝块接种到经高温高压灭菌的酵母液体培养基(每升培养基含1%葡萄糖,0.3%酵母粉)。经180 r/min,28 ℃,摇菌培养4~5 d。用纱布过滤,无菌水冲洗3~5次,滤纸吸去多余水分收集菌丝体,经冻干机将菌丝体干燥。利用OMEGA真菌提取试剂盒提取病原菌DNA,-20 ℃冷冻备用。
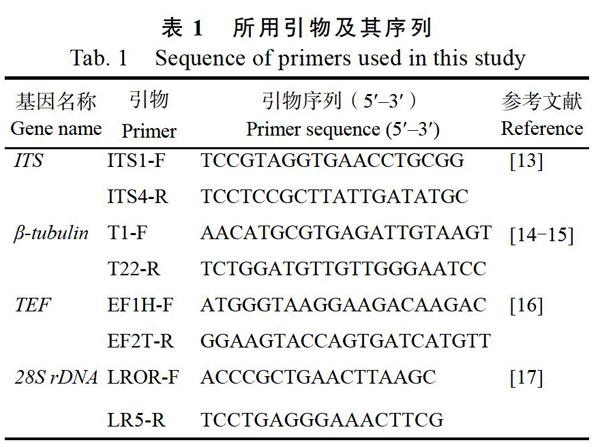
1.2.4 病原菌分子鉴定 采用ITS1/ITS4(ITS基因)、T1/T22(编码蛋白基因β-微管蛋白,β-tubulin)、EF1H/EF2T(真核生物延伸生长因子基因,TEF)、LROR/LR5(28S rDNA基因)共4对引物对病原菌进行分子鉴定,具体序列见表1。扩增程序为:94 ℃下预变性3 min,然后94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,35个循环后72 ℃延伸10 min,反应结束后置于4 ℃冰箱保存。扩增产物在1%的琼脂糖凝胶检测并回收。回收产物连接pMD18T载体,并于大肠杆菌克隆。挑取单菌落进行分子鉴定,选取3个阳性克隆子于英濰捷基(广州)贸易有限公司测序。
1.2.5 序列分析 将测序获得菌株的ITS、β-tubulin、TEF和28S rDNA基因片段序列与从GenBank中下载的菌株(部分为模式菌株)序列,使用DNAStar Seqman软件进行对齐,并通过人工校对后,使用MEGA 7.0软件进行比对分析,分别构建基于ITS、β-tubulin、TEF、28S rDNA单个基因序列的系统发育树。其中ITS和TEF基因序列进一步用于构建双基因加合树。用于构建发育树的菌株相关信息见表2。
1.2.6 病原菌生物学特性测定 (1)营养因子测定。分别测定不同培养基、碳源、氮源等对病原菌生长的影响。选用PDA培养基、玉米粉琼脂培养基、牛肉膏蛋白胨培养基、萨氏培养基、Czapek培养基、燕麦粉琼脂培养基为参试培养基;碳源、氮源则采用Czapek培养基作为基础培养基,将该培养基的硝酸钠分别使用等氮当量的牛肉浸膏、半胱氨酸、甘氨酸、硫酸铵、硝酸铵、氯化铵、尿素代替;以及使用等碳当量的麦芽糖、果糖、葡萄糖、乳糖、甘露醇、可溶性淀粉代替蔗糖;从而配制成不同的碳源、氮源培养基。利用灭菌打孔器(d=5 mm),在PDA平板预培养7 d的病原菌边缘打取菌块,接种于上述培养基中,于28 ℃培养7 d后测量菌落直径。各处理均重复3次。
(2)非营养因子测定。分别测定温度、pH、光照条件以及病原菌的致死温度等非营养因子。温度试验共设4、13、20、25、28、30、37 ℃等7个梯度,培养7 d;光照试验设24 h光照,12 h/12 h光照/黑暗,24 h全黑暗条件,置于28 ℃恒温培养箱培养7 d;pH试验则设3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0共9个梯度,置于28 ℃培养7 d。采用十字交叉法测量菌落直径。病原菌致死温度测定:通过在2 mL的离心管中加入1 mL的无菌水,在离心管中加入菌饼(d=5 mm),并分别在35、40、45、50、55、60、65、70、75 ℃温度水浴10 min(预热1 min)后,接种到PDA平板培养基上,置于培养箱中28 ℃培养,7 d后采用十字交叉法测量菌落直径。各处理均重复3次。
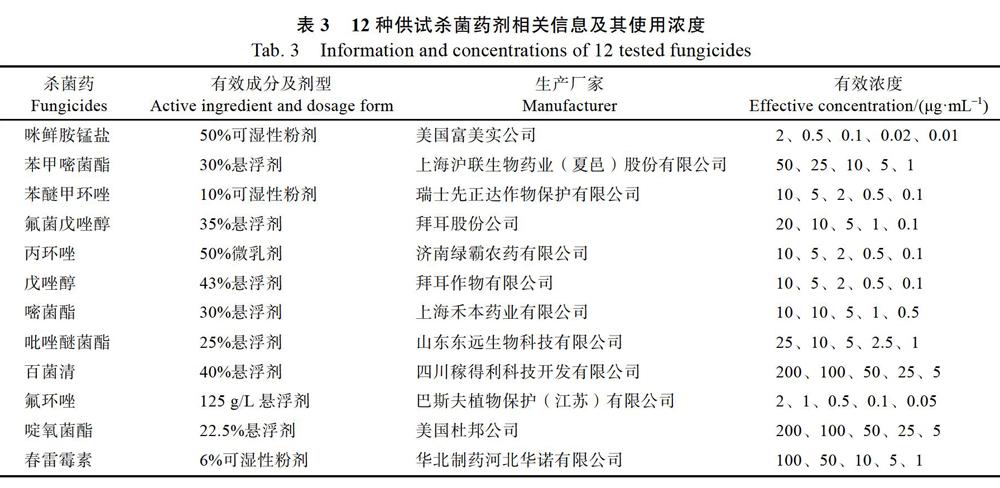
1.2.7 病原菌药剂敏感性测定 利用12种供试杀菌药剂(表3),配制不同浓度的含药剂平板,将培养好的CPE5病原菌菌块(d=5 mm)接于含药剂平板的中心,每个浓度设置5个重复,置于28 ℃恒温培养箱培养7 d,用十字交叉法测量病原菌菌落直径,计算生长抑制率,分析不同杀菌剂对供试病菌菌丝体生长的影响。
1.3 数据处理
采用SPSS 13.0分析软件和Excel软件进行试验数据的统计分析。
2 结果与分析
2.1 病害症状及病原菌的形态特征
该病原菌主要危害咖啡果实,感病果实变蓝黑色,由果柄向果蒂逐渐蔓延,最后发展至全果(图1A)。通过常规分离法分离获得分离物CPE5、CPE12,分离物在PDA上生长迅速,培养7 d后,菌落呈圆形,毡状,菌丝灰白色,表面稀疏(图1B),背面出现浅黄色色素(图1C)。分生孢子有1~8个隔膜,长6.08~65.3 ?m,宽2.76~9.03 ?m;小型分生孢子呈肾形,大型分生孢子若纺锤形,两端尖(图1D)。
2.2 致病性测定
挑选健康无机械损伤的小粒种咖啡叶片,进行微刺伤后接种2个菌丝块,用无菌PDA作为对照。6 d后,接种叶片表面出现感病症状,病斑边缘呈现黄色,病斑中心为黑色,而其对照则无任何发病迹象(图2A)。而孢子悬浮液接种健康的咖啡果实7 d后,刺伤处颜色由褐变黑,局部伴有白色霉点(图2B),而其对照亦无任何感病症状(图2C)。再分离的病原菌分生孢子与原接种菌一致(图2D)。由此可判断所分离的病原菌为致病菌。
2.3 分子鉴定
采用ITS1/ITS4、T1/T22、EF1H/EF2T、LROR/LR5共4对引物对病原菌进行分子鉴定,经过琼脂糖凝胶电泳检测分别获得568、1332、743、925 bp的片段。将上述序列分别在GenBank数据库中进行同源性搜索,下载同源性较高的菌株序列,与本研究的菌株CPE5和CPE12的序列构建Neighbor-joining Tree。由于数据库中序列长度存在差异,使用Seqman软件进行比对并手工校正,最终用于构建发育树的目的菌株ITS、β-tubulin、TEF、28S rDNA序列分别为464、1323、614、870 bp。基于不同序列构建的单基因系统发育树存在一定的差异(由于篇幅所限,单基因发育树未在文中列出)。在ITS序列系统发育树中,CPE5、CPE12与Fusarium solani JF740882和F. solani JF740931菌株聚类为一支。在β-tubulin序列系统发育树中,CPE5、CPE12与F. solani KU983876、F. solani KF255996聚类成一个分支;TEF序列系统发育树显示,CPE5、CPE12与F. solani JF740846、F. solani DQ247538菌株聚类为一支;而在28S rDNA序列系统发育树中,CPE5、CPE12则与F. solani MH875874菌株虽然聚类在同一分支,但只有91%的节点支持率。由于上述基因序列的缺失,本研究仅通过将ITS与TEF基因序列拼接,构建双基因加合树。聚类结果显示,CPE5、CPE2与F. solani NRRL52778、NRRL25083菌株聚类成一个分支,且其节点支持率为100%(图3)。综合上述,由ITS、β-tubulin、TEF、28S rDNA四个单基因系统发育树以及ITS和TEF的双基因加合树,可得出CPE5和CPE12属于腐皮镰孢(Fusarium solani)。
2.4 咖啡腐皮镰孢菌生物学特性
2.4.1 营养因子对咖啡腐皮镰孢菌生长的影响 营养因子测定结果表明,菌株CPE5在供试的6种培养基上均能生长,最适宜生长的培养基是PDA和玉米粉琼脂培养基,其菌落平均直径分别为76.17 mm和71.58 mm;牛肉膏蛋白胨培养基、燕麦粉琼脂培养基的效果次之,菌落平均直径分别为66.5 mm和64.17 mm;其余培养基生长效果则较差(篇幅所限,数据未列出。下同)。在供试的7种不同碳源培养基中,以甘露醇的利用率最高,培养7 d后病原菌菌落平均直径为79.17 mm,显著高于其他碳源培养基;其次为果糖,菌落平均直径为74.83 mm;蔗糖和乳糖的碳源利用率最差,无显著差异,平均菌落直径为52.5 mm和51.33 mm。在供试的8种不同含氮培养基上,利用率较高的是牛肉浸膏、甘氨酸、尿素,菌落平均直径依次为77.00、79.17、76.5 mm,三者之间无显著差异;其次为半胱氨酸和氯化铵,平均菌落直径为64.00 mm和65.17 mm;利用率最低的為含硝酸铵的培养基,菌丝极稀薄,不易用肉眼观察。
2.4.2 非营养因子对咖啡腐皮镰孢菌生长的影响 非营养因子测定结果表明,病原菌可在13~30 ℃的环境下生长,在4 ℃以及37 ℃的环境下,病原菌不能生长;适宜生长温度为25~30 ℃,最适生长温度为28 ℃,菌落平均直径显著大于其他处理;温度小于25 ℃的条件下病原菌的生长受到抑制。菌株在中性及偏碱性的环境下生长明显快于偏酸性环境,当pH<3时菌株的生长受到抑制。完全光照有利于病原菌生长,其次为12 h光暗交替,在完全黑暗条件下不利于菌株菌丝的生长。菌饼在70 ℃水浴10 min后,在28 ℃环境下依旧能正常生长,但在75 ℃下水浴后菌落不生长。所
以CPE5菌株的致死温度和致死时间分别为75 ℃和10 min。
2.5 病原菌室内毒力测定
室内毒力测定结果显示,咪鲜胺锰盐和戊唑醇2种药剂的EC50值分别为1.8352 g/mL和1.4826g/mL,对CPE5菌株菌丝体生长具有十分显著的抑制效果。而氟菌戊唑醇、嘧菌酯、百菌清等3种药剂对病原菌的抑制效果次之,EC50值分别为4.7226、2.8080、2.7433 g/mL;此外,丙环唑、氟环唑也有较强的抑制效果,EC50分别为9.0377、6.9998 g/mL。其中,啶氧菌酯与春雷霉素对该病原菌的抑制效果最差,EC50值分别为7405.9907、9522.0294g/mL,基本无抑制效果。12种不同的杀菌剂对腐皮镰孢菌的抑制效果存在差异(表4)。
3 讨论
镰刀菌属(Fusarium ssp.)是世界上分布范围很广的一类真菌,可侵染多种作物,引起根腐病、莖腐病等症状。镰刀菌属种类繁多,部分镰刀菌存在多个专化型,以及种间差异,加上多种形态,给鉴定分类带来很大的困难。仅依靠形态学鉴定无法很好地区分种类。目前应用于鉴定镰刀菌的基因位点主要有ITS、TEF、β-tubulin、28S rDNA,以及线粒体小亚基核糖体(mtSSU)、组蛋白(H3)、钙调蛋白(calmodulin)等[18]。如林珊宇等[19]使用rDNA-ITS序列鉴定出引起火龙果软腐病的病原菌是木贼镰刀菌(Fusarium equiseti);杨波等[20]利用引物对EF1H/EF2T扩增目的片段,结合形态学鉴定出引起新疆马铃薯根腐病的病原菌为锐顶镰刀菌等5种不同的镰刀菌。张曼等[21]使用ITS基因序列和EF1-α基因序列相结合确定引起葫芦砧木萎蔫病的病原菌是腐皮镰孢菌(Fusarium solani);张贞明等[22]使用引物对Fu3/Fu4确定引起甘肃省武威市苜蓿根腐病的病原菌是半裸镰孢菌、厚垣镰孢菌、层出镰孢菌3种致病菌。
本研究通过采用ITS、TEF、β-tubulin、28S rDNA四个单基因对从咖啡黑果病样上分离获得的病原菌进行分子鉴定,并且构建ITS与TEF基因的加合树,综合分析确定该病原菌为腐皮镰孢菌(Fusarium solani)。尽管,目前已有报道多种危害咖啡浆果的病害,如由卡哈瓦刺盘孢(Colletotrichum kahawae)引起的咖啡果疫病[23];由胶孢炭疽菌(Colletotrichum gloesporioides)引起的褐疫病[24];以及咖啡生尾孢(Cercospora coffeicola)危害咖啡浆果发病[25],引起暗红褐色、疱状病斑引起的疱斑病等。经过查询文献资料,目前国内尚无腐皮镰孢菌危害咖啡果实的报道,本研究为首次报道。
对于一种新病害,明确其生物特性,是开展监测预警及其防治的前提条件。生物学特性研究结果显示,病原菌可在13~30 ℃的环境下生长,在4 ℃以及37 ℃的环境下,病原菌不能生长;最适生长温度为28 ℃。完全光照有利于病原菌生长。最适宜CPE5生长的培养基是PDA、玉米粉琼脂培养基;病原菌对碳源甘露醇利用率最高,蔗糖和乳糖利用率最差;对氮源利用率最高的是牛肉浸膏、甘氨酸、尿素,最差的是硝酸钠和硝酸铵,但在含硝酸铵的平板上菌丝极稀薄;CPE5菌株的致死温度和致死时间分别为75 ℃和10 min。与杨静美等[26]在番木瓜上分离到的F. solani生物学特性相似。咪鲜胺锰盐、戊唑醇2种药剂对病原菌的抑制效果最好。需要注意的是,咖啡黑果可由生理、病理、虫害等多方面原因引起,本研究所鉴定的腐皮镰孢菌(F. solani)只是其中病原之一。故在生产中,首先需要明确其病因,才能有的放矢地对其进行防治。
参考文献
[1] Fábio M, DaMatta José D, Cochicho Ramalho. Impact of drought and temperature stress on coffee physiology and production: A review[J]. Brazilian Journal of Plant Physiology, 2006, 18(1): 55-81.
[2] 霍 达, 刘 杰, 王雪松, 等. 咖啡锈病的防治[J]. 中国热带农业, 2014(5): 49-52.
[3] 文志华, 毕晓菲, 鲁维艳. 中国咖啡消费趋势浅谈[J]. 农产品加工, 2018(2): 69-70.
[4] 中国电子商务研究中心. 2016年度中国电子商务市场数据监测报告[R/OL]. (2017-05-24)[2020-04-05]. http://www. 100ec.cn.
[5] 杨显刚, 杨海云, 罗恒兰, 等. 咖啡锈病对云南小粒咖啡产量和品质的影响[J]. 云南农业科技, 2019(4): 29-31.
[6] 龙亚芹, 段春芳, 刘 杰, 等. 小粒咖啡褐斑病病原菌鉴定及田间抗病性研究[J]. 西南林业大学学报(自然科学), 2017, 37(2): 152-157.
[7] Pinard F, Makune S E, Campagne P, et al. Spatial distribution of coffee wilt disease under roguing and replanting conditions: A case study from Kaweri Estate in Uganda[J]. Phytopathology, 2016, 106(11): 1291-1299.
[8] Bell C A, Aykinson H J, Andrade A C, et al. A high-throughput molecular pipeline reveals the diversity in prevalence and abundance of Pratylenchus and Meloidogyne species in coffee plantations[J]. Phytopathology, 2018, 108(5): 641-650.
[9] 白学慧, 周丽洪, 胡永亮, 等. 咖啡细菌性叶斑病病原的分离与鉴定[J]. 热带作物学报, 2013, 34(4): 738-742.
[10] 舒 梅, 山云辉. 咖啡黑果病的病因分析及防治[J]. 云南农业科技, 2002(5): 31-32.
[11] 李荣福, 王海燕, 龙亚芹. 中国小粒种咖啡病虫草害[M]. 北京: 中国农业出版社, 2015: 17-20.
[12] 王剑文, 龙乙明, 解继武. 咖啡黑果病病因的初步研究[J]. 云南热作科技, 1993(3): 33-34.
[13] White T J, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//Innis M A, Gelfand D H, Sninsky J J, et al. PCR Protocols: A guide to methods and applications. Academic Press, San Diego, 1990: 315-322.
[14] Odonnell K, Cigelnik E. Two divergent intragenomic r DNA ITS2 types within a monophyletic lineage of the fungus Fusarium are nonorthologous[J]. Molecular Phylogenetics and Evolution, 1997, 7(1): 103-116.
[15] Odonnell K, Kistler H C, Cigelnik E, et al. Multiple evolutionary origins of the fungus causing Panama disease of banana: Concordant evidence from nuclear and mitochondrial gene genealogies[J]. Proceedings of the National Academy of Sciences, 1998, 95(5): 2044-2049
[16] Odonnell K, Nirenberg H I, Aoki T, et al. A multigene phylogeny of the Gibberella fujikuroi species complex: Detection of additional phylogenetically distinct species[J]. Mycoscience, 2000, 41(1): 61-78.
[17] Morita S, Inoue S, Ohkuma M, et al. Fungal community analysis of fungus gardens in termite nests[J]. Microbes and Environment, 2005, 20(4): 243-252.
[18] 柳 鳳, 詹儒林, 韦继光, 等. 现代生物技术在镰刀菌分类学中的应用[J]. 中国农学通报, 2012, 28(30): 166-177.
[19] 林珊宇, 贤小勇, 韦小妹, 等. 广西火龙果采后病害主要病原菌分离与鉴定[J]. 中国南方果树, 2018, 47(2): 6-12.
[20] 杨 波, 郭成瑾, 王喜刚, 等. 新疆马铃薯镰刀菌根腐病发生危害调查及病原菌鉴定[J]. 西北农业学报, 2019, 28(12): 2069-2077.
[21] 张 曼, 钱 芳, 徐锦华, 等. 葫芦砧木萎蔫病病原镰刀菌鉴定及其防治药剂的筛选[J]. 植物保护, 2019, 45(5): 232-236, 258.
[22] 张贞明, 柏玉晶, 阿不满, 等. 甘肃省武威市苜蓿镰孢根腐病菌的鉴定[J]. 草业科学, 2018, 35(12): 2998-3003.
[23] Waller J M, Bridge P D, Black R, et al. Characterization of the coffee berry disease pathogen, Colletotrichum kahawae sp. nov[J]. Mycological Research, 1993, 97(8): 989-994.
[24] Sreenivasaprasad S, Brown A E, Mills P R. Coffee berry disease pathogen in Africa: Genetic structure and relationship to the group species Colletotrichum gloeosporioides[J]. Mycological Research, 1993, 97(8): 995-1000.
[25] Paula, P V A A D, Pozza E A, Santoss L A, et al. Diagrammatic scales for assessing brown eye spot (Cercospora coffeicola) in red and yellow coffee cherries[J]. Journal of Phytopathology, 2016, 164(10): 791-800.
[26] 杨静美, 陈 健, 罗金棠, 等. 番木瓜茄病镰刀菌的生物学特性研究[J]. 中国热带农业, 2011(1): 56-58.
责任编辑:谢龙莲
收稿日期 2020-05-05;修回日期 2020-06-16
基金项目 国家重点研发计划项目(No. 2018YFD0201100);中国热带农业科学院基本科研业务费专项资金项目(No. 1630042017021);FAO/IAEA合作研究项目(No. 20380)。
作者简介 朱孟烽(1995—),男,硕士研究生,研究方向:咖啡病害监测与防治。*通信作者(Corresponding author):吴伟怀(WU Weihuai),E-mail:weihuaiwu2002@163.com;易克贤(YI Kexian),E-mail:yikexian@126.com。

