孤独症谱系障碍小鼠模型行为学检测方法
王剑飞,韩俊海,张子超
孤独症谱系障碍小鼠模型行为学检测方法
王剑飞,韩俊海,张子超
东南大学生命科学与技术学院,发育与疾病相关基因教育部重点实验室,南京 210096
孤独症谱系障碍(autism spectrum disorder, ASD)是一种遗传相关的神经系统发育性疾病,患者主要呈现社交缺陷、沟通障碍、重复刻板行为和学习记忆障碍等核心症状。小鼠模型是探究孤独症谱系障碍的致病机理和寻找潜在治疗方法的重要工具,而小鼠行为学的观测和分析可以帮助人们更好地了解不同遗传操作对相应孤独症表型的影响,从而阐释疾病机理。本文列举了针对孤独症患者核心缺陷的相关小鼠行为学分析方法,包括检测社交缺陷的三厢社交实验、居住者–入侵者实验、筑巢实验和超声波检测;检测重复刻板行为的Y迷宫自主选择实验、捋毛实验、刻板行为分析实验和弹珠埋藏实验;检测焦虑行为的旷场实验、高架十字迷宫实验和明暗穿梭实验;检测学习和记忆障碍的新事物选择实验和水迷宫实验。本文详细描述了这些行为学实验的标准操作流程、注意事项以及规范的数据分析方法,可以帮助研究人员进行相关实验设计。同时本文对已知孤独症小鼠遗传模型中的各项行为学表型进行了汇总和比较,为相关研究人员提供系统参照。
孤独症谱系障碍;小鼠行为学分析;社交障碍;重复刻板;学习记忆;焦虑
孤独症谱系障碍(autism spectrum disorder, ASD)是一类发病率达1%[1]的高发儿童神经发育障碍疾病,近年来呈增长趋势,因其对家庭和社会生活的影响而引起了广泛关注。绝大多数孤独症患者具有典型的语言障碍以及重复刻板行为,运动机能低下并常伴随有严重的肌肉紧张症,在学习、交流和生活方面存在诸多障碍。此外,大部分患者会有各种并发疾病,包括智力障碍(约45%)、儿童注意力缺陷多动症(28%~44%)、抽搐性运动障碍(14%~38%)、胃肠性问题(9%~70%)、免疫失调(<38%)、焦虑(42%~56%)、沮丧(12%~70%)、强迫症状(19%~32%),以及自残行为(<50%)等[2]。
ASD的致病机理复杂,涉及遗传和环境因素等多方面因素。约有25%的患者是由遗传原因导致[3],目前研究已发现了超过102个孤独症相关基因[4]。除此以外,由于暴露在重金属、阻燃剂、杀虫剂、用于乙烯基和化妆品的邻苯二甲酸盐、以及细菌或病毒感染等环境也会导致ASD[5]。为了探究ASD的致病机理和寻找潜在的治疗方法,研究者们已经建立起了多种小鼠模型:(1)通过特定药物诱发产生ASD模型,如丙酸(PPA)模型和丙戊酸(VPA)模型;(2)直接利用行为学方法等筛选出既有典型ASD症状,如近交系 BTBR-T+tf/J和BALB/cByJ小鼠模型;(3)最重要的是利用基因改造获得的大量ASD模型,如基因敲除/敲入、和的基因敲除模型等[6]。这些基因工程小鼠模型在国内可以从上海南方模式动物中心和集萃药康等平台获取,科研人员可以从整体水平研究基因或者生化因素在ASD病理中的作用,从分子、细胞、组织和行为学不同层次进行分析,观察干预疗效,这对于阐释疾病机理和研究治疗方法至关重要。
本文汇总了针对社交行为、重复刻板行为、焦虑和学习记忆等研究常用的小鼠行为学分析方法,详细介绍了各种方法的实验原理、装置、操作以及数据记录分析等内容,并总结了已知孤独症基因工程小鼠模型中的相关行为学表型,希望为拟开展相关ASD研究人员提供实验设计和实施的具体参考。
1 材料和方法
1.1 小鼠及饲养条件
行为学实验中大多采用3~4月龄(诱导分离超声波检测为出生后的幼崽)的雄性同窝小鼠,之前没有进行过任何行为测试。小鼠均在SPF级环境下饲养于购自苏州枫桥净化公司的普通饲养笼,行为学实验需在安静的恒温封闭房间进行,行为测定要在光周期内完成。行为测试装置包括各种行为箱及配套设备和视频分析系统(SuperMaze)等可以从上海欣软公司购买。
1.2 三厢社交实验
三厢社交实验(three-chamber social test):2004年Crawley等[7]根据小鼠的群居性和社会性以及形成一定社交记忆的原理,开发出自动化的三厢社交实验,可以直接自动化的测量小鼠社交行为,并对实验结果进行标准化和高通量的分析。三厢社交实验的基础是正常小鼠具有社交能力,当面对同类时,会更愿意和同类小鼠接触,而不是单处一室;当出现陌生的同类时,正常小鼠能把它和熟悉的同伴区分开来,更多的和陌生个体接触,表现出社交新颖性。
三厢社交行为箱整体为敞口的长方体,中间被两块医用有机挡板均分为3个独立小室,每个挡板下方均有一个可控制开关的小门方便小鼠自由进出各室。左右两室的角落各有一个铁质的网格状束缚器,束缚放入其中的小鼠。实验前两天,将待测小鼠放入行为房饲养使小鼠熟悉测试环境,减少小鼠因环境差异而造成的实验误差;实验时,通常在较暗的环境中进行,行为箱内光照可以维持在40 lux,温度保持在24℃,实验人员避免出现在小鼠的视线之内,并减少噪音的产生,维持环境音量在30 dB以下,保持安静;每只小鼠实验结束用70%酒精去除行为箱内气味和异物,并用卫生纸擦拭干净。
实验分为3个阶段:(1)适应阶段:将实验小鼠背朝实验者放入行为箱的中央室,打开左右挡板的小门使其自由活动10 min,充分熟悉环境;(2)社交能力检测:10 min后将小鼠重新放至中央室,关闭左右挡板的小门并在左右两室的束缚器中随机放入一只同种相似年龄段的小鼠(stranger 1),另一个保持空置(empty),打开左右挡板的小门使其自由活动10 min并记录;(3)社交新颖性检测:10 min后将小鼠重新放至中央室,关闭左右挡板的小门,取出stranger 1再次随机放入到任一束缚器中,然后在另一束缚器中放入另一只同种相似年龄段的小鼠(stranger 2),打开左右挡板的小门使其自由活动10 min (图1)并记录。实验结束将小鼠放回饲养笼,清洗行为箱,统计实验数据。
1.3 居住者–入侵者实验
居住者–入侵者实验(resident-intruder test):同一物种成员之间的社会冲突来产生情感和心理压力,让失败者产生社交挫败,失败者会有生理和行为变化[8]。小鼠天生具有领地意识会攻击外来侵入者,研究人员发现统计实验中居住者的攻击性行为和非攻击性的社交行为可以模拟孤独症患者的暴力倾向和社交缺陷。
实验使用常规的透明饲养笼(30 cm×17 cm× 16 cm)即可检测小鼠的社交行为。实验环境与三厢社交实验相同,实验通常分为两个阶段:(1)实验前将待测鼠(居住者)和标准的非进攻鼠(入侵者:年龄相仿,体型和体重与待测小鼠相仿或略低)单独饲养一周,培养它们的领地意识。为了增强领地意识,也可以引进同窝雌鼠共同饲养;(2)实验时保持待测小鼠笼内环境不变(若有雌鼠则在实验前24 h取出),将标准的非进攻鼠作为入侵者放入,记录并统计10 min内小鼠的行为表现(图2A)并记录。实验连续4 d,每天选取同一时间实验、记录和观察。
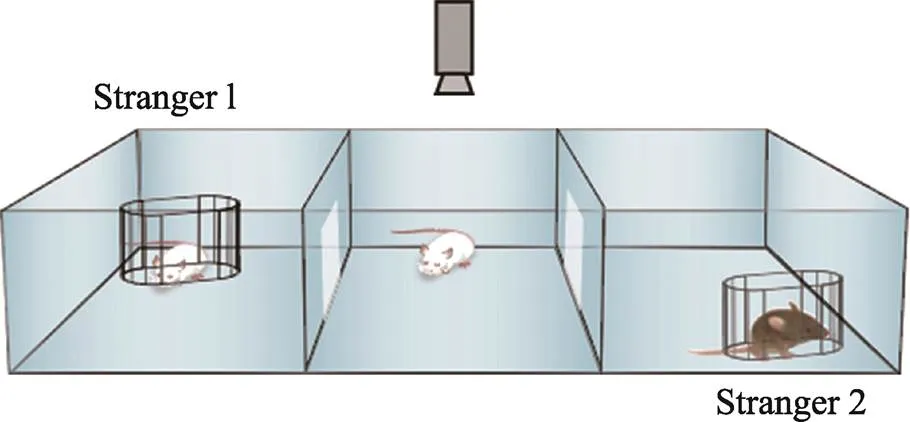
图1 三厢社交实验
1.4 筑巢实验
筑巢实验(nesting test):群居小鼠通过筑巢来保温和防御,其筑巢能力与母性行为、家庭社交行为和繁殖等因素有关,具有社会交流的性质。2006年Deacon等[9,10]在初级巢穴评级基础上(0:没有巢;1:平巢;2:巢盖住小鼠)制定了更加精细的5分巢穴评分表,广泛应用于小鼠社交行为检测。
实验在常规饲养条件下的透明饲养笼(30 cm× 17 cm×16 cm)中即可检测小鼠的社交行为。在正常的光周期(时间为7: 00~19: 00光照,19: 00~7: 00黑暗)和温湿度(温度保持在26℃,湿度保持在40%~70%)的饲养房中,下午6时将一定量的筑巢材料(片状、屑状、条状的木质和纸质材料最佳,避免使用棉质材料,防止纤维状的棉絮阻碍小鼠行动和损伤小鼠眼睛[11])放入鼠笼,并给予充足的食物与水。第二天早上7点观察筑巢结果,小鼠筑巢过程中避免实验人员进出鼠房,保持安静的环境,避免打扰小鼠筑巢。
1.5 超声波发声检测实验
超声波发声(ultrasonic vocalizations, USVs):USVs被小鼠用来传递情绪状态相关信息进行互动和交流,与小鼠社会行为密切相关。目前3种类型的USVs在实验室小鼠中得到了大量研究:幼崽隔离诱导产生的USVs、青年小鼠社会交流产生的USVs和成年小鼠社交互作产生的USVs。Premoli等[12]归纳描述了小鼠幼崽与母亲分离时发出的USVs并认为其促进了母亲和子女之间的社会交流;Panskepp等[13]发现USVs在青年小鼠中与社会互作和运动水平相关;Egnor等[14]认为成年小鼠求偶和交配时产生的USVs在社会、性行为中具有重要作用。

图2 居住者–入侵者实验
A:实验设置示意图;B:小鼠攻击性行为(上)和非攻击性社交(下)示例。
隔离诱导USVs是幼崽在与母亲分离时发出的求救叫声,代表着幼崽与母亲之间的声音交流行为,这种行为被认为与ASD有关,在ASD小鼠模型中幼崽表现出USVs释放受损或呼叫模式异常。
实验采用SONOTRACK超声波监测系统,其主要由测量箱和控制器两部分组成。测量箱可充分隔音且内层有专用隔音棉减少回声,箱内空间可以放置标准小鼠饲养笼。每个测试箱内还包含有易安装且能够收集全段超声信号的敏度麦克风、超低噪音放大器、整套LED照明设备和低噪音通风设备。控制器控制整个测量箱照明、通风以及进行实验记录,并与系统相连进行数据分析。
实验前,保持幼崽和母鼠的生活环境不变。实验时在出生后的2、4、6、8、12日将幼崽从母鼠身边分离,放置在测量箱内一个直径5 cm、高度10 cm的空塑料容器中;测量幼崽的体温,并保持测量箱内温度恒定为21℃;将麦克风通过测量箱盖中的小孔固定安装,离幼崽上方约20 cm,记录并统计5 min内幼崽发出的USVs;录音结束后,再次测量幼崽的体温,实验前后应保持幼崽体温一致,避免因寒冷导致记录的USVs差异;实验结束后利用70%的酒精擦洗测量箱,并开始下一组实验[15]。
求偶则是成年小鼠社交互动的一种表现形式,雄鼠在面对成年雌鼠或其气味时会释放大量的USVs,吸引雌鼠注意并增加求偶的成功率[16]。社交缺陷会影响雄鼠在求偶过程中的USVs释放,在ASD小鼠模型中,雄鼠会表现出USVs释放受损或呼叫模式异常。
实验同样采用SONOTRACK超声波监测系统,实验前将待测的雄鼠在单独的饲养笼中隔离饲养5 d,并将其放置在行为房熟悉环境;实验当天检查相同基因型的陌生雌鼠的阴道,选取发情期的雌鼠为引入对象;实验时将饲养笼放置入测量箱,固定麦克风距雄鼠上方约20 cm,然后将发情的雌鼠引入被隔离的雄鼠饲养笼,记录并统计5 min内雄鼠发出的USVs;实验结束后利用70%的酒精擦洗测量箱,并开始下一组实验。
1.6 Y-迷宫自发选择实验
Y-迷宫自主选择实验(Y maze spontaneous selection test):依据小鼠具有探索新环境的天性,1976年Olten等[17]开发了Y迷宫用于测量大鼠的特殊学习和记忆能力。在ASD模型中,小鼠如果认定环境和事物后很难做出改变就被认为具有重复刻板的偏执性行为[18]。
Y-迷宫由3条等长的支臂(35 cm×5 cm×15 cm)和一个连接区组成,每两条臂之间的夹角均为120°,3条臂交汇处的连接区有可供打开的小门,方便小鼠自由进出。
实验前预处理和实验环境与三厢社交实验相同。实验时:(1)先任选一条臂作为起始臂,将小鼠背对实验者面向迷宫中心轻轻放入,打开门,当小鼠选择进入一条臂的时候,关闭门,使小鼠在其中自由活动5 min,并将小鼠进入的臂记作目标臂,另一条臂记作非目标臂[19];(2)将小鼠重新放入起始臂,打开门,记录小鼠进入的臂;(3)重复(2)中操作20次,记录并统计小鼠进入目标臂和非目标臂的次数(图3)。
1.7 捋毛实验
捋毛实验 (grooming):小鼠具有梳理毛发的天性,在梳理行为中,Berridge和Bursten等[20,21]首先揭示了小鼠复杂的固定梳理动作模式,并在一种松鼠()中,将其仪式化为一种刻板的展示,随后梳理毛发作为反应重复刻板行为的指标广泛适用于孤独症小鼠模型中。常见的捋毛动作包括前肢梳理、摩擦清洗颜面、身体腹侧、尾部和生殖器清理(图4,A~C)等。

图3 Y-迷宫自主选择实验
实验使用常规的饲养笼即可检测小鼠的重复刻板行为。实验前预处理和实验环境与三厢社交实验相同。实验时小鼠置于30×17×16 cm干净透明的饲养笼中,给与充足的食物和水让其自由探索10 min;10 min后打开摄像头,记录30 min内小鼠在笼子里自由活动数据。每次试验之间,用70%的乙醇清洗开阔的场地。
1.8 其他刻板行为分析实验
刻板行为分析(stereotyped behavior analysis test):刻板行为被认为是孤独症谱系障碍的核心症状之一。具体的刻板行为表征最早是从Kanner[22]描述的11名儿童开始为人所知,而在ASD小鼠模型中也观察到一系列刻板行为检测,包括高水平的转圈、空翻、后肢站立、垂直跳跃、重复的前肢运动、咀嚼垫料或无意义咀嚼、摇头和嗅探同一位置等[23]。
实验前预处理和实验环境与三厢社交实验相同。实验时将小鼠置于30 cm×17 cm×16 cm干净透明的饲养笼中,铺上垫料并给与充足的食物和水让其自由探索10 min;10 min后打开摄像头,记录30 min内小鼠在笼子里自由活动数据。每次试验之间,用70%的乙醇清洗开阔的场地。
1.9 弹珠埋藏实验
弹珠埋藏实验(marble-burying tests):挖掘和掩埋是小鼠的一种典型行为,实验最初用于评估啮齿类动物的焦虑行为,但2009年Thomas等[24,25]更偏向于其为测量重复性或强迫性挖掘行为的测试,并可以定量地检测ASD小鼠模型中重复刻板行为。
实验前预处理和实验环境与三厢社交实验相同。实验时将新鲜无味的垫料加入到崭新的饲养笼中(30 cm×17 cm×16 cm),深度为5 cm,并将垫料压平压实;将标准玻璃弹珠(各种款式和颜色,直径约为2 cm,重量约为5 g),按5排每排4弹珠等距离地轻放在垫料上(图5);打开摄像头,记录30 min内小鼠的运动情况。每次实验之间,更换鼠笼和垫料,并用温和的洗涤剂清洗弹珠,蒸馏水彻底冲洗,使用前晾干。
1.10 旷场实验
旷场实验(open field test):将动物置于一个被周围墙壁阻止逃跑的未知环境,是一种被广泛应用的类焦虑行为模型,起初为了评估动物情绪而开发,随后也被Archer等[26,27]用于检测动物的行为运动能力。旷场实验中,小鼠具有畏惧空旷场地而进行躲避的天性,而另一方面又会对空旷中心产生探究的好奇心理,两者冲突从而引发焦虑。
实验使用旷场行为箱检测小鼠自发活动行为,探索行为和焦虑。行为箱整体为40 cm×40 cm×40 cm敞口的正方体,实验前预处理和实验环境与三厢社交实验相同。实验时将小鼠背朝实验人员放入行为箱(图6A)的正中心,让其自由探索10 min;10 min后打开摄像头,记录10 min内小鼠在行为箱内自由活动数据(图6B),每次试验之间,用70%的乙醇清洗行为箱。

图4 小鼠捋毛行为
A:清洗颜面;B:清理前肢;C:尾部清理。
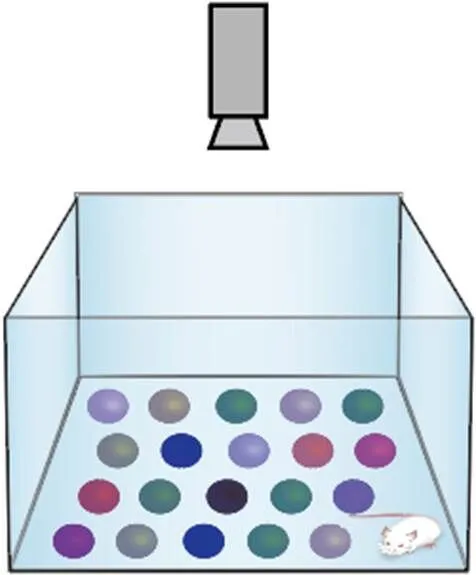
图5 弹珠埋藏实验
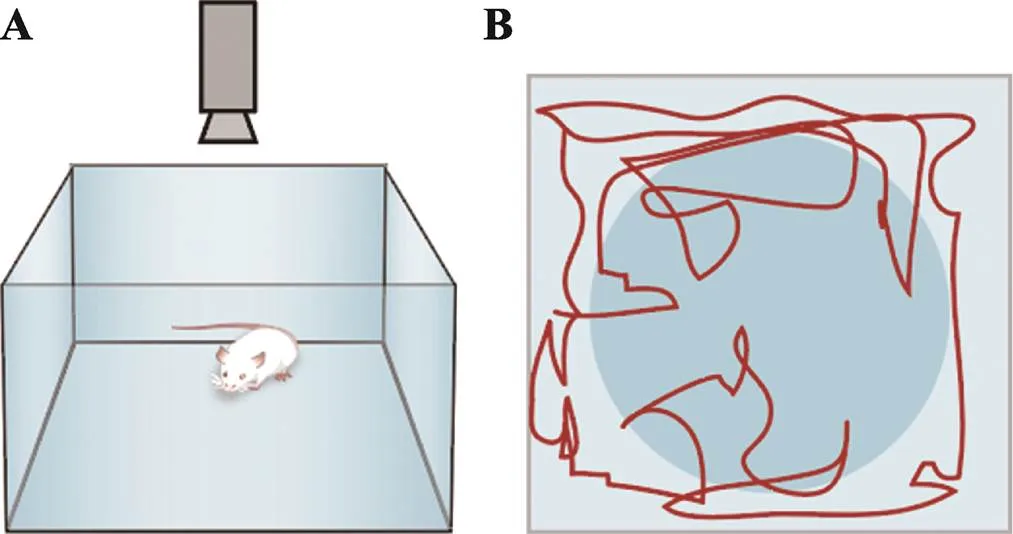
图6 旷场实验
A:行为箱;B:行为箱俯视观测图(中间蓝色圆圈是人为划定的中央区,红色曲线为小鼠运动轨迹)。
1.11 高架十字迷宫实验
高架十字迷宫实验(the elevated plus maze test):小鼠具有恐高的天性,对高处天然趋避,但对新环境又有探索的好奇心。1958年Montgomery等发现暴露在高架的迷宫通道中所引发的这种探究–趋避冲突,比暴露在封闭的旷场中所引发的焦虑冲突要强烈得多,基于此设计出开放和封闭区域不均一的高架Y-迷宫实验;1985年Pellow等[28]利用等长的开放和封闭臂优化成高架十字迷宫检测小鼠的焦虑行为。
整个高架十字迷宫由两条等长的臂(35 cm× 5 cm)十字交叉组成,其中一条臂的四周有不透明的挡板围住,称为闭臂(35 cm×5 cm×15 cm);另一条周围无挡板的臂称为开臂;两臂交叉的无挡板部分称为中央区(5 cm×5 cm)。整个迷宫离地约60 cm,给小鼠营造一个恐惧的环境。
实验前预处理和实验环境与三厢社交实验相同。实验时将小鼠背朝实验者,面向开臂放在高架十字迷宫(图7)的中央区,用摄像头记录小鼠5 min内的行为数据,然后将小鼠取回放入饲养笼,更换实验小鼠,面向同一开臂放入迷宫。每次试验之间,用70%的乙醇清洗迷宫,若小鼠在迷宫中长时间无运动或从迷宫坠落,则不计入最后的分析。
1.12 明暗穿梭实验
明暗穿梭实验(light/dark transition test):基于小鼠对明亮照明区域的自然厌恶,以及对新环境的自发探索行为,2006年Takao[29]等利用人为控制的明暗环境优化设计出明暗穿梭实验,用于检测小鼠的类焦虑行为。
明暗行为箱(27cm×27 cm×45 cm)由大小相同的明箱和暗箱组成,箱体顶部加盖,内部固定有高清摄像机记录小鼠活动数据,明箱内有亮光照明,两箱之间的隔墙有一个可控制的门洞(7.5 cm×7.5 cm)供小鼠穿梭。
实验前预处理和实验环境与三厢社交实验相同。实验时首先打开明暗箱内的发光二极管,明箱中由白色二极管(390 Lux)明亮地照亮,而暗箱中则是黑色二极管(2 Lux)照射;将小鼠置于暗箱中,当红外摄像头检测到小鼠3 s后控制开门(防止小鼠在释放后立即进入光室,并有逃离实验的动机);记录10 min内小鼠的活动情况,并在下一组实验前用70%的乙醇清洗行为箱。
1.13 新事物识别实验
新事物识别实验(novel-object recognition test):1988年由Enaceur和Delacour等[30]引入,目的是评估大鼠在熟悉环境中识别新物体的能力。从那时起,这项测试就开始流行起来,用于测试啮齿类动物的认知记忆。小鼠先天对新物体有探索倾向并通过对新物体(形状、大小等)的灵活变换可检测小鼠短期记忆和认知能力。

图7 高架十字迷宫实验
新事物识别行为箱为上方敞口、四周透明的40 cm×40 cm×40 cm正方体,也可用旷场行为箱替代。实验前五天,每天抚摸实验小鼠1 min,避免刺激小鼠,使其消除与测试者的陌生感,实验前两天将小鼠放入行为房熟悉环境。实验环境与三厢社交实验相同,实验分为3个阶段:(1)将小鼠放入行为箱自由活动5 min,然后将小鼠移出行为箱并在行为箱侧壁7 cm左右的位置水平放置两个形状、大小以及颜色均相同的物体(直径约3 cm);(2)将小鼠背对物体重新放入行为箱中央后打开摄像头记录其10 min内小鼠的活动(图 8A);(3)将小鼠放回饲养笼,并将行为箱内一个物体随机替换为另一个大小相似但形状和颜色不同的新物体,1 h后将小鼠重新背对物品放入行为箱记录10 min的活动(图 8B)。
1.14 水迷宫实验
水迷宫实验(Morris water maze test):小鼠天生厌水,在水中会选择最佳的路线逃离水环境。根据此特性1981年Morris通过强迫实验动物游泳设计出水迷宫实验,并迅速成为评估空间记忆和空间导航的标准任务。通过观测小鼠在逃亡过程中是否能利用周围环境进行定位寻找隐藏在水中的逃生平台来检验小鼠的空间参考记忆能力。小鼠搜寻并登上平台所用的时间越短,小鼠的学习和记忆能力也就越强[31]。
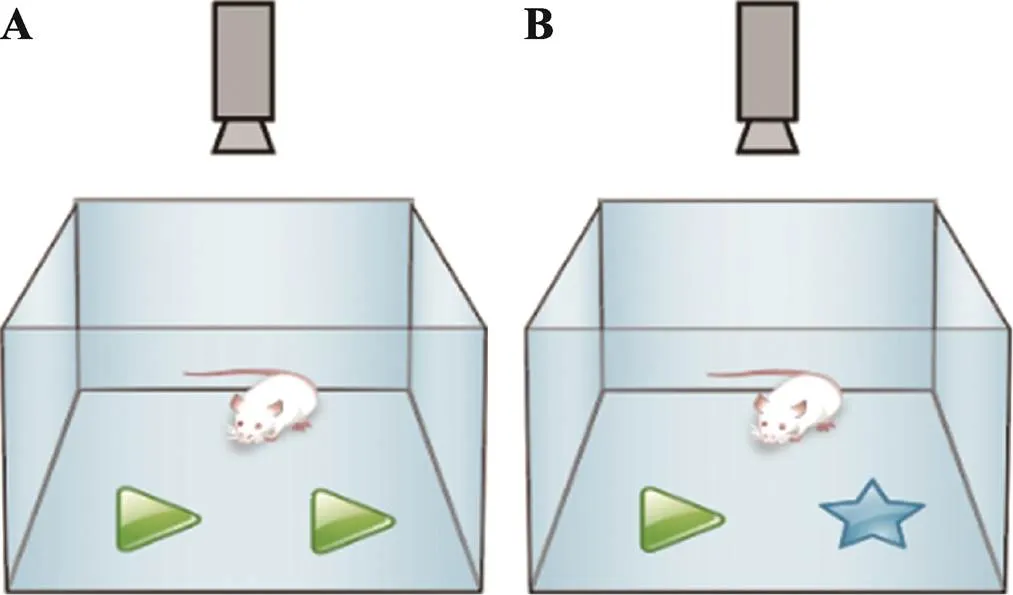
图8 新事物识别实验
A:事物认知;B:新事物识别。
水迷宫行为箱整体为直径110 cm、高95 cm敞口的圆柱体,通过在地上划线将箱内人为等分为4个区域(Q1~Q4),并在Q2内通过支架固定一个直径约8 cm的逃生平台,每个区域箱壁等高的位置固定1个形状不同的标记物(高逃生平台约20 cm,如三角形、圆形、正方形和五角星等),作为逃生平台的空间参考,并在正下方设置人为的入水口,将小鼠放入行为箱中。
小鼠放在行为房中饲养两天,使其熟悉实验环境。实验前先灌水入迷宫中,直到其刚淹没逃生平台为止,同时保持室温和水温在24℃左右,并根据小鼠体色选择高对比度的试剂将水变浑浊(如棕色或黑色鼠可用牛奶),一方面阻挡小鼠的视线,隐藏水下的逃生平台,另一方面确保SuperMaze系统能够准确捕捉到小鼠的踪迹(图9A)。整个实验为3个阶段:(1)记忆获取。将小鼠以半随机方式选择入水口,背对实验人员面朝池壁放入迷宫中,记录小鼠60 s内在迷宫内的运动情况。若小鼠在60 s内搜寻并登上平台,让其在平台停留30 s以便根据4个入水口上的固定参照物对平台位置进行空间学习和记忆(图9B),并判定小鼠逃亡成功;若小鼠在60 s内不能搜寻并登上平台,则用手将其引导至平台并停留30 s也让其对平台位置进行学习和记忆,同时判定该小鼠逃亡成功。每天每只小鼠实验4次,每次间隔15~25 min,确保每只实验小鼠分别从4个入水口放入,防止小鼠采用非记忆性的策略进行逃生;实验连续进行7 d,每天实验起始时间应相同,确保小鼠对平台位置的记忆获取。在每次水迷宫实验结束后,实验者应注意立即用毛巾或者吹风机将小鼠毛发晾干,避免小鼠因为着凉而影响接下来的实验;(2)记忆巩固。7 d的训练结束后将小鼠放回鼠笼,进行24 h的记忆巩固;(3)记忆提取。24 h后去除迷宫内的逃生平台,在原逃生平台的对侧象限入水口放入小鼠,记录60 s内小鼠运动状况,检测小鼠学习和记忆能力。
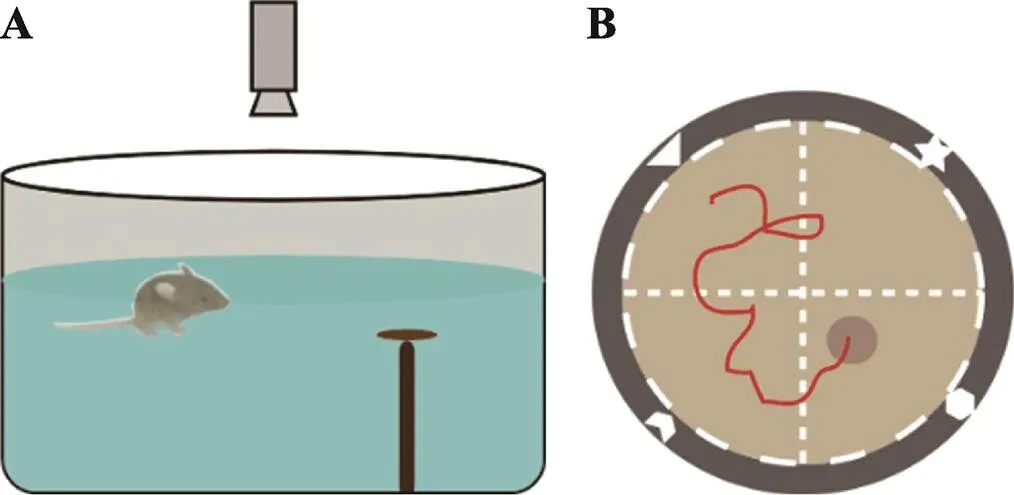
图9 水迷宫实验
A:水迷宫装置正视图;B:水迷宫俯视图(棕色标注出隐藏在水面下的逃生平台,红色为小鼠运动轨迹)。
2 实验数据分析
2.1 ASD小鼠社交行为分析
社交障碍是孤独症谱系障碍核心缺陷之一,患者在社会认知、社交互动、眼神接触、理解和使用非言语沟通等方面存在困难[32]。研究中通常利用三厢社交实验、居住者–侵入者实验、筑巢实验和超声波发声检测这几种方法来对小鼠模型进行社交行为评估。
在三厢社交实验中,通过摄像头实时跟踪、记录小鼠的行为轨迹,用SuperMaze分析软件统计小鼠的社交信息。(1)社交能力检测:统计小鼠在empty室所待的总时间TE(鼠身进入一半即开始计时,离开即停止计时),以及和stranger1的接触总时间TS(小鼠嗅探实验鼠即开始计时,离开即停止计时); (2)社交新颖性检测:统计小鼠和stranger1以及 stranger2的接触总时间TS1和TS2(计算方法如(1)中所示)。若TE≥TS表明有严重的社交能力缺陷;若TS1≥TS2则表明有严重的社交新奇性缺陷。孤独症小鼠模型通常社交新颖性能力明显缺失,并伴随有一定程度的社交能力障碍。在Fmr1ASD小鼠模型中,Naviaux等[33]发现Fmr1小鼠接触时间TE≈TS、TS2 在居住者–入侵者实验中,用摄像头记录4 d内待测小鼠和侵入者之间的攻击性(aggressivity behaviors)[34]和非攻击性行为(non-aggressive behaviors)的社交行为时间。非攻击性的行为包括追逐、尾随、前肢搭趴、捋毛、鼻–鼻互触或鼻–下体接触等[35],而攻击性行为包括受试小鼠主动撕咬/抓/怒视入侵小鼠等(图2B)。非攻击性行为(NS)减少或者攻击性行为(NA)增加,表明受试小鼠存在社交缺陷。在NL3ASD小鼠模型中,Burrows等[36]发现NL3小鼠攻击性行为增加2倍,非攻击性社交行为无明显差异,检测出明显的社交缺陷。 在筑巢实验中,根据巢穴评分系统(nesting score system, NSS)[37](图10)对巢穴进行评分(S),评分系统粗分为5大类:(1) 0分,小鼠未扰乱或使用筑巢材料;(2) 1分,小鼠扰乱材料但未将其聚集成巢位,材料只是简单堆积;(3) 2分,小鼠聚集材料形成平坦巢穴,巢体外观呈浅碟状,巢壁不完全或缺;(4) 3分,材料被聚集形成杯状巢穴,巢壁为可辨识的杯状或碗状:(5) 4分,材料被聚集形成不完全的圆顶巢穴,巢壁汇合超过半球体;(6) 5分,材料被聚集形成完整的圆顶巢穴,巢体四周或顶部只存在一个可容纳一只小鼠进出的进出口。评分越低小鼠的社交行为缺陷越严重。在ASD小鼠模型中,Orefice等[9]发现小鼠筑巢得分显著减少,检测出明显的社交缺陷。 图10 小鼠筑巢评分图 母子隔离诱导USVs实验中,可以直接根据SONOTRACK系统统计出生后2、4、6、8和12天时的如下数据:(1)幼崽在5 min内发出叫声的总数目(NU);(2)幼崽在5 min内发出叫声的总持续时间(TU);(3)根据Chabout等[38]在2012年将小鼠USVs划分成10种类型:短音(≤50 ms且≤10 kHz)、平音(≥50 ms且≤10 kHz)、单次跳频音(瞬时的一个频率改变)、多次跳频音(多次的频率改变)、U型音(U型波且≥10 kHz)、V型音(倒U型波且≥10 kHz)、调制音(几个频率的降低或增加且≥10 kHz)、复合音(同时释放或多个频率且≥10 kHz)、上行音(频率逐渐上升且≥10 kHz)和下行音(频率逐渐下降且≥10 kHz),统计幼崽在5 min内发音的复杂度(Cu),每种发声类型的总数目(NTU)和总持续时间(TTU)。NU和TU降低,则表明幼崽存在沟通障碍,有明显的社交缺陷;Cu降低、NTU和TTU与正常幼崽相比有明显的异常表达模式,也表明幼崽存在着社交缺陷。 成年小鼠求偶诱导USVs实验中,同样根据系统直接统计:(1)雄鼠在5 min内发出叫声的总数目(NU1);(2)雄鼠在5 min内发出叫声的总持续时间(TU1)。NU1和TU1降低,则表明雄鼠存在社交缺陷。在Cntnap2ASD小鼠模型中,Brunner等[39]和Penagarikano等[40]发现Cntnap2幼崽和成年雄鼠USVs数目下降约1倍,检测出明显的社交缺陷。 重复刻板行为是孤独症谱系障碍的核心缺陷之一,具体表现为刻板行为、强迫行为、自伤行为、仪式化行为、同一性行为和狭窄兴趣[41]。在小鼠模型中通常用Y-迷宫自发选择、捋毛实验、刻板行为分析和弹珠埋藏这几种方法来模拟重复刻板行为[35]。 在Y-迷宫自发选择实验中,根据小鼠进入相同目标臂的次数比例来表征重复刻板行为的程度。记录小鼠在试验总次数(NT)中进入目标臂的次数(NA)比例R (R= NA/NT),R值越高,表示小鼠的重复刻板行为越严重。在RIM32ASD小鼠模型中,Zhu等[35]发现RIM32小鼠R值约为WT鼠的1.3倍,检测出明显的刻板重复行为。 在捋毛实验中,用摄像头记录30 min内小鼠的行为,人为统计小鼠梳理毛发所用的时间(TG)占总时间的比例,比例越高则刻板重复行为越严重。在ASD小鼠模型中,Peça等[42]发现小鼠捋毛时间约为WT鼠的1.7倍,检测出明显的刻板重复行为。 在刻板行为分析实验中,用摄像头记录30 min内小鼠的行为,统计所观察到的各项刻板动作的次数、时间及其总次数(Nc)和时间(Tc)作为评估刻板运动的指标,统计的次数越多时间越长则表明重复刻板行为越严重。在C58/J ASD小鼠模型中,Moy等[43]发现C58/J小鼠相较于正常品系小鼠旋转、空翻和垂直跳跃增加约4倍,后肢站立增加约2倍,检测出明显的刻板行为。 在弹珠埋藏实验中,人为统计30 min内小鼠埋藏弹珠的数目(埋藏深度为70%及以上,Nb)和小鼠挖掘垫料的时间(Td),埋藏数目和挖掘时间增加则刻板重复行为越严重。在ASD小鼠模型中,Gkogkas等[44]发现小鼠埋藏弹珠的数目约为WT的2倍,检测出明显的刻板重复行为。 焦虑是一种心理生物学的情绪状态或反应,包括不愉快的紧张感、担忧和神经系统的自主激活,是ASD患者中常见的表型。小鼠模型中主要通过将动物暴露于自然的、潜在的致焦虑性情况来引起相应行为反应来检测其焦虑水平[45],有旷场实验、高架十字迷宫实验和明暗穿梭实验等。 在旷场实验中,利用SuperMaze系统统计和分析不同的观察指标:(1)优先统计在行为箱中小鼠10 min (T)内活动的总路程(Dt),根据时间计算小鼠的平均速度V (V=Dt/T)。检测小鼠的自发运动能力[46],避免运动能力的缺陷影响实验结果;(2)在电脑的SuperMaze软件上根据人为划分的中央区(中央直径约32 cm的圆)和周边区(圆外区域) (图6B),统计小鼠在中央区运动的距离(Dc)以及在中央区所待的时间(Tc),计算出小鼠在中央区运动的距离占总距离的比例Rd (Rd=Dc/Dt)或者在中央区运动时间占总时间的比例Rt (Rt=Tc/T),比较小鼠Rd或者Rt,数值越小的小鼠焦虑程度越高。 在高架十字迷宫实验中,同样通过SuperMaze系统统计和分析不同的观察指标:(1)小鼠的平均速度。判断小鼠的自发运动能力;(2)计算出小鼠在开臂运动时间(TO)占总时间(T)的比例Rto(Rto=TO/T);(3)小鼠在开臂中运动的总距离(DO),计算出小鼠在开臂运动的距离占总距离的比例(Rdo= DO/Dt)。Rto、Rdo越小,小鼠的焦虑程度越高[47]。在Arid1bASD小鼠模型中,Jung等[48]发现Arid1b小鼠在中央区运动的时间和距离相比WT鼠减少了约3倍,在开臂运动的时间相比WT鼠减少了约4倍,检测出明显的焦虑。 在明暗穿梭实验中,利用记录的数据统计10 min内小鼠箱室的转换次数(Nl)和在明箱中所待的总时间(Tl),Nl和Tl降低,则表明小鼠焦虑程度较高。在Cadm1ASD小鼠模型中,Takayanagi等[49]发现Cadm1小鼠在明箱中呆的时间相较于WT降低了约8倍,表现出明显的焦虑。 学习和记忆障碍也是孤独症患者常见的缺陷之一,其具体表现为大多数患者学习能力较差,记忆能力比如复杂的视觉和语言信息记忆、空间参考记忆、联想学习能力、语言工作记忆和识别记忆存在严重问题[50]。在小鼠模型中较为常见的是用新事物识别实验和水迷宫实验来检测认知记忆和参考记忆。 在新事物识别实验中,根据录像统计小鼠在步骤(3)中10 min内探索新事物的时间(TN)和熟悉事物的时间(TF),探索时间包括鼻子或嘴接触物体和小鼠距离物体2~3 cm范围内探究的时间(前爪搭在物体上、鼻子嗅物体、舔物体等均属探究物体,摆个架势或爬到物体上不动不能算是对物体的探究)。若TN与TF相比无明显差异,即小鼠无法区分新旧事物,则意味着小鼠的记忆存在障碍。在Arid1bASD小鼠模型中,Jung等[48]发现Arid1b小鼠探索新事物的时间TN与TF相比无明显差异,检测出明显的记忆能力缺失。 在水迷宫实验中,通过SuperMaze软件在记忆获取阶段统计:(1)根据小鼠的运动距离和时间统计出小鼠的自发运动能力,首先排除小鼠自发运动能力对实验结果产生的影响;(2)记录小鼠从入水到登上逃生平台所用时间作为潜伏期(TL)。若小鼠60 s内无法自己登上逃生平台,则潜伏期记作60 s。潜伏期越长表明受试小鼠的记忆获取能力越差。记忆提取阶段需用SuperMaze软件捕捉并记录小鼠的运动轨迹和统计小鼠经过原隐藏平台位置的次数。运动轨迹杂乱无章,路过平台次数(NT)显著降低表明受试小鼠记忆提取能力越差,表明小鼠空间参考记忆有严重缺陷。 在Arid1bASD小鼠模型中,Jung等[48]发现Arid1b小鼠探索新事物的时间TN与TF相比无明显差异;潜伏期时间明显增加,约是WT鼠的3~4倍且记忆提取时路过平台次数显著减少,检测出明显的学习和记忆能力障碍[48]。 因为小鼠胆小怕惊,对环境变化敏感,为了确保行为学实验结果的可靠性,需要遵循一些严格的要求:(1)温度稳定在22℃~25℃之间,噪音低于30 dB;(2)实验组数量与对照组相似不低于10只,若是单只小鼠的重复实验分析则不低于10次; (3)实验均采用雄鼠,避免雌鼠发情期和体内激素的干扰;(4)多采用2~6个月小鼠,年龄过大或过小的小鼠运动能力有所缺陷,并有证据证明小鼠的焦虑会随年龄的升高而增加[51];(5)小鼠在暗阶段最为活跃且内源性激素差异不大,所以行为学分析实验应该遵循小鼠的光周期;(6)实验前两天将小鼠放置实验地点熟悉环境,实验前对小鼠的处理应保持一致;(7)长期的社会隔离会导致小鼠的社交行为、学习记忆能力和焦虑的改变[52],小鼠饲养保持每笼4~5只;(8)凡是涉及到人工统计数需双盲。 虽然小鼠模型经济成本、时间成本、技术条件、同源性和行为学观察总体评估最优,是国内外研究ASD致病机理最普遍的动物模型,但还有很多需要完善和解决的问题。一方面是啮齿类动物和人类在社会行为和大脑解剖方面有明显的进化差异,这些行为和解剖学差异已经成为关于啮齿动物模型在研究孤独症方面的争论问题[53]。另外,ASD患者已经被证实患有大量的并发症,比如睡眠、感知觉异常和肌肉张力问题等。在行为学实验中,我们也可以利用睡眠剥夺[54]、刺激奖赏[55]、步态检测和丝网测试[56,57]来检测实验小鼠是否存在ASD相关的并发症。 小鼠的行为学方法广泛应用于各种孤独症谱系障碍基因工程小鼠模型中,不同的小鼠模型在社交缺陷、重复刻板、焦虑以及学习和记忆障碍等行为上具有相似的表型,但也存在明显的差异。表1~ 表3分别总结了已有孤独症基因工程小鼠模型在社交和重复刻板行为以及焦虑和学习记忆行为测试中的表型,这些行为差异可能与其遗传病理相关。 表1 ASD小鼠模型社交行为检测 TE、TS表示小鼠在空室、含同类小鼠的室所待的时间;TS1、TS2表示小鼠与熟悉小鼠、陌生小鼠所待的时间;NA、NS表示小鼠攻击性行为、非攻击性社交行为的次数;S表示小鼠筑巢得分数;NU、TU表示单位时间内母子分离后幼崽发出的超声波数目和持续时间;Cu表示幼崽超声波发声的种类;NU1表示成年小鼠求偶发出的超声波数目;↑表示数目增加;↓表示数目减少。 表2 ASD小鼠重复刻板行为检测 TG表示小鼠的捋毛时间;R表示小鼠未发生选择改变的比例;Nc表示小鼠的刻板行为的次数统计;↑表示数目增加;↓表示数目减少;Nb表示小鼠单位时间内埋藏弹珠的数目。 表3 ASD小鼠焦虑、学习记忆行为检测 续表 Rt表示小鼠在中央区运动的时间占总时间的比例;Rto表示小鼠在开臂运动的时间占总时间的比例;Nl、Tl表示小鼠进入明箱的次数、时间;TN、TF表示小鼠对新事物、旧事物探索的时间;TL、NT表示小鼠潜伏期时间、记忆提取时路过目标平台附近的次数。 近些年行为学检测方法在不断成熟与完善,实验趋向低损伤、操作更加简单、统计更快捷以及得到的实验数据更加可靠。同时行为学实验分析系统也不断得到改进,例如Noldus的EthoVision分析软件,通过接收视频信号,对每一帧进行数字化,并分析生成的像素来确定被跟踪动物的位置(以及其他数据)。在行为学实验中可以获得动物在特定区域的运动路程、运动轨迹、站立次数、时间、速度和进入该区域的频次等,使得行为学的实验统计结果包含更多信息[102]。 行为学方法的引入为实验室研究ASD的致病机理提供了多元化方向:(1)根据已经报导的ASD相关基因,结合基因工程的技术在动物模型上进行基因的编辑,根据行为学实验结果,判断是否有ASD样行为,然后对该基因的上下游进行分析,寻找完整的分子环路。(2)利用反义核酸等技术,在一定时间内临时阻断某个特定基因的表达并根据行为学的实验数据,快速并直观的筛选出与ASD相关的基因,并可与相应的遗传工程动物模型进行比较,同时也促进了动物学、分子生物学以及遗传学的交叉和结合[103]。(3)以膜片钳技术与动物行为学实验相结合,通过在特定脑区注射相应的病毒,人为控制特定基因的表达,并根据行为学实验结果,采用离体脑片的膜片钳记录电位的传递并通过免疫染色技术构建出相关细胞的形态和类型,在分子、细胞和神经环路的水平上阐述ASD的致病机理。 行为学方法的引入也极大促进了ASD临床治疗的研究,ASD动物模型产生的行为学数据是神经精神药物开发的基石,采用动物行为学进行ASD药物的研发与检测具有更全面、可靠和准确的特点,在国际科学界受到广泛应用。熟练的掌握这这些行为学检测方法,有助于阐释ASD致病机理和寻找治疗方法的研究。 [1] Mattila ML, Kielinen M, Linna SL, Jussila K, Ebeling H, Bloigu R, Joseph RM, Moilanen I. Autism spectrum disorders according to DSM-IV-TR and comparison with DSM-5 draft criteria: an epidemiological study., 2011, 50(6): 583– 592. [2] Lai MC, Lombardo MV, Baron-Cohen S. Autism., 2014, 383(9920): 896–910. [3] Sanders SJ, He X, Willsey AJ, Ercan-Sencicek AG, Samocha KE, Cicek AE, Murtha MT, Bal VH, Bishop SL, Dong S, Goldberg AP, Jinlu C, Keaney JR, Klei L, Mandell JD, Moreno-De-Luca D, Poultney CS, Robinson EB, Smith L, Solli-Nowlan T, Su MY, Teran NA, Walker MF, Werling DM, Beaudet AL, Cantor RM, Fombonne E, Geschwind DH, Grice DE, Lord C, Lowe JK, Mane SM, Martin DM, Morrow EM, Talkowski ME, Sutcliffe JS, Walsh CA, Yu TW, Ledbetter DH, Martin CL, Cook EH, Buxbaum JD, Daly MJ, Devlin B, Roeder K, State MW. Insights into autism spectrum disorder genomic architecture and biology from 71 risk loci., 2015, 87(6): 1215–1233. [4] Satterstrom FK, Kosmicki JA, Wang J, Breen MS, De Rubeis S, An JY, Peng M, Collins R, Grove J, Klei L, Stevens C, Reichert J, Mulhern MS, Artomov M, Gerges S, Sheppard B, Xu X, Bhaduri A, Norman U, Brand H, Schwartz G, Nguyen R, Guerrero EE, Dias C, Betancur C, Cook EH, Gallagher L, Gill M, Sutcliffe JS, Thurm A, Zwick ME, Borglum AD, State MW, Cicek AE, Talkowski ME, Cutler DJ, Devlin B, Sanders SJ, Roeder K, Daly MJ, Buxbaum JD. Large-scale exome sequencing study implicates both developmental and functional changes in the neurobiology of autism., 2020, 180(3): 568–584. [5] Berg R. Autism--an environmental health issue after all?., 2009, 71(10): 14–18. [6] Zhou RY, Dang WL, Zhou Z, Li HW, Zhang X. Advances in research of animal models of autism spectrum disorders., 2019, 27( 3): 380–386周荣易, 党伟利, 周正, 李华伟, 张晰. 孤独症谱系障碍动物模型研究进展. 中国实验动物学报, 2019, 27(3): 380–386. [7] Crawley JN. Mouse behavioral assays relevant to the symptoms of autism., 2007, 17(4): 448– 459. [8] Hollis F, Kabbaj M. Social defeat as an animal model for depression., 2014, 55(2): 221–232. [9] Orefice LL, Zimmerman AL, Chirila AM, Sleboda SJ, Head JP, Ginty DD. Peripheral mechanosensory neuron dysfunction underlies tactile and behavioral deficits in mouse models of ASDs., 2016, 166(2): 299–313. [10] Deacon RM. Assessing nest building in mice., 2006, 1(3): 1117–1119. [11] Ravizza SM, Solomon M, Ivry RB, Carter CS. Restricted and repetitive behaviors in autism spectrum disorders: the relationship of attention and motor deficits., 2013, 25(3): 773–784. [12] Premoli M, Memo M, Bonini SA. Ultrasonic vocalizations in mice: relevance for ethologic and neurodevelopmental disorders studies., 2021, 16(6): 1158–1167. [13] Panksepp JB, Lahvis GP. Social reward among juvenile mice., 2007, 6(7): 661–671. [14] Egnor SR, Seagraves KM. The contribution of ultrasonic vocalizations to mouse courtship., 2016, 38: 1–5. [15] Peñagarikano O, Lázaro MT, Lu XH, Gordon A, Dong H, Lam HA, Peles E, Maidment NT, Murphy NP, Yang XW, Golshani P, Geschwind DH. Exogenous and evoked oxytocin restores social behavior in the Cntnap2 mouse model of autism., 2015, 7(271): 271r–278r. [16] Zala SM, Reitschmidt D, Noll A, Balazs P, Penn DJ. Sex-dependent modulation of ultrasonic vocalizations in house mice (Mus musculus musculus)., 2017, 12(12): e188647. [17] Yan T, He B, Wan S, Xu M, Yang H, Xiao F, Bi K, Jia Y. Antidepressant-like effects and cognitive enhancement of Schisandra chinensis in chronic unpredictable mild stress mice and its related mechanism., 2017, 7(1): 6903. [18] Hoeffer CA, Tang W, Wong H, Santillan A, Patterson RJ, Martinez LA, Tejada-Simon MV, Paylor R, Hamilton SL, Klann E. Removal of FKBP12 enhances mTOR- Raptor interactions, LTP, memory, and perseverative/ repetitive behavior., 2008, 60(5): 832–845. [19] Ru M, Liu H. Association between Y-maze acquisition learning and major histocompatibility complex class ii polymorphisms in mice., 2018, 2018: 6381932. [20] Berridge KC, Aldridge JW, Houchard KR, Zhuang XX. Sequential super-stereotypy of an instinctive fixed action pattern in hyper-dopaminergic mutant mice: a model of obsessive compulsive disorder and Tourette's., 2005, 3: 4. [21] Bursten SN, Berridge KC, Owings DH. Do California ground squirrels (Spermophilus beecheyi) use ritualized syntactic cephalocaudal grooming as an agonistic signal?., 2000, 114(3): 281–290. [22] Kanner L. The conception of wholes and parts in early infantile autism., 1951, 108(1): 23–26. [23] Ellegood J, Crawley JN. Behavioral and neuroanatomical phenotypes in mouse models of autism., 2015, 12(3): 521–533. [24] Simmons DH, Titley HK, Hansel C, Mason P. Behavioral tests for mouse models of autism: an argument for the inclusion of cerebellum-controlled motor behaviors., 2020, S0306-4522(20): 30304. [25] Thomas A, Burant A, Bui N, Graham D, Yuva-Paylor LA, Paylor R. Marble burying reflects a repetitive and perseverative behavior more than novelty-induced anxiety., 2009, 204(2): 361–373. [26] Markowska AL, Stone WS, Ingram DK, Reynolds J, Gold PE, Conti LH, Pontecorvo MJ, Wenk GL, Olton DS. Individual differences in aging: behavioral and neurobiological correlates., 1989, 10(1): 31–43. [27] Rodgers RJ. Animal models of 'anxiety': where next?., 1997, 8(6–7): 477–496, 497–504. [28] Pellow S, Chopin P, File SE, Briley M. Validation of open: closed arm entries in an elevated plus-maze as a measure of anxiety in the rat., 1985, 14(3): 149–167. [29] Takao K, Miyakawa T. Light/dark transition test for mice., 2006, (1): 104. [30] Ennaceur A, Delacour J. A new one-trial test for neurobiological studies of memory in rats. 1: Behavioral data., 1988, 31(1): 47–59. [31] Tomas PI, Burwell RD. Using the spatial learning index to evaluate performance on the water maze., 2015, 129(4): 533–539. [32] Wang SS, Yan Y, Zhao YS. Interventions for social skills in autism spectrum disorders: a meta-analysis of effects and influencing factors., 2019, (10): 43–51. 汪斯斯, 闫燕, 赵勇帅. 自闭症谱系障碍群体社交技能的干预: 效果及其影响因素的元分析. 中国特殊教育, 2019, (10): 43–51. [33] Naviaux JC, Wang L, Li K, Bright AT, Alaynick WA, Williams KR, Powell SB, Naviaux RK. Antipurinergic therapy corrects the autism-like features in the Fragile X (Fmr1 knockout) mouse model., 2015, 6: 1. [34] Han S, Tai C, Westenbroek RE, Yu FH, Cheah CS, Potter GB, Rubenstein JL, Scheuer T, de la Iglesia HO, Catterall WA. Autistic-like behaviour in Scn1a+/– mice and rescue by enhanced GABA-mediated neurotransmission., 2012, 489(7416): 385–390. [35] Zhu JW. TRIM32 deficiency leads to autistic behaviors in mice[Dissertation]. Southern Medical University, 2016. 朱健伟. TRIM32的缺失导致小鼠自闭症样行为的实验研究[学位论文]. 南方医科大学, 2016. [36] Burrows EL, Laskaris L, Koyama L, Churilov L, Bornstein JC, Hill-Yardin EL, Hannan AJ. A neuroligin-3 mutation implicated in autism causes abnormal aggression and increases repetitive behavior in mice., 2015, 6: 62. [37] Hess SE, Rohr S, Dufour BD, Gaskill BN, Pajor EA, Garner JP. Home improvement: C57BL/6J mice given more naturalistic nesting materials build better nests., 2008, 47(6): 25–31. [38] Chabout J, Serreau P, Ey E, Bellier L, Aubin T, Bourgeron T, Granon S. Adult male mice emit context- specific ultrasonic vocalizations that are modulated by prior isolation or group rearing environment., 2012, 7(1): e29401. [39] Brunner D, Kabitzke P, He D, Cox K, Thiede L, Hanania T, Sabath E, Alexandrov V, Saxe M, Peles E, Mills A, Spooren W, Ghosh A, Feliciano P, Benedetti M, Luo CA, Biemans B. Comprehensive analysis of the 16p11. 2 deletion and null cntnap2 mouse models of autism spectrum disorder.. 2015, 10(8): e134572. [40] Peñagarikano O, Abrahams BS, Herman EI, Winden KD, Gdalyahu A, Dong H, Sonnenblick LI, Gruver R, Almajano J, Bragin A, Golshani P, Trachtenberg JT, Peles E, Geschwind DH. Absence of CNTNAP2 leads to epilepsy, neuronal migration abnormalities, and core autism-related deficits., 2011, 147(1): 235–246. [41] Ning N, Zhang YS, Yang GX. A review of the researches into restricted and repetitive behaviors of children with autism spectrum disorder., 2015, (2): 46–52. 宁宁, 张永盛, 杨广学. 自闭症谱系障碍儿童重复刻板行为研究综述. 中国特殊教育, 2015, (2): 46–52. [42] Peça J, Feliciano C, Ting JT, Wang W, Wells MF, Venkatraman TN, Lascola CD, Fu Z, Feng G. Shank3 mutant mice display autistic-like behaviours and striatal dysfunction., 2011, 472(7344): 437–442. [43] Moy SS, Riddick NV, Nikolova VD, Teng BL, Agster KL, Nonneman RJ, Young NB, Baker LK, Nadler JJ, Bodfish JW. Repetitive behavior profile and supersensitivity to amphetamine in the C58/J mouse model of autism., 2014, 259: 200–214. [44] Gkogkas CG, Khoutorsky A, Ran I, Rampakakis E, Nevarko T, Weatherill DB, Vasuta C, Yee S, Truitt M, Dallaire P, Major F, Lasko P, Ruggero D, Nader K, Lacaille JC, Sonenberg N. Autism-related deficits via dysregulated eIF4E-dependent translational control., 2013, 493(7432): 371–377. [45] Steimer T. Animal models of anxiety disorders in rats and mice: some conceptual issues., 2011, 13(4): 495–506. [46] Walz K, Spencer C, Kaasik K, Lee CC, Lupski JR, Paylor R. Behavioral characterization of mouse models for Smith-Magenis syndrome and dup(17)(p11. 2p11. 2)., 2004, 13(4): 367–378. [47] Seo JH. Treadmill exercise alleviates stress-induced anxiety-like behaviors in rats., 2018, 14(5): 724–730. [48] Jung EM, Moffat JJ, Liu J, Dravid SM, Gurumurthy CB, Kim WY. Arid1b haploinsufficiency disrupts cortical interneuron development and mouse behavior., 2017, 20(12): 1694–1707. [49] Takayanagi Y, Fujita E, Yu Z, Yamagata T, Momoi MY, Momoi T, Onaka T. Impairment of social and emotional behaviors in Cadm1-knockout mice., 2010, 396(3): 703–708. [50] Williams DL, Goldstein G, Minshew NJ. The profile of memory function in children with autism., 2006, 20(1): 21–29. [51] Shoji H, Miyakawa T. Age-related behavioral changes from young to old age in male mice of a C57BL/6J strain maintained under a genetic stability program., 2019, 39(2): 100–118. [52] Han RT, Kim YB, Park EH, Kim JY, Ryu C, Kim HY, Lee J, Pahk K, Shanyu C, Kim H, Back SK, Kim HJ, Kim YI, Na HS. Long-term isolation elicits depression and anxiety-related behaviors by reducing oxytocin- induced GABAergic transmission in central amygdala., 2018, 11: 246. [53] Zhao H, Jiang YH, Zhang YQ. Modeling autism in non-human primates: opportunities and challenges., 2018, 11(5): 686–694. [54] Thomas AM, Schwartz MD, Saxe MD, Kilduff TS. Cntnap2 knockout rats and mice exhibit epileptiform activity and abnormal sleep-wake physiology., 2017, 40(1). [55] Chen Q, Deister CA, Gao X, Guo BL, Lynn-Jones T, Chen NY, Wells MF, Liu RP, Goard MJ, Dimidschstein J, Feng SJ, Shi YW, Liao WP, Lu ZH, Fishell G, Moore CI, Feng GP. Dysfunction of cortical GABAergic neurons leads to sensory hyper-reactivity in a Shank3 mouse model of ASD., 2020, 23(4): 520–532. [56] Burket JA, Young CM, Green TL, Benson AD, Deutsch SI. Characterization of gait and olfactory behaviors in the Balb/c mouse model of autism spectrum disorders., 2016, 122: 29–34. [57] Roemers P, Hulst Y, van Heijningen S, van Dijk G, van Heuvelen MJG, De Deyn PP, van der Zee EA. Inducing physical inactivity in mice: preventing climbing and reducing cage size negatively affect physical fitness and body composition., 2019, 13: 221. [58] Garg SK, Lioy DT, Cheval H, Mcgann JC, Bissonnette JM, Murtha MJ, Foust KD, Kaspar BK, Bird A, Mandel G. Systemic delivery of MeCP2 rescues behavioral and cellular deficits in female mouse models of Rett syndrome.. 2013, 33(34): 13612–13620. [59] Orefice LL, Zimmerman AL, Chirila AM, Sleboda SJ, Head JP, Ginty DD. Peripheral mechanosensory neuron dysfunction underlies tactile and behavioral deficits in mouse models of ASDs., 2016, 166(2): 299–313. [60] Yoo J, Bakes J, Bradley C, Collingridge GL, Kaang BK. Shank mutant mice as an animal model of autism.2013, 369(1633): 20130143. [61] Won H, Lee HR, Gee HY, Mah W, Kim JI, Lee J, Ha S, Chung C, Jung ES, Cho YS, Park SG, Lee JS, Lee K, Kim D, Bae YC, Kaang BK, Lee MG, Kim E. Autistic-like social behaviour in Shank2-mutant mice improved by restoring NMDA receptor function., 2012, 486(7402): 261–265. [62] Wang X, Mccoy PA, Rodriguiz RM, Pan Y, Je HS, Roberts AC, Kim CJ, Berrios J, Colvin JS, Bousquet-Moore D, Lorenzo I, Wu G, Weinberg RJ, Ehlers MD, Philpot BD, Beaudet AL, Wetsel WC, Jiang YH. Synaptic dysfunction and abnormal behaviors in mice lacking major isoforms of Shank3., 2011, 20(15): 3093–3108. [63] Jaramillo TC, Speed HE, Xuan Z, Reimers JM, Escamilla CO, Weaver TP, Liu S, Filonova I, Powell CM. Novel shank3 mutant exhibits behaviors with face validity for autism and altered striatal and hippocampal function., 2017, 10(1): 42–65. [64] Jaramillo TC, Xuan Z, Reimers JM, Escamilla CO, Liu S, Powell CM. Early restoration of Shank3 Expression in shank3 knock-out mice prevents core ASD-like behavioral phenotypes., 2020, 7(3). [65] Peca J, Feliciano C, Ting JT, Wang WT, Wells MF, Venkatraman TN, Lascola CD, Fu ZY, Feng GP. Shank3 mutant mice display autistic-like behaviours and striatal dysfunction., 2011, 472(7344): 437–442. [66] Reynolds CD, Nolan SO, Jefferson T, Lugo JN. Sex-specific and genotype-specific differences in vocalization development in FMR1 knockout mice., 2016, 27(18): 1331–1335. [67] Rotschafer SE, Trujillo MS, Dansie LE, Ethell IM, Razak KA. Minocycline treatment reverses ultrasonic vocalization production deficit in a mouse model of Fragile X Syndrome., 2012, 1439: 7–14. [68] Spencer CM, Alekseyenko O, Serysheva E, Yuva- Paylor LA, Paylor R. Altered anxiety-related and social behaviors in the Fmr1 knockout mouse model of fragile X syndrome., 2005, 4(7): 420–430. [69] Delorey TM, Sahbaie P, Hashemi E, Homanics GE, Clark JD. Gabrb3 gene deficient mice exhibit impaired social and exploratory behaviors, deficits in non-selective attention and hypoplasia of cerebellar vermal lobules: a potential model of autism spectrum disorder., 2008, 187(2): 207–220. [70] Celen C, Chuang JC, Luo X, Nijem N, Walker AK, Chen F, Zhang SY, Chung AS, Nguyen LH, Nassour I, Budhipramono A, Sun XX, Bok LA, Mcentagart M, Gevers EF, Birnbaum SG, Eisch AJ, Powell CM, Ge WP, Santen GW, Chahrour M, Zhu H. Arid1b haploinsufficient mice reveal neuropsychiatric phenotypes and reversible causes of growth impairment., 2017, 6: e25730. [71] Wei HG, Wang M, Lv N, Yang H, Zhao M, Huang B, Li RS. Increased repetitive self-grooming occurs in Pax2 mutant mice generated using CRISPR/Cas9., 2020, 393: 112803. [72] Nakajima R, Takao K, Hattori S, Shoji H, Komiyama NH, Grant SGN, Miyakawa T. Comprehensive behavioral analysis of heterozygous Syngap1 knockout mice., 2019, 39(3): 223–237. [73] Penagarikano O, Abrahams BS, Herman EI, Winden KD, Gdalyahu A, Dong H, Sonnenblick LI, Gruver R, Almajano J, Bragin A, Golshani P, Trachtenberg JT, Peles E, Geschwind DH. Absence of CNTNAP2 leads to epilepsy, neuronal migration abnormalities, and core autism-related deficits., 2011, 147(1): 235–246. [74] Hulbert SW, Wang XM, Gbadegesin SO, Xu Q, Xu X, Jiang YH. A novel Chd8 mutant mouse displays altered ultrasonic vocalizations and enhanced motor coordination., 2020, 13(10): 1685–1697. [75] Jung H, Park H, Choi Y, Kang H, Lee E, Kweon H, Roh JD, Ellegood J, Choi W, Kang J, Rhim I, Choi SY, Bae M, Kim SG, Lee J, Chung C, Yoo T, Park H, Kim Y, Ha S, Um SM, Mo S, Kwon Y, Mah W, Bae YC, Kim H, Lerch JP, Paik SB, Kim E. Sexually dimorphic behavior, neuronal activity, and gene expression in Chd8-mutant mice., 2018, 21(9): 1218–1228. [76] Shih PY, Hsieh BY, Lin MH, Huang TN, Tsai CY, Pong WL, Lee SP, Hsueh YP. CTTNBP2 controls synaptic expression of zinc-related autism-associated proteins and regulates synapse formation and autism-like behaviors., 2020, 31(9): 107700. [77] Yoo T, Kim SG, Yang SH, Kim H, Kim E, Kim SY. A DLG2 deficiency in mice leads to reduced sociability and increased repetitive behavior accompanied by aberrant synaptic transmission in the dorsal striatum., 2020, 11(1): 19. [78] Gilbert J, O'Connor M, Templet S, Moghaddam M, Di Via IA, Sinclair A, Zhu LQ, Xu W, Man HY. Nexmif/ Kidlia knock-out mouse demonstrates autism-like behaviors, memory deficits, and impairments in synapse formation and function., 2020, 40(1): 237–254. [79] Armstrong EC, Caruso A, Servadio M, Andreae LC, Trezza V, Scattoni ML, Fernandes C. Assessing the developmental trajectory of mouse models of neurodevelopmental disorders: Social and communication deficits in mice with Neurexin 1alpha deletion., 2020, 19(4): e12630. [80] Etherton MR, Blaiss CA, Powell CM, Sudhof TC. Mouse neurexin-1alpha deletion causes correlated electrophysiological and behavioral changes consistent with cognitive impairments., 2009, 106(42): 17998–18003. [81] Burrows EL, Laskaris L, Koyama L, Churilov L, Bornstein JC, Hill-Yardin EL, Hannan AJ. A neuroligin-3 mutation implicated in autism causes abnormal aggression and increases repetitive behavior in mice., 2015, 6: 62. [82] Cao W, Lin S, Xia QQ, Du YL, Yang Q, Zhang MY, Lu YQ, Xu J, Duan SM, Xia J, Feng G, Xu J, Luo JH. Gamma oscillation dysfunction in mpfc leads to social deficits in neuroligin 3 R451C knockin mice., 2018, 97(6): 1253–1260. [83] El-Kordi A, Winkler D, Hammerschmidt K, Kästner A, Krueger D, Ronnenberg A, Ritter C, Jatho J, Radyushkin K, Bourgeron T, Fischer J, Brose N, Ehrenreich H. Development of an autism severity score for mice using Nlgn4 null mutants as a construct-valid model of heritable monogenic autism., 2013, 251: 41–49. [84] Blundell J, Blaiss CA, Etherton MR, Espinosa F, Tabuchi K, Walz C, Bolliger MF, Sudhof TC, Powell CM. Neuroligin-1 deletion results in impaired spatial memory and increased repetitive behavior., 2010, 30(6): 2115–2129. [85] Nakanishi M, Nomura J, Ji X, Tamada K, Arai T, Takahashi E, Bućan M, Takumi T. Functional significance of rare neuroligin 1 variants found in autism., 2017, 13(8): e1006940. [86] Clipperton-Allen AE, Page DT. Pten haploinsufficient mice show broad brain overgrowth but selective impairments in autism-relevant behavioral tests., 2014, 23(13): 3490–3505. [87] Cupolillo D, Hoxha E, Faralli A, De Luca A, Rossi F, Tempia F, Carulli D. Autistic-Like Traits and Cerebellar Dysfunction in Purkinje Cell PTEN Knock-Out Mice., 2016, 41(6): 1457–1466. [88] Ehninger D, Han S, Shilyansky C, Zhou Y, Li W, Kwiatkowski DJ, Ramesh V, Silva AJ. Reversal of learning deficits in a Tsc2+/– mouse model of tuberous sclerosis., 2008, 14(8): 843–848. [89] Tsai PT, Rudolph S, Guo C, Ellegood J, Gibson JM, Schaeffer SM, Mogavero J, Lerch JP, Regehr W, Sahin M. Sensitive Periods for cerebellar-mediated autistic- like behaviors., 2018, 25(2): 357–367. [90] Zheng F, Kasper LH, Bedford DC, Lerach S, Teubner BJ, Brindle PK. Mutation of the CH1 domain in the histone acetyltransferase crebbp results in autism-relevant behaviors in mice., 2016, 11(1): e146366. [91] Cheh MA, Millonig JH, Roselli LM, Ming X, Jacobsen E, Kamdar S, Wagner GC. En2 knockout mice display neurobehavioral and neurochemical alterations relevant to autism spectrum disorder., 2006, 1116(1): 166–176. [92] Silverman JL, Yang M, Lord C, Crawley JN. Behavioural phenotyping assays for mouse models of autism., 2010, 11(7): 490–502. [93] Bowers JM, Konopka G. ASD-relevant animal models of the foxp family of transcription factors., 2012, (Suppl.) 1(10): 10082. [94] Medvedeva VP, Rieger MA, Vieth B, Mombereau C, Ziegenhain C, Ghosh T, Cressant A, Enard W, Granon S, Dougherty JD, Groszer M. Altered social behavior in mice carrying a cortical Foxp2 deletion., 2019, 28(5): 701–717. [95] Nakatani J, Tamada K, Hatanaka F, Ise S, Ohta H, Inoue K, Tomonaga S, Watanabe Y, Chung YJ, Banerjee R, Iwamoto K, Kato T, Okazawa M, Yamauchi K, Tanda K, Takao K, Miyakawa T, Bradley A, Takumi T. Abnormal behavior in a chromosome-engineered mouse model for human 15q11-13 duplication seen in autism., 2009, 137(7): 1235–1246. [96] Lacaria M, Spencer C, Gu W, Paylor R, Lupski JR. Enriched rearing improves behavioral responses of an animal model for CNV-based autistic-like traits., 2012, 21(14): 3083–3096. [97] Molina J, Carmona-Mora P, Chrast J, Krall PM, Canales CP, Lupski JR, Reymond A, Walz K. Abnormal social behaviors and altered gene expression rates in a mouse model for Potocki-Lupski syndrome., 2008, 17(16): 2486–2495. [98] Katayama Y, Nishiyama M, Shoji H, Ohkawa Y, Kawamura A, Sato T, Suyama M, Takumi T, Miyakawa T, Nakayama KI. CHD8 haploinsufficiency results in autistic-like phenotypes in mice., 2016, 537(7622): 675–679. [99] Meyza KZ, Defensor EB, Jensen AL, Corley MJ, Pearson BL, Pobbe RL, Bolivar VJ, Blanchard DC, Blanchard RJ. The BTBR T+ tf/J mouse model for autism spectrum disorders-in search of biomarkers., 2013, 251: 25–34. [100] Brodkin ES. BALB/c mice: low sociability and other phenotypes that may be relevant to autism., 2007, 176(1): 53–65. [101] Ryan BC, Young NB, Crawley JN, Bodfish JW, Moy SS. Social deficits, stereotypy and early emergence of repetitive behavior in the C58/J inbred mouse strain., 2010, 208(1): 178–188. [102] Sun XP, Wang Q, Shi Z, Chen SG, Liu X. Review and prospect of experiment methodology on animal behavior., 2018, 28(3): 1–7. 孙秀萍, 王琼, 石哲, 陈善广, 刘新民. 动物行为实验方法学研究的回顾与展望. 中国比较医学杂志, 2018, 28(3): 1–7. [103] Jin JM. The application of ethology in modern life science research laboratory., 2008, 28(1): 1–3. 金玫蕾. 动物行为学在现代生命科学研究中的应用. 实验动物与比较医学, 2008, 28(1): 1–3. Behavioral analyses in mouse models of autism spectrum disorders Jianfei Wang, Junhai Han, Zichao Zhang Autism spectrum disorder is a group of genetically-related developmental disorders of the nervous system. Patients mainly present with core symptoms such as social behavior defects, repetitive stereotyped behaviors, and learning and memory disorders. The mouse models are critical for the studies of the pathogenic mechanisms and potential therapeutic strategies of autism spectrum disorder. The assessments of mouse behaviors provide understandings of the effects of different genetic manipulations as well as pathogenic mechanisms of these diseases. This article describes various mouse behavioral assays corresponding to the core symptoms of ASD patients and provides a detailed description of protocols, cautions, and data analysis for those assays, thereby helping researchers to establish their own experimental designs. In addition, behavioral phenotypes of currently known ASD mouse models are summarized to provide a reference for researchers in the field. autism spectrum disorder; mouse behavioral analysis; social disorder; repetitive behavior; learning and memory; anxiety 2020-11-18; 2021-02-08 国家自然科学基金项目(编号:31871374,81730034)和江苏省自然科学基金项目(编号:BK20170080)资助[Supported by the National Natural Science Foundation of China (Nos. 31871374, 81730034), and the Natural Science Foundation of Jiangsu Province (No. BK20170080)] 王剑飞,在读硕士研究生,专业方向:孤独症致病机制。E-mail: w13912971049@163.com 张子超,博士,副研究员,研究方向:分子神经生物学。E-mail: zhangzc@seu.edu.cn 10.16288/j.yczz.20-391 2021/3/22 15:20:40 URI: https://kns.cnki.net/kcms/detail/11.1913.R.20210319.1153.002.html (责任编委: 许琪)
2.2 ASD小鼠重复刻板行为分析
2.3 ASD小鼠焦虑行为分析
2.4 ASD小鼠学习记忆行为分析
3 应用
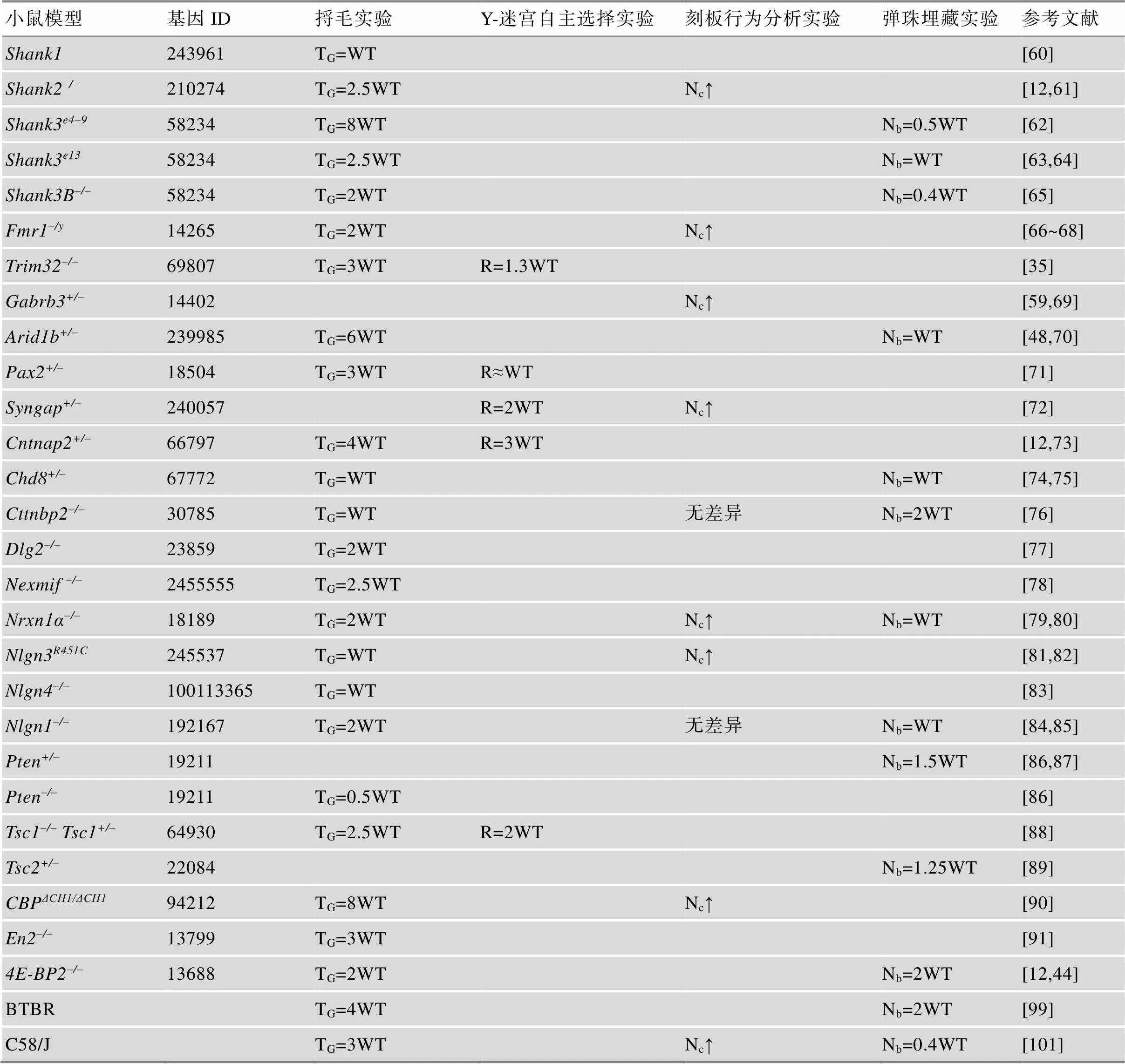
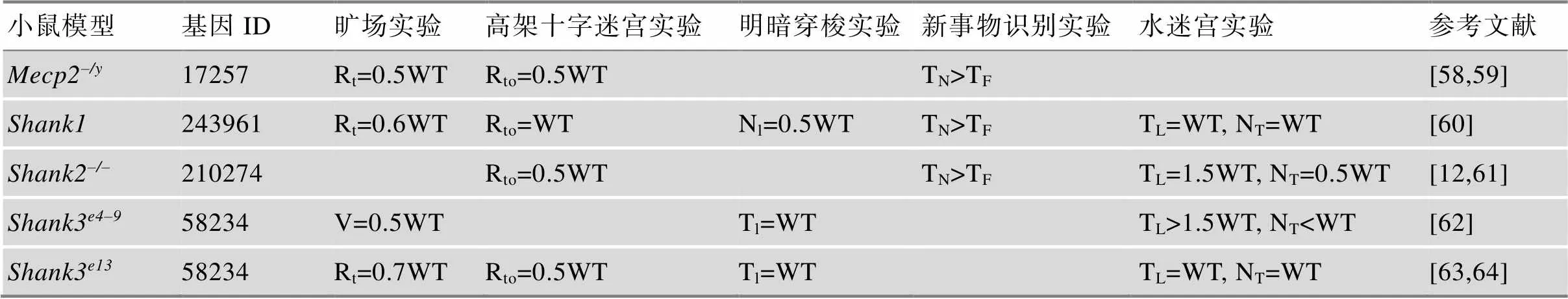
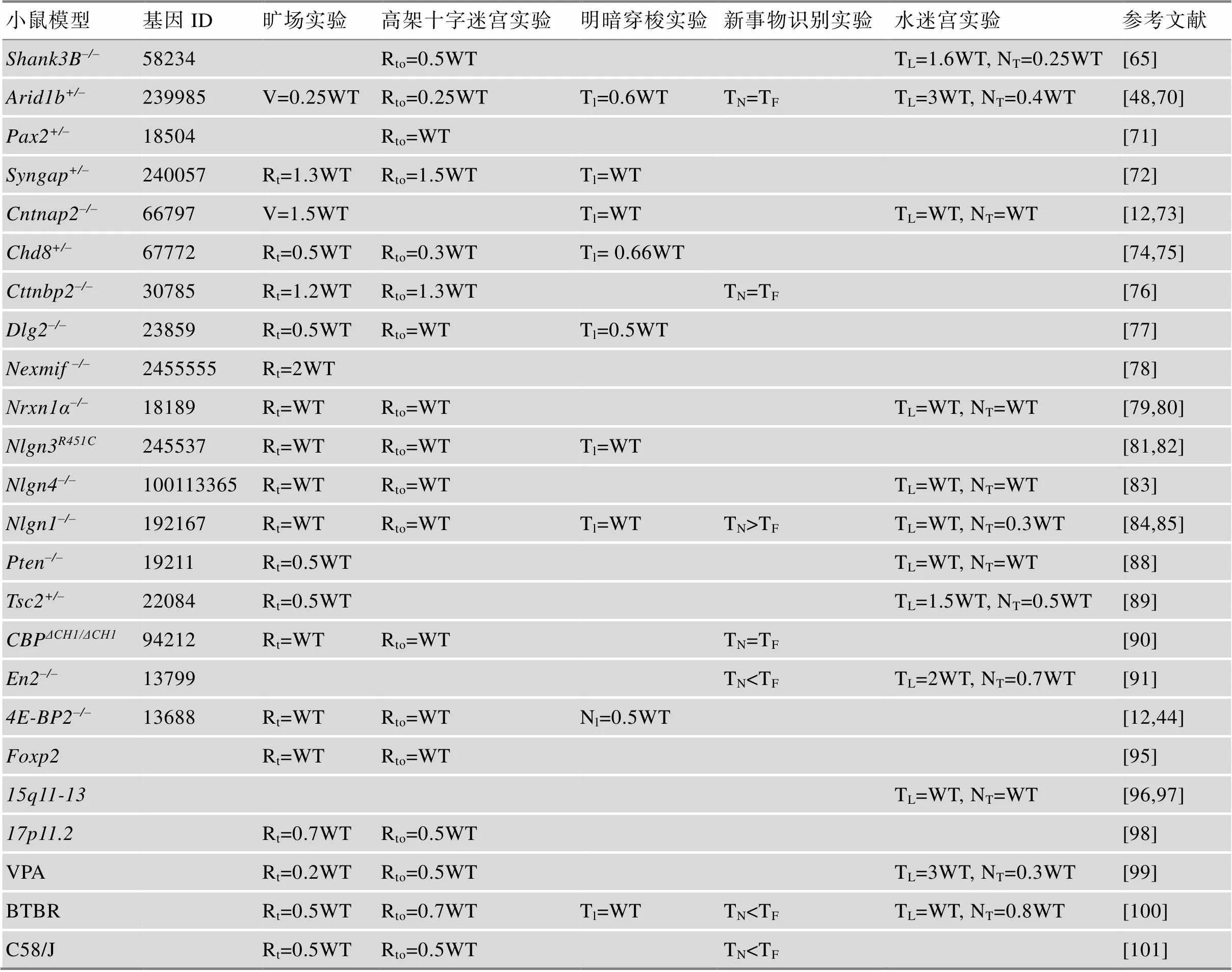
3.1 孤独症谱系障碍基因工程小鼠模型行为学表型总结

3.2 孤独症谱系障碍小鼠行为学检测方法应用前景

