玉米转录因子ZmbZIP77基因克隆及表达分析
邹华文,郭凯,张莹莹,侯留迪,朱叶青,胡蓉蓉,周开明,张丙林,刘卫娟
长江大学农学院,湖北 荆州434025
碱性亮氨酸拉链(Basic Leucine Zipper,bZIP)转录因子家族是真核生物中分布最广泛、结构最保守的一类基因家族[1]。bZIP蛋白含有60~80个氨基酸残基[2],这些残基组成了一个碱性区域和一个亮氨酸拉链结构。碱性区域含有一个不变的N-x7-R/K基序;亮氨酸拉链区由一个或多个重复区域组成[3]。
在植物中,bZIP转录因子家族行使多种功能,包括参与种子发育、病菌防御、维管发育、光信号传导、组织和器官分化以及非生物胁迫响应等多种生理进程[4-6]。在拟南芥中,转MdbZIP48基因的拟南芥种子发芽率、子叶绿化率、根长均高于野生型[7]。CRAWFORD等[8]研究发现,胡椒在受到病虫害的侵袭时,CAbZIP1转录因子起着重要的调控作用。MITSUTOMO等[9]研究结果显示,bZIP转录因子FD能够促进植物开花,FD同开花关键基因FT互作,进而调控下游与花原基分化相关基因的表达。Lu[10]等研究发现,水稻bZIP家族中的成员OsbZIP12和OsbZIP72的表达受ABA的诱导和调控。拟南芥AtbZIP29基因通过调控根尖分生组织细胞中细胞壁的形成来影响根的生长发育[11]。过量表达刚毛怪柳ThbZIP1基因的拟南芥,其耐旱性和耐盐性都显著高于野生型[12]。过量表达玉米ZmbZIP72基因的拟南芥,其耐旱性和耐盐性显著增强[13]。转OsbZIP23基因显著提高水稻的耐旱性[14],表明OsbZIP23基因在水稻对抗非生物胁迫的过程中起到了重要作用。相对于其他作物而言,碱性亮氨酸拉链蛋白在拟南芥和水稻中的作用研究较为深入,但在玉米中的作用研究相对较少。
在前期工作中,笔者对干旱处理下不同耐旱性的玉米材料进行转录组测序,结果发现编号为GRMZM2G066734的序列在所有玉米材料中都表达。在干旱敏感材料中,该基因在干旱处理下的表达量是正常处理下的7.9倍;在耐旱材料中,该基因在干旱处理下的表达量是正常处理下的13.6倍,提示其可能在干旱信号传导过程中起到重要作用[15]。将GRMZM2G066734序列片段在MazieGDB中进行比对,得到ZmbZIP77基因序列。研究中,笔者克隆了玉米ZmbZIP77基因,并且对该基因进行生物信息学分析,同时运用实时荧光定量PCR技术分析该基因在玉米不同组织及不同逆境条件下的表达特征,以期为下一步深入研究ZmbZIP77生物学功能提供基础依据。
1 材料与方法
1.1 试验材料及处理
研究所用玉米材料为B73自交系,由长江大学玉米逆境分子生物学实验室保存。选取大小一致的玉米种子,用1%次氯酸钠消毒5min,蒸馏水冲洗3次,置于28℃培养箱中催芽。选取长势一致的种子,放入1/4 Hoagland培养液中培养,每周更换2次培养液,培养至三叶一心期进行处理。用20% PEG6000替换培养液模拟干旱处理,用0.2mol/L NaCl溶液替换培养液模拟盐胁迫处理,对照组均为正常培养,分别处理48h后取样;将植株置于42℃光照培养箱模拟高温处理,对照组为正常温度培养,处理4h后取样;对叶面均匀喷施0.1mol/L 的脱落酸(ABA)进行处理,对照组喷施蒸馏水,每隔12h喷洒1次,共4次。分别取各个处理后植株的根部和正常处理植株的根、叶和胚芽鞘,液氮速冻后保存于-80℃超低温冰箱中。每个处理设置3个重复。
1.2 玉米总RNA的提取及cDNA的合成以及基因克隆
以正常培养条件下的玉米根为材料,进行总RNA的提取。总RNA提取参照宝日医生物技术(北京)有限公司TRIzol试剂产品说明进行。残留DNA的去除以及cDNA合成参照全式金公司试剂盒(TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix)说明进行。cDNA测定浓度后保存于-20℃待用。
利用Primer 5.0 分别设计引物(见表1),通过实时荧光定量PCR方法获得ZmbZIP77基因片段。PCR体系为10μL:cDNA0.5μL,ddH2O 1.3μL,2× buffer 5.0μL,dNTP(2.5mmol/L) 2.0μL,上下游引物(10μmol/L)各0.5μL,Taq 酶(5U/μL)0.2μL。 PCR反应条件:94℃ 2min,98℃ 10s,62℃ 30s,68℃ 1min,35个循环,68℃ 4min。
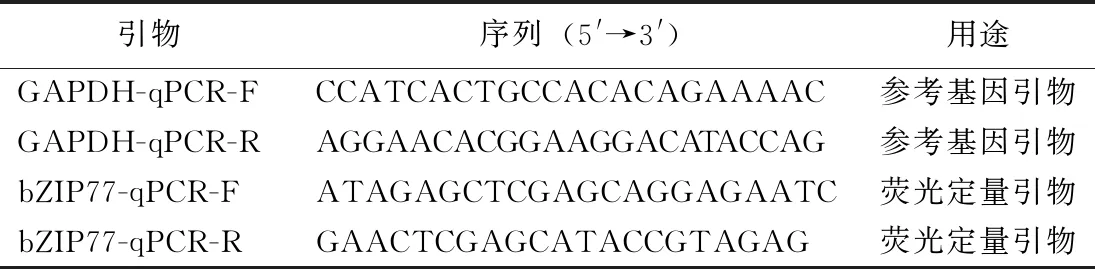
表1 引物序列及用途Table 1 Primer sequence and application
1.3 玉米ZmbZIP77基因表达分析
以玉米GAPDH基因为内参。试验中使用SYBR Green I荧光标记染料为购于天根生化公司的RealUniversal彩色荧光定量预混试剂,荧光定量PCR仪型号为bio-rad CFX connet。每个样品设置2个技术重复,相对定量的结果采用2-△△Ct法计算基因的相对表达量。
1.4 玉米ZmbZIP77基因的生物信息学分析
利用Expasy ProtParam (https://web.expasy.org/protparam/)在线软件对玉米bZIP家族成员进行氨基酸残基数、理论等电点和相对分子量等理化性质的预测,DNAMAN软件进行序列对比后使用MEGA-X软件构建进化树,使用在线工具InterProscan[16](http://www.ebi.ac.uk/interpro/search/sequence-search)分析ZmbZIP77蛋白结构域,采用在线工具SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测分析蛋白二级结构,TMHMM Server v.2.0(https://www.cbs.dtu.dk/services/TMHMM/ )用于ZmbZIP77蛋白的亲疏水性分析,NetPhos 3.1(http://www.cbs.dtu.dk/services/NetPhos/)则用于进行磷酸化微点预测分析。利用Softberry在线工具Protcomp 9.0(http://www.softberry.com/berry.phtml?topic=protcomppl&group=programs&subgroup=proloc)进行基因的亚细胞定位预测。
2 结果与分析
2.1 玉米ZmbZIP77的基因克隆与序列分析

图1 ZmbZIP77核苷酸序列及编码的氨基酸序列Fig.1 Nucleotide sequence of ZmbZIP77 and amino acid sequence of the coding
RT-PCR产物测序后的核酸及编码的氨基酸序列如图1所示。在NCBI中比对结果表明此序列与其他物种的bZIP77序列相似性最高,于是命名此序列为ZmbZIP77,并在NCBI中登录,登录号为MH210731。进一步分析表明,此序列含有1个长度为387bp的开放阅读框,上游有1个起始密码子ATG,下游有1个终止密码子TGA,表明此序列是1个全长的基因。
ProtParam在线分析显示,ZmbZIP77基因共编码129个氨基酸,分子质量为31.8ku,等电点为5.16,总平均亲水性为0.961,亲水性系数介于-3~3之间,属于两性氨基酸(见图2(a))。NetPhos 3.1 在线分析显示,ZmbZIP77中有5个Ser磷酸化位点、3个Thr磷酸化位点和1个Tyr磷酸化位点(见图2(b))。利用InterProscan对ZmbZIP77蛋白的结构分析发现,该蛋白中含有BRLZ结构域和2个低复杂度区域,分别位于氨基酸14~81、93~103和105~121位置。SOPMA预测结果显示,ZmbZIP77的二级结构中含有α螺旋约占81.40%,β转角约占3.88%,延伸链约占1.55%,无规则卷曲约占13.18%(见图2(c))。利用Softberry在线工具进行的蛋白亚细胞定位预测结果显示,该蛋白可能位于细胞核中。
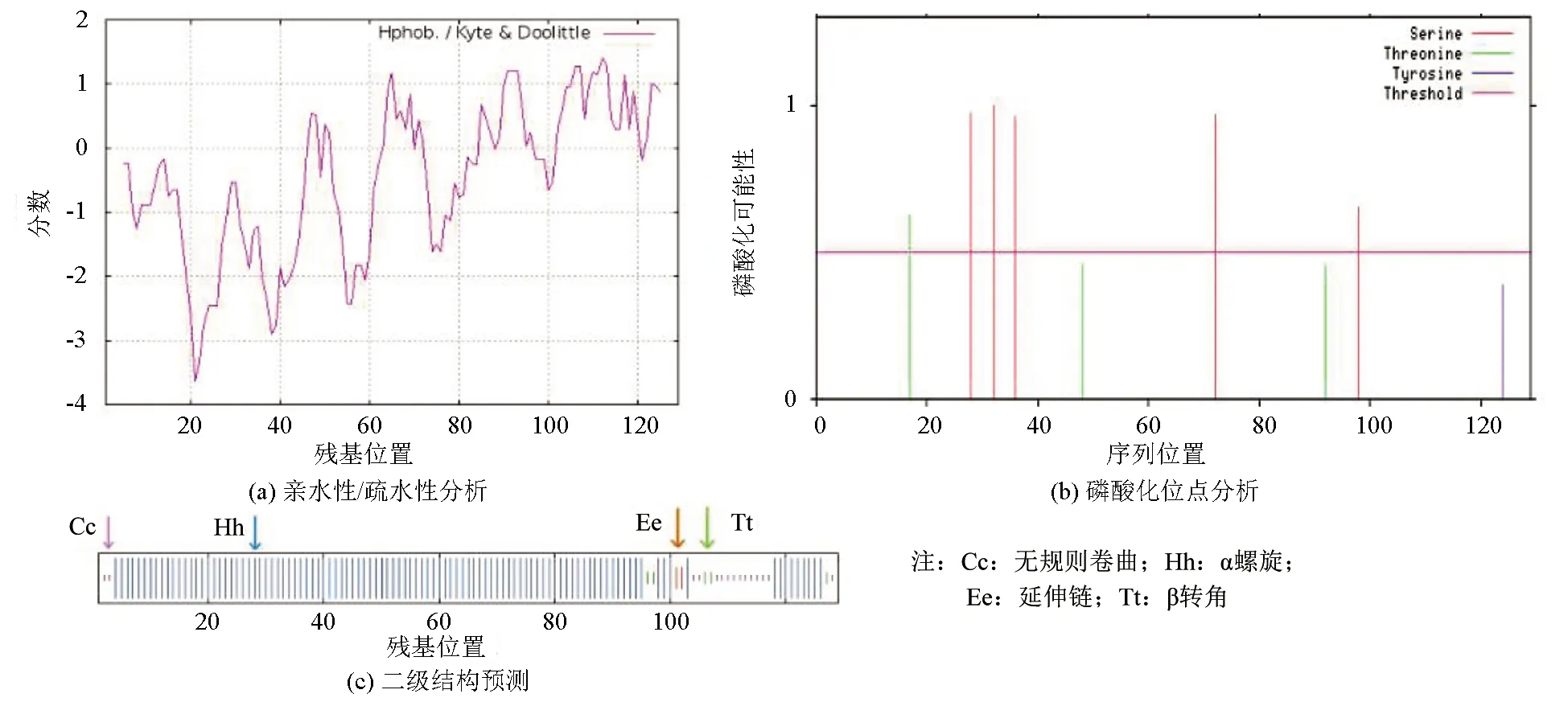
图2 ZmbZIP77蛋白的生物信息学分析Fig.2 Bioinformatics analysis of ZmbZIP77 protein
2.2 玉米ZmbZIP77的蛋白同源性及进化树分析
从NCBI中分别选取拟南芥、小麦以及水稻的bZIP序列与ZmbZIP77进行多序列比对,结果如图3所示。由图3可知,ZmbZIP77与其他bZIP家族成员一样,均含有1个保守的GBF1(Plant G-box binding factor 1)结构域,暗示它和该家族中其他成员具有相同或相似的功能。

图3 ZmbZIP77蛋白序列及其他序列的多重比对Fig.3 Multiple alignment of ZmbZIP77 protein sequence with other sequences
图4表示ZmbZIP77与其他相关bZIP序列(包括拟南芥中的AtbZIP10和HY5,水稻中的OsbZIP34、OsbZIP06和OsbZIP2b,高粱中的SbbZIP19、SbbZIP27和SbbZIP60,玉米中的ZmbZIP6和ZmbZIP52,小麦中的Wlip9a和TabZIP1)构建的进化树。由图4可知,根据bZIP序列的同源性,植物bZIP序列可以分为3类,ZmbZIP77位于第Ⅱ类,与小麦Wlip9a和拟南芥AtbZIP10亲缘关系最近。

图4 ZmbZIP77蛋白与其它物种同源基因的进化树分析Fig.4 Phylogenetic tree analysis of ZmbZIP77 protein and homologous genes of other species
2.3 玉米ZmbZIP77的表达谱分析
2.3.1ZmbZIP77在玉米不同组织中的表达谱分析
采用实时荧光定量PCR技术分析ZmbZIP77基因在不同部位中的表达情况。结果(见图5)表明,ZmbZIP77在根中的表达量最高,其次是胚芽鞘,在叶中的表达水平相对较低。该基因在根中的表达量是叶中表达量的5.17倍,在胚芽鞘中的表达量是叶中表达量的1.73倍,由此推断ZmbZIP77基因可能在根及胚芽鞘的发育进程中起作用。
2.3.2ZmbZIP77在不同处理下的表达谱分析
利用实时荧光定量PCR方法分析玉米根中ZmbZIP77基因在不同非生物胁迫处理下的表达水平,结果如图6所示。由图6可知,在玉米根中干旱、ABA和高温极显著诱导该基因表达,其中干旱和ABA处理后该基因表达量是未处理的4.15倍和4.47倍;盐胁迫对该基因无显著诱导作用,暗示该基因可能参与ABA信号相关的干旱信号响应。
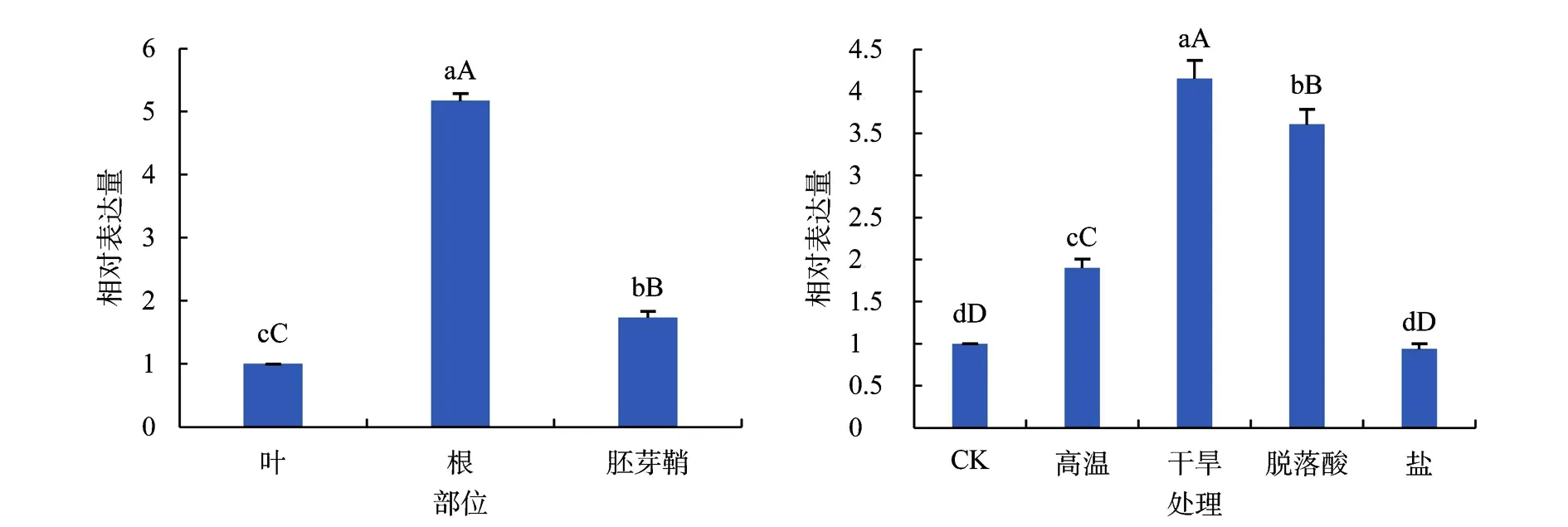
图5 正常条件下ZmbZIP77在玉米各部位中的相对表达量 图6 不同处理条件下ZmbZIP77在玉米根中的相对表达量Fig.5 The relative expression of ZmbZIP77 in various Fig.6 The relative expression of ZmbZIP77 in maize parts of maize under normal conditions roots under different treatment conditions
3 结论
通过分别从其他作物中选取bZIP序列与玉米ZmbZIP77进行多序列比对,结果发现这些bZIP序列非常保守,都含有一个保守的GBF1(Plant G-box binding factor 1)结构域,暗示ZmbZIP77和其它bZIP转录因子家族成员一样行使相同或相似的功能。进化树分析结果表明玉米ZmbZIP77同拟南芥AtbZIP10和小麦Wlip19a的亲缘关系最近,位于第Ⅱ类。
在不同组织中测定玉米ZmbZIP77基因的表达量,结果显示,在根和胚芽鞘中表达量相对较高,在叶中表达量相对较低,说明玉米ZmbZIP77具有组织特异性。对玉米分别进行高温、干旱、脱落酸(ABA)和盐4种非生物胁迫处理,结果表明,干旱显著诱导玉米ZmbZIP77表达,ABA和高温次之,盐胁迫不显著诱导该基因表达。在根部中,玉米ZmbZIP77受干旱诱导表达模式与香蕉MaZAT10基因受干旱诱导表达相似[17];玉米ZmbZIP77受高温诱导表达模式和水稻OsBBX6相似[18,19]。玉米ZmbZIP77基因不但可以被干旱和高温等非生物胁迫因子诱导表达,还可以被ABA诱导表达,表明其可能参与ABA介导的非生物胁迫响应信号通路。对于其真实的生化特性、在逆境信号传导及植物生长发育中的确切作用还需要进一步研究探讨。

