硒化蒲公英多糖的制备、结构表征及益生菌促增殖活性
王丽波,高婧宇,李腾飞,李莲玉,刘 博,张洪龑,杨 昱,徐雅琴
(东北农业大学文理学院,黑龙江 哈尔滨 150030)
微量元素硒(Se)对生命活动有重要的作用,具有抗肿瘤、抗氧化、增强机体免疫能力、保护视觉器官、延缓衰老、预防和治疗心血管疾病等活性[1]。硒多糖是一类由硒和多糖结合而成的重要有机硒,相比无机硒,硒多糖的毒性更小,副作用更小[2],且兼具多糖类生物活性,如抗氧化、降血脂、降血糖和抗炎活性等,能够直接影响人体的生理功能。有研究报道,硒化修饰可改善多糖的生物活性:曾素娟等[3]对比了红芪多糖和硒化红芪多糖对口腔癌细胞SCC25增殖的抑制作用,结果表明各浓度多糖对SCC25细胞增殖的抑制作用均呈时间依赖性,且在相同条件下,硒化红芪多糖对细胞增殖的抑制作用更强;Liu Xuegui等[4]研究了苜蓿中多糖和硒化多糖的抗氧化活性,结果表明,硒化多糖对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基的清除能力强于原多糖,在质量浓度为5.0 mg/mL时,硒化多糖对DPPH自由基的清除能力与VC相近,表明多糖经硒化修饰后具有更好的抗氧化活性。
蒲公英(Taraxacum mongolicumHand.-Mazz.)是一种药食同源植物,有“天然抗生素”的美誉,含有多糖、萜类、酚酸、黄酮、香豆素等成分[5]。在上述化合物中,多糖是重要的功能性物质,已有研究表明蒲公英多糖具有抗炎、抗氧化、抑菌、抗肿瘤、降血糖、抗凝血等功效[6]。如Huang Dan等[7]研究了蒲公英多糖对DPPH自由基的清除能力,结果显示,当质量浓度为1.4 mg/mL时,多糖对DPPH自由基的清除率最高,可达89.33%,半抑制质量浓度为0.51 mg/mL,表明蒲公英多糖具有较强的DPPH自由基清除活性;李雪石等[8]研究蒲公英多糖对链脲佐菌素致糖尿病模型大鼠餐后血糖水平的影响,测定其血清胰岛素水平、葡萄糖灌输率、以及对α-糖苷酶体外活性的影响,结果表明蒲公英多糖具有降低餐后血糖的作用,且作用机制研究表明,蒲公英多糖可抑制小肠对麦芽糖的水解和对葡萄糖的吸收。目前,对蒲公英多糖的相关研究尚处于初级阶段,鲜见有关蒲公英多糖硒化修饰的研究报道。
本实验以蒲公英根为原料,采用硝酸-亚硒酸钠法制备硒化蒲公英多糖(selenized dandelion root polysaccharide,Se-DRP)。利用高效液相色谱、气相色谱、核磁共振(nuclear magnetic resonance,NMR)等多种方法表征多糖结构,测定Se-DRP对益生菌增殖的促进作用以及对α-淀粉酶活性的抑制作用。旨在通过对Se-DRP结构和活性的研究,探索蒲公英多糖的新应用领域,为硒化多糖的深入研究及蒲公英资源开发提供理论参考。
1 材料与方法
1.1 材料与试剂
蒲公英根购自黑龙江省哈尔滨市药材店,磨成粉后封袋密封保存,备用。
纤维素酶(≥50 U/g) 北京奥博兴生物科技有限公司;硝酸、亚硒酸钠、葡聚糖标准品、甲醇、三氟乙酸、吡啶、醋酸酐、氯仿、冰醋酸(色谱纯) 美国Sigma公司;植物乳杆菌10665、嗜酸乳杆菌 东北农业大学食品学院乳品科学教育部重点实验室;大孔吸附树脂D101、Sephadex G-100 南开大学化工厂;其他化学试剂均为国产分析纯。
1.2 仪器与设备
LC-AFS6500型液相色谱原子荧光联用仪 北京海光仪器有限公司;WFJ-7200型可见分光光度计、UV-2700双光束紫外-可见分光光度计 北京普析通用仪器有限公司;ALPHA-T型傅里叶变换红外光谱仪、AVANCEIII 400兆NMR波谱仪 德国Bruker公司;2695/2414高效液相色谱仪 沃特世科技(上海)有限公司;GC-2010 plus气相色谱仪 日本岛津公司。
1.3 方法
1.3.1 蒲公英多糖的制备与纯化
采用超声辅助酶法,以去离子水为提取剂,料液比1∶30(m/V)、超声功率700 W、超声时间40 min、纤维素酶添加量0.8%(以蒲公英质量计)的条件下提取多糖。提取液经过滤、浓缩、体积分数80%乙醇醇沉、冻干后得到蒲公英粗多糖。
依次采用D101大孔吸附树脂(3.5 cm×50 cm)和Sephadex G-100(1.8 cm×40 cm)纯化蒲公英粗多糖。先后两次洗脱条件分别为:1)D101大孔吸附树脂:多糖上样量为40 mg,去离子水为洗脱剂,洗脱流速2 mL/min;2)Sephadex G-100:多糖上样质量浓度1.0 mg/mL,去离子水为洗脱剂,洗脱流速0.6 mL/min。采用苯酚硫酸法[9]跟踪检测洗脱液,将多糖洗脱峰合并,浓缩、冻干后得到纯化蒲公英多糖。
1.3.2 Se-DRP的制备
用50 mL体积分数为0.5%的HNO3溶液溶解蒲公英多糖(500 mg),在室温下搅拌30 min,加入0.5 g Na2SeO3和0.7 g BaCl2,将混合物在60 ℃下搅拌,反应4 h。冷却至室温后,滴加1 mol/L的NaOH溶液将pH值调节至7~8。加入0.5 g Na2SO4除去Ba2+,将反应物3 500 r/min离心5 min,取上清液,用流水透析至加入抗坏血酸不显红色,再用去离子水透析12 h,浓缩、冻干即得到Se-DRP。
1.3.3 Se-DRP的理化性质测定
1.3.3.1 成分测定
采用原子荧光光谱法测定硒含量[10],苯酚硫酸法测定多糖质量分数[9],2,4-二硝基水杨酸法测定还原糖含量[11],考马斯亮蓝法测定蛋白质含量[12],间羟基联苯法测定糖醛酸含量[13]。
1.3.3.2 分子质量测定
配制质量浓度为2.0 mg/mL的葡聚糖标准品溶液(3 000、5 000、10 000、40 000、70 000 Da)和Se-DRP溶液,过0.22 μm的微孔滤膜后采用高效液相色谱仪测定分子质量。
色谱条件:检测器:2414示差折光检测器;色谱柱:Ultrahydrogel Linear色谱柱(7.8 mm×300 mm,10 μm);柱温:(35±0.1)℃;流动相:超纯水;流速:0.6 mL/min;进样量:10 μL。
1.3.3.3 单糖组成测定
称取20.0 mg Se-DRP于具塞试管中,加入4.0 mL 4 mol/L的三氟乙酸,密封振荡5 min,在110 ℃条件下水解8 h。反应结束后,加入4 mL色谱级甲醇辅助氮吹,除尽三氟乙酸。按照参考文献[14],将单糖标准品和多糖水解物用糖腈乙酰化法衍生处理后,利用气相色谱仪分析单糖组成。
1.3.4 Se-DRP的结构测定
1.3.4.1 紫外光谱分析
配制质量浓度为0.1 mg/mL的Se-DRP溶液,在200~400 nm的波长范围内扫描。
1.3.4.2 傅里叶变换红外光谱分析
称取2.0 mg Se-DRP样品与KBr固体充分研磨后压片,在4 000~400 cm-1的波数范围内扫描。
1.3.4.3 NMR分析
将70.0 mg Se-DRP样品溶于1 mL的D2O,充分振荡核磁管使其完全溶解,室温下采用400 MHz NMR仪测定1D-NMR(1H-NMR、13C-NMR)。
1.3.5 Se-DRP对益生菌增殖作用分析
1.3.5.1 培养基的配制
MRS肉汤培养基的配制:1 L去离子水中加入10.0 g蛋白胨、10.0 g牛肉膏、5.0 g酵母粉、1.0 mL吐温-80、2.0 g K2HPO4、5.0 g乙酸钠、2.0 g柠檬酸二铵、0.20 g MgSO4、0.05 g MnSO4,调节pH值至6.5(±0.05)。
MRS固体培养基的配制:将15.0 g琼脂加入到MRS肉汤培养基中,制得MRS固体培养基。
增殖培养基的配制:在MRS肉汤培养基中分别添加不同质量浓度(0、5、10、15、20 mg/mL)的Se-DRP,以不含碳源的MRS肉汤培养基为空白对照,低聚果糖(fructo oligosaccharide,FOS)为阳性对照。
1.3.5.2 菌种的活化
将MRS液体培养基用高压灭菌锅灭菌(120 ℃、15 min)。无菌环境下将植物乳杆菌10665和嗜酸乳杆菌分别接种于MRS液体培养基中,37 ℃恒温培养箱中培养36 h后,将两个菌株分别接种于MRS固体培养基上,37 ℃恒温培养36 h后,分别挑选两个菌种的单个菌落接种于MRS液体培养基中,同样条件再培养36 h,得到活化菌种。
1.3.5.3 Se-DRP对植物乳杆菌10665和嗜酸乳杆菌增殖作用分析
将10 mL不含碳源的MRS液体培养基高压灭菌。用无菌水溶解Se-DRP和FOS,过0.22 μm微孔滤膜后分别加入到MRS液体培养基中,使糖的终质量浓度为0、5、10、15、20 mg/mL。无菌环境下接种已活化的实验菌种,37 ℃恒温培养箱培养48 h,测定培养液在600 nm波长处的光密度值(OD600nm)。
1.3.5.4 益生菌生长曲线的绘制
取干净无菌的试管若干,各加入10 mL不含碳源的MRS肉汤培养基,灭菌。将200 mg Se-DRP和FOS样品用少量无菌水溶解后,过0.22 μm滤膜,无菌条件下分别加入到灭菌的MRS肉汤培养基中,使糖的终质量浓度为20 mg/mL。无菌条件下分别接种活化的植物乳杆菌10665和嗜酸乳杆菌,37 ℃恒温培养箱中培养48 h。分别在培养的0、4、8、16、24、32、40、48 h取样,测定液体培养基pH值和600 nm波长处的光密度值(OD600nm),并绘制生长曲线。
1.3.6 Se-DRP对α-淀粉酶活性抑制率的测定
取1.0 mL多糖溶液(质量浓度0.2~4.0 mg/mL)与1.0 mLα-淀粉酶溶液(质量浓度0.6 mg/mL)和可溶性淀粉溶液(质量浓度2.0 mg/mL)充分混合,37 ℃恒温培养箱中反应20 min,结束后,加入5.0 mL的二硝基水杨酸试剂沸水浴5 min,冷却至室温,采用紫外-可见分光光度计测定540 nm波长处的吸光度。以阿卡波糖为阳性对照,按下式计算抑制率[15]。
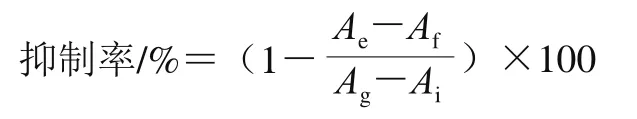
式中:Ae为样品、底物和酶的吸光度;Af为样品和底物的吸光度;Ag为酶和底物的吸光度;Ai为底物的吸光度。
1.4 数据处理与分析
实验数据均以3 次结果的平均值±标准误差表示。采用Origin 8.5软件绘图,并用SPSS软件进行差异显著性分析,差异显著性分析方法为邓肯检验,P<0.05为差异显著。
2 结果与分析
2.1 Se-DRP的理化性质
经两步柱层析分离后制得的纯化蒲公英多糖的质量分数为(94.24±0.48)%。Se-DRP的质量分数为(93.47±0.75)%,可知硒化修饰后多糖纯度基本没有变化。成分测定结果表明,Se-DRP中的硒含量为(190.00±0.43)μg/g,糖醛酸含量为(103.80±0.05)mg/g,还原糖含量为(1.40±0.02)mg/g,不含蛋白质。
Se-DRP的分子质量采用高效液相色谱测定(图1A),Se-DRP的洗脱曲线仅为一个尖锐对称峰,表明其分子质量分布范围较窄,为均一多糖。根据标准葡聚糖回归方程lgm=-0.624 4x+13.362(R2=0.992 8),代入Se-DRP保留时间15.14 min,得到Se-DRP的分子质量为8 102 Da。Se-DRP的单糖组成由气相色谱测定(图1B),相同条件下通过对比标准品单糖出峰时间可确定单糖种类。结果表明,Se-DRP由半乳糖醛酸、鼠李糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖6 种单糖组成,物质的量比为0.64∶0.73∶19.36∶0.84∶1.00∶27.41。
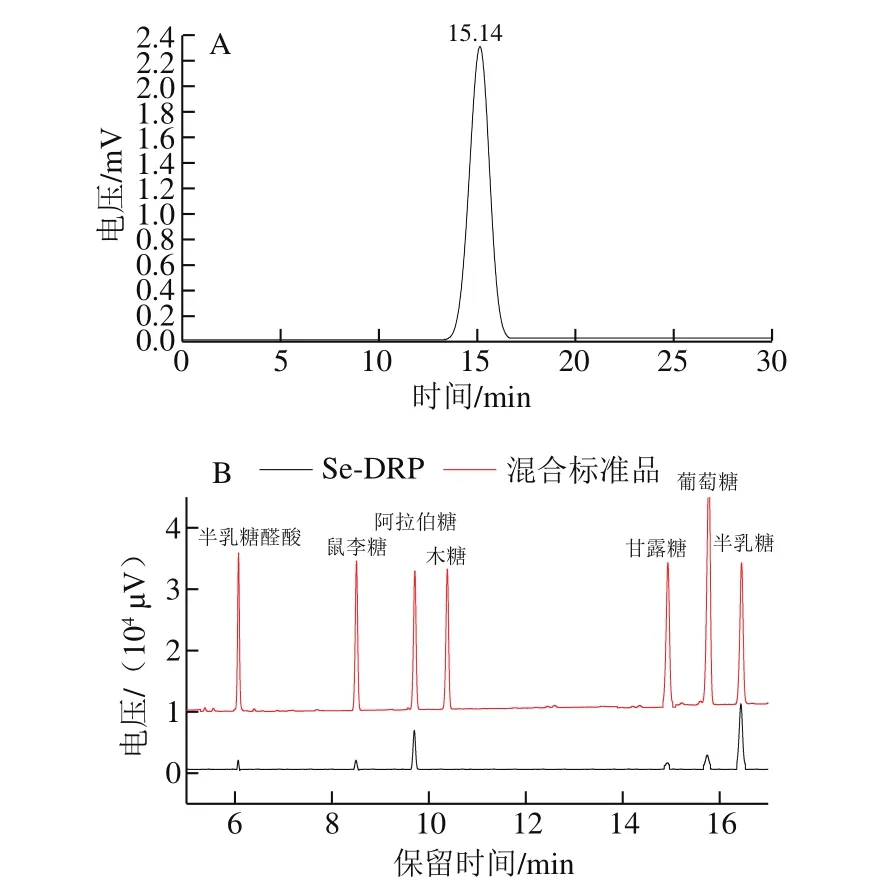
图1 Se-DRP液相色谱(A)和气相色谱(B)图Fig.1 Liquid chromatogram (A) and gas chromatogram (B) of Se-DRP
2.2 Se-DRP结构
2.2.1 紫外光谱分析
由图2A可知,Se-DRP在260 nm和280 nm波长处均没有吸收峰,表明Se-DRP中不存在蛋白质和核酸等成分。
2.2.2 傅里叶变换红外光谱分析
红外光谱是分析多糖结构有利的工具,可根据多糖的特征吸收峰鉴定多糖的结构。Se-DRP的傅里叶变换红外光谱见图2B,3 389.51、2 936.71 cm-1波长处对应的吸收峰分别是由O—H、C—H的伸缩振动引起的[16],1 745.46 cm-1波长处的吸收峰是由C=O的伸缩振动引起的,1 608.33 cm-1波长处的吸收峰是由羧酸中C=O伸缩振动引起的[17-18],1 424.08 cm-1波长处的吸收峰是C—H的弯曲振动峰[19],1 251.24 cm-1波长处的吸收峰是C—O糖苷键的振动峰,1 106.98 cm-1和1 026.99 cm-1之间的吸收峰表明有吡喃糖存在,834.16 cm-1波长处的吸收峰表明多糖结构中有α-糖苷键[20],759.89 cm-1和638.48 cm-1处的峰归因于Se=O的不对称伸缩振动[19,21]。
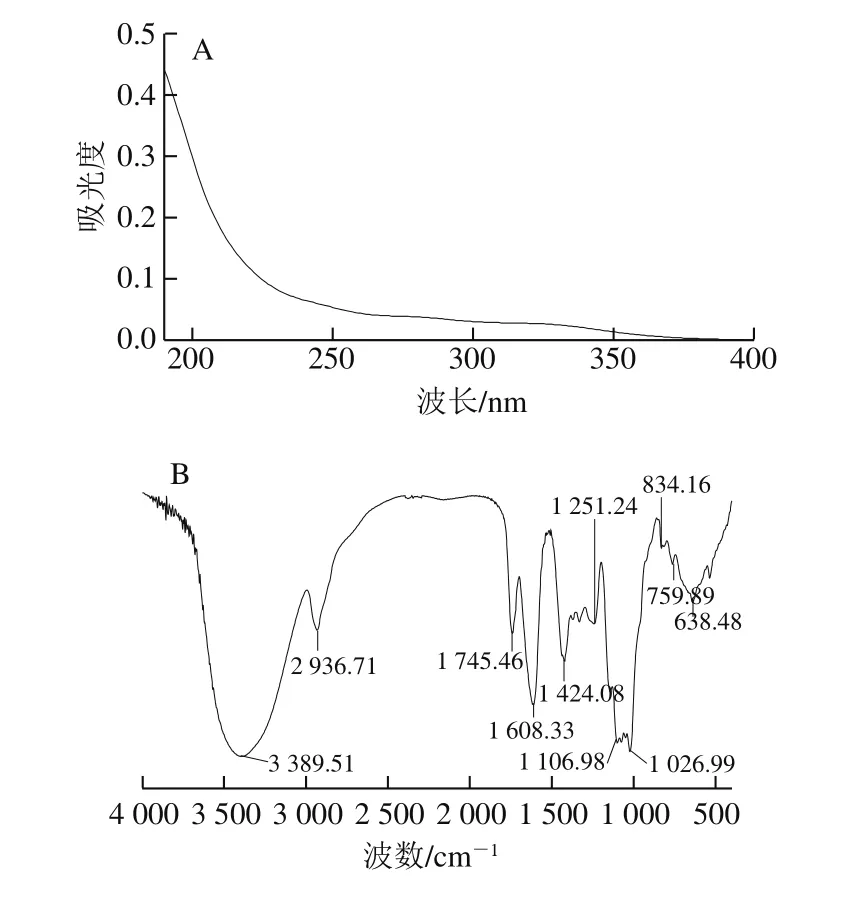
图2 Se-DRP的紫外光谱图(A)和傅里叶变换红外光谱图(B)Fig.2 Ultraviolet absorption spectrum (A) and Fourier transform infrared spectrum (B) of Se-DRP
2.2.3 NMR分析
多糖结构中的糖残基数目、糖环构型、异头构型、连接位置等信息可通过NMR分析获得。1H-NMR和13C-NMR谱图中多糖的典型信号分别集中在δH3.0~5.5和δC60~110范围内,根据δH4.0~5.5异头质子和δC90~110异头碳的共振信号,可判断多糖的异头构型(α-、β-构型)和糖环构型(吡喃糖和呋喃糖)。一般来说,α-构型异头氢质子的δ大于5.0,而β-构型异头氢质子的δ小于5.0;呋喃糖的C2和C4在δ82~84间有信号,吡喃糖C3和C5的δ一般小于80[22]。
由图3A可知,Se-DRP在异头氢的共振区域范围内共有6 个信号峰,δ分别为4.40、4.56、4.90、5.03、5.18、5.37,确定为3 个α-构型异头氢质子和3 个β-构型异头氢质子[22]。同时在13C NMR谱图(图3B)中,在异头碳的共振区域范围内,对应有6 个信号峰,δ分别为99.54、100.41、103.23、103.68、107.43、109.25。结合谱图及文献[17,23-24],将δ进行归属,确定组成Se-DRP的主要糖残基有→6)-β-D-葡萄糖-(1→(H1/C1~H6/C6位移值分别为4.40/103.23、3.43/69.90、3.63/74.29、4.01/70.57、3.95/76.98、3.67/67.94)、→3)-β-D-半乳糖-(1→(H1/C1~H6/C6化学位移分别为4.56/103.68、3.46/69.90、3.66/79.03、3.43/72.61、3.63/74.29、3.72/61.27)、→5)-α-L-阿拉伯糖-(1→(H1/C1~H5/C5化学位移分别为5.03/109.25、4.16/81.35、3.87/76.58、4.07/83.85、3.67/68.47)和→4)-α-D-半乳糖醛酸-(1→(H1/C1~H5/C5化学位移分别为5.37/99.54、3.63/71.41、3.85/73.70、3.74/79.03、4.17/70.57,C6为170.78)。根据文献[25-26],δ4.90/107.43和δ5.18/100.41分别归属于β-甘露糖和α-鼠李糖。
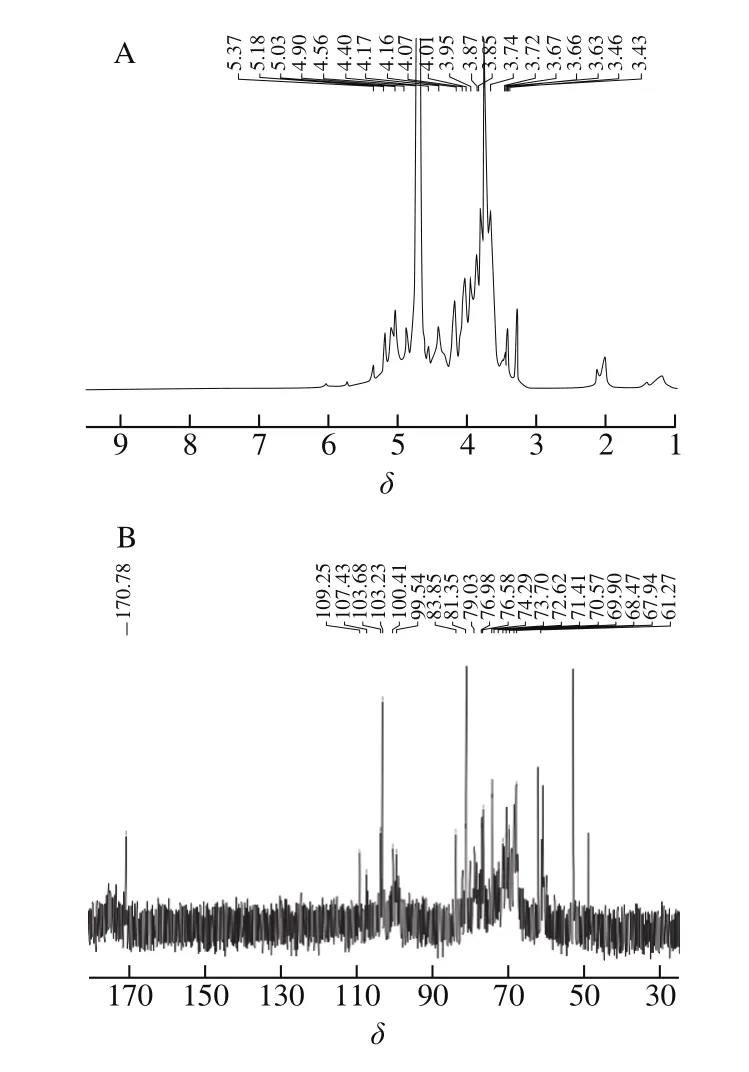
图3 Se-DRP的1D NMR谱Fig.3 1D NMR spectra of Se-DRP
2.3 Se-DRP对益生菌增殖的促进作用
益生菌是肠道中一类对宿主有益,通过维持宿主肠道微生态平衡,从而对宿主产生确切健康功效的微生物总称。双歧杆菌和乳杆菌是两类主要益生菌,约占肠道细菌总数的25%,包括长双歧杆菌、青春双歧杆菌、嗜酸乳杆菌、植物乳杆菌10665等[27-28]。研究表明,益生菌有预防和治疗肠道疾病、刺激免疫功能、降低胆固醇和心血管病风险、抗肿瘤、抗癌及抑制病原菌的作用[29]。益生元是一种刺激细菌生长的化合物,它与机体的健康有关,能够降低由微生物区系改变介导的疾病风险[30]。目前,FOS是公认的最有利于益生菌增殖的碳源[31],对乳杆菌等益生菌具有较好的增殖促进作用。如王鑫[32]以FOS为阳性对照,研究了菜籽多糖及其修饰产物对嗜酸乳杆菌的益生作用,结果表明FOS及多糖均具有一定的增殖促进作用,且FOS的作用更强。Huang Fei等[33]研究了发酵前后龙眼果肉多糖对植物乳杆菌10665和嗜酸乳杆菌的益生活性,发现发酵后多糖弱于阳性对照FOS对菌种的促增殖活性。因此,本实验采用FOS作阳性对照,研究Se-DRP对植物乳杆菌10665和嗜酸乳杆菌的促生长作用。
2.3.1 Se-DRP对益生菌的促生长作用
培养液的光密度值(OD600nm)可以衡量菌体数量变化,OD600nm越大,表示菌液中所含有的菌体数目越多。由图4A、B可知,在多糖质量浓度5~20 mg/mL范围内,植物乳杆菌10665和嗜酸乳杆菌的数量都随Se-DRP质量浓度的增加而增加,表明Se-DRP对两个菌种均有一定的增殖促进作用,且菌种的增殖和Se-DRP质量浓度之间呈剂量依赖性。当质量浓度到达15 mg/mL后,菌种数量增长趋势相对变缓。此外,相同条件下,Se-DRP对两个菌种的促生长作用均弱于FOS。

图4 Se-DRP对植物乳杆菌10665(A)和嗜酸乳杆菌(B)的促增殖活性Fig.4 Effect of Se-DRP on promoting the proliferation of Lactobacillus plantarum 10665 (A) and Lactobacillus acidophilus (B)
2.3.2 益生菌的生长曲线
多糖作为碳源在被益生菌代谢利用的过程中,会被分解为一些单糖,而这些单糖可作为益生元提供能源物质,促进益生菌的生长。同时,益生菌利用多糖代谢会产生有机酸,营造酸性环境,并且随着培养时间的延长,菌体产生的酸不断增加,培养液的pH值也下降。所以通过测定培养液中pH值的变化,可掌握菌体的增殖状况[34]。
由图5A、B可知,随着培养时间的延长,接种植物乳杆菌10665和嗜酸乳杆菌的Se-DRP和FOS液体培养基OD600nm均明显上升,在培养36 h后,OD600nm基本维持稳定,说明菌落总数随培养时间的延长不断增加,在培养36 h后,菌种的生长趋于稳定。Se-DRP对益生菌增殖的促进作用可能与其低分子质量关系较大。王霄[35]对比了菜籽多糖及其酶解产物对益生菌的增殖促进作用,研究结果表明,酶解后分子质量为7 184 Da的多糖对益生菌生长促进作用强于酶解前分子质量为52 485 Da的多糖,表明低分子质量的多糖可被益生菌更好地利用[36]。
从培养液pH值与培养时间的关系曲线可知,随着培养时间的延长,植物乳杆菌10665和嗜酸乳杆菌在Se-DRP培养基和FOS培养基中的pH值均呈下降趋势,在培养36 h后,pH值趋于稳定。这是因为益生菌生长过程中分泌的糖苷酶能够将多糖水解成单体,然后通过代谢将单体降解成短链脂肪酸(乙酸、丙酸、丁酸和乳酸)和气体,从而导致发酵液的pH值明显降低。但随着培养时间延长,培养基中的碳源基本被消耗,所以益生菌的生长变缓,发酵液的pH值也趋于稳定[37]。
综上,Se-DRP对植物乳杆菌10665和嗜酸乳杆菌具有良好的增殖促进作用,可视为潜在的益生元。
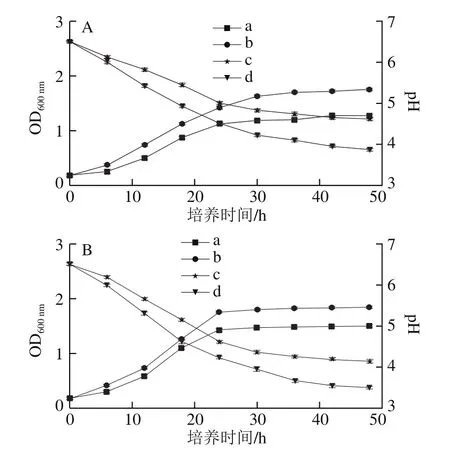
图5 植物乳杆菌10665(A)和嗜酸乳杆菌(B)的生长曲线Fig.5 Growth and acid production curves of Lactobacillus plantarum 10665 (A)and Lactobacillus acidophilus (B) in the presence and absence of Se-DRP
2.4 Se-DRP对α-淀粉酶活性的抑制作用
α-淀粉酶抑制剂通过抑制小肠中糖类水解酶的活性,减少淀粉类食物中葡萄糖的释放,延缓碳水化合物的吸收。因此,天然的α-淀粉酶抑制剂可作为口服降糖药。如图6所示,在质量浓度0~1.0 mg/mL范围内,Se-DRP和阿卡波糖对α-淀粉酶活性的抑制率均随质量浓度的增加而增加,当质量浓度为1.0 mg/mL时,Se-DRP和阿卡波糖对α-淀粉酶活性的抑制率分别为(48.34±0.96)%和(77.47±1.07)%。随后二者对α-淀粉酶活性的抑制率保持平稳。在质量浓度为4.0 mg/mL时,Se-DRP的抑制率为(52.34±1.45)%,低于阿卡波糖的抑制率((79.94±1.24)%)。这是由于多糖在低质量浓度时,酶过量,每个多糖分子都可以和酶分子结合,抑制酶的活性,当浓度达到一定值时,所有的酶分子都已和多糖结合,再增加多糖的质量浓度,抑制率不再明显升高[38]。
万艳娟等[39]报道了质量浓度2.00 mg/mL的南瓜多糖对α-淀粉酶活性的抑制率为2.50%。王文武等[38]研究了海藻多糖对α-淀粉酶活性的抑制作用,结果显示,随着多糖质量浓度的增加,其活性抑制率也不断提高,当多糖质量浓度达到10.00 mg/mL时,其对α-淀粉酶活性的抑制率不再增加,半抑制质量浓度为2.85 mg/mL。可见Se-DRP对α-淀粉酶活性的抑制作用强于南瓜多糖和海藻多糖,可应用于碳水化合物消化调节、食品升糖指数控制。
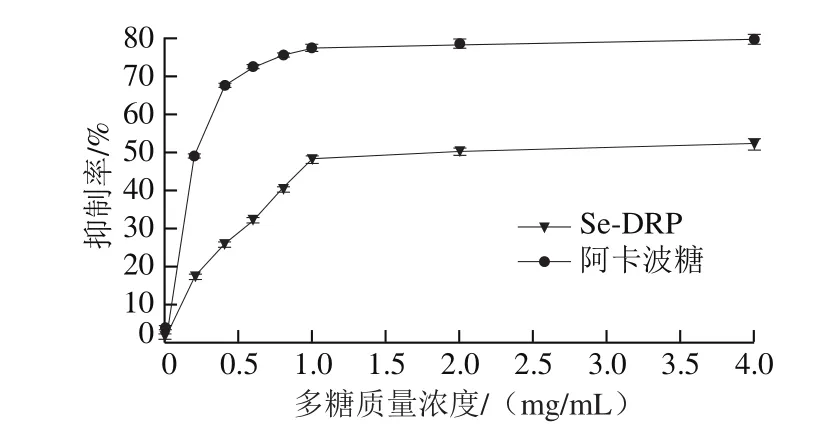
图6 Se-DRP对α-淀粉酶活性的抑制作用Fig.6 Inhibitory effect of Se-DRP on α-amylase activity
3 结 论
本实验制备了硒含量为(190.00±0.43)μg/g的Se-DRP,其质量分数为(93.47±0.75)%,由6 种单糖组成,分子质量8 102 Da。Se-DRP具有多糖特征吸收峰,主要糖残基为→6)-β-D-葡萄糖-(1→、→5)-α-L-阿拉伯糖-(1→、→4)-α-D-半乳糖醛酸-(1→和→3)-β-D-半乳糖-(1→。在Se-DRP质量浓度为5~20 mg/mL范围内,随多糖Se-DRP质量浓度的增加,对植物乳杆菌10665和嗜酸乳杆菌的生长促进作用显著增强,同时产生酸性代谢产物,说明Se-DRP可被益生菌利用,是潜在的低分子质量多糖类益生元。在质量浓度为0~1.0 mg/mL范围内,Se-DRP对α-淀粉酶活性的抑制率和质量浓度之间呈剂量依赖性,质量浓度为1.0 mg/mL时,Se-DRP的抑制率可达(48.34±0.96)%,表明Se-DRP可作为天然的α-淀粉酶抑制剂应用于降血糖药物或功能性食品。

