衍生化—气相色谱—质谱法测定饮用水中的二甲胺*
石梦琦 李翠梅 朱君妍 张绍广 孙 雯
(苏州科技大学环境科学与工程学院,江苏 苏州 215009)
亚硝胺类化合物是一种新兴的饮用水消毒副产物(DBPs),已被美国环境保护署(USEPA)列为可能的人类致癌物[1-3]。学者对我国饮用水系统中含氮消毒副产物(N-DBPs)调查发现,水中的亚硝胺前体物浓度较高,此结果引起了国内各界的关注[4]。这类DBPs是由含氮物质通过亚硝化或氧化反应生成的[5],其中检出最多、浓度最高的是N-亚硝基二甲胺 (NDMA)[6],要控制这些DBPs形成,最有效的方法是尽量减少其来自水源的前体物[7-8]。研究表明,二甲胺(DMA)和DMA官能团的叔胺是N-DBPs的直接前体物[9-10],其中DMA可与水中的氯、氯胺以及臭氧反应生成NDMA[11-13]。目前,DMA常痕量存在于工业废水、生活污水中,对环境和人类的健康带来了威胁[14]。
DMA属于有机胺中的脂肪胺,具有极性强、分子量低、亲水性强等特点[15-17],DMA常温状态下易挥发,若直接进样检测效果不理想,因此预处理需采用衍生化法将DMA与苯磺酰氯(BSC)反应生成化学性质稳定的二甲基苯磺酰胺(BSA)。目前,针对于DMA的检测方法有分光光度法、液相色谱法和气相色谱—质谱(GC—MS)法等;其中分光光度法易受金属离子等因素的干扰;液相色谱法基质杂峰较多,分离效果不佳;GC—MS法灵敏度高、定量准确,适用于饮用水中痕量二级胺类物质的检测。但大部分研究检出限为微克或毫克级别,本实验采用衍生化—GC—MS法测定水中DMA的含量,对衍生化温度、pH、反应时间以及萃取剂用量进行了优化选择,通过减少实验药剂的使用量,增加萃取次数使预处理时间缩短,萃取更完全。在优化检测条件的基础上,提高了检测方法的精密度及回收率等,使检出限突破了以往的微克级别,可以更加准确地检测饮用水中DMA等二级胺类物质含量。
1 材料与方法
1.1 主要材料
DMA溶液(质量分数为33%),二氯甲烷(DCM)、BSC、无水Na2SO4、NaHCO3、NaOH均为分析纯。
1.2 主要仪器
7890型GC—MS仪,HH-6型磁力搅拌恒温水浴锅,Sartorius BT25S型微量天平,LDO-9240A型烘箱,SX751型便携式多参数测量仪,HPS-3C型精密pH计,ZRXQ0150型纯水/超纯水装置。
1.3 实验条件
采用GC—MS检测,其中色谱柱选用安捷伦HP-5系列的弹性石英毛细管柱,规格为30.0 m×0.25 mm×0.25 μm;色谱柱箱升温过程:40 ℃保持5 min,以20 ℃/min的速率升温至120 ℃(保持2 min),然后再升温至220 ℃,最后以10 ℃/min的速率升温至300 ℃(保持1 min)。进样口温度280 ℃;柱前压力80.3 kPa;载气氮气、氦气的流量为1 mL/min;色谱检测器电离电位为70 eV;质谱检测采用离子选择模式(SIM),由图1可知特征离子质荷比为77.1、141.0、185.0。
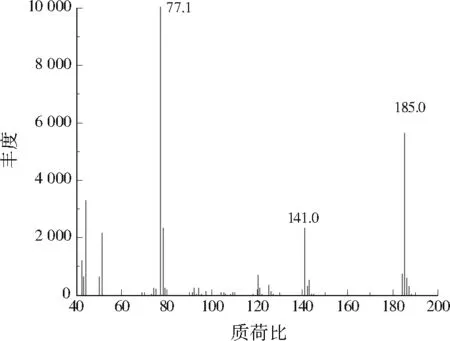
图1 保留时间为10.345 min时衍生物BSA的定性离子图Fig.1 Qualitative ion diagram of derivative BSA at a retention time of 10.345 min
1.4 实验方法
本实验使用BSC衍生化法[18]作为预处理方法,其原理是DMA与BSC发生衍生化反应并生成BSA。实验步骤为:(1)在250 mL锥形瓶中加入100 mL 2.00 ng/L的DMA标准溶液,再依次加入1 mL BSC和4 mL 400 g/L的NaOH,将密封好的锥形瓶在低温(7 ℃)下搅拌30 min。(2)为了完全水解多余的BSC,需在充分反应后加入5 mL 400 g/L的NaOH,在高温状态(80 ℃)下继续搅拌30 min。当溶液冷却至室温后,调节pH为5.0~5.5。(3)依次加入20 mL DCM萃取2次,以去除多余的BSC,萃取后的有机相加入15 mL 4.2 g/L的NaHCO3溶液进行反萃取。(4)所得的有机相经无水Na2SO4干燥后直接进样,使用GC—MS仪进行检测分析。
2 结果与讨论
2.1 最佳条件
2.1.1 衍生化温度的影响
取2.00 ng/L的DMA标准溶液,考察温度(50、60、70、80、90 ℃)对衍生化反应的影响,反应时间为30 min。由图2可知,当衍生化温度为50~80 ℃时,衍生物BSA的峰面积呈上升趋势,当衍生化温度达到80 ℃时,衍生物BSA的峰面积最大,若衍生化温度过高,会加速水分挥发,影响后续的解析测定,同时对检测仪器与色谱柱造成不利影响。因此,最佳的衍生化温度为80 ℃。
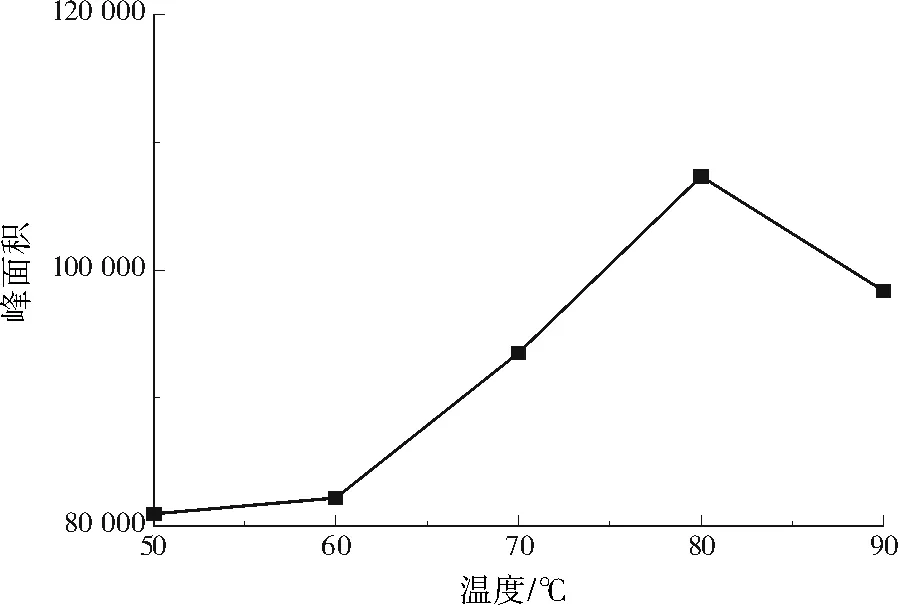
图2 温度对衍生物BSA峰面积的影响Fig.2 Effect of temperature on the peak area of derivative BSA
2.1.2 pH的影响
取2.00 ng/L的DMA标准溶液,考察pH(3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0)对衍生化反应的影响。由图3可知,当pH为3.0~5.5时,随着pH的增加,衍生物峰面积增加;当pH为5.5~7.0时,随着pH的增加,衍生物峰面积减少。pH为5.0~5.5时,衍生物的检测峰面积较大,反应趋于平衡。因此,最佳pH为5.0~5.5。
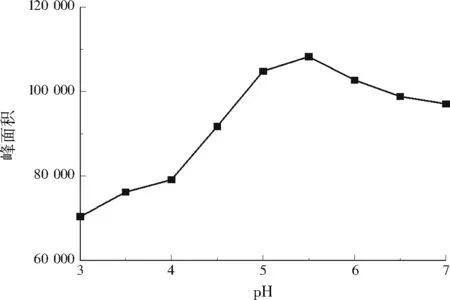
图3 pH对衍生物BSA峰面积的影响Fig.3 Effect of pH on the peak area of derivative BSA
2.1.3 反应时间的影响
在预处理过程中,由于DMA在常温状态下易挥发,故将衍生化过程分为两个阶段:低温反应和高温反应。低温反应可以尽可能保存溶液中的DMA,高温反应会影响到衍生化是否完全。设置低温反应时间为10~30 min;高温反应时间为10~30 min,对两个阶段的反应时间分别进行优化,探索其最优的时间分配。
取2.00 ng/L的DMA标准溶液,考察两个阶段不同的反应时间对衍生化反应的影响。由表1可知,低温反应与高温反应均为30 min时,衍生物BSA的峰面积最大,此时的衍生化反应比其他条件下更完全,无逆反应。因此,最佳的反应时间为低温反应30 min,高温反应30 min。
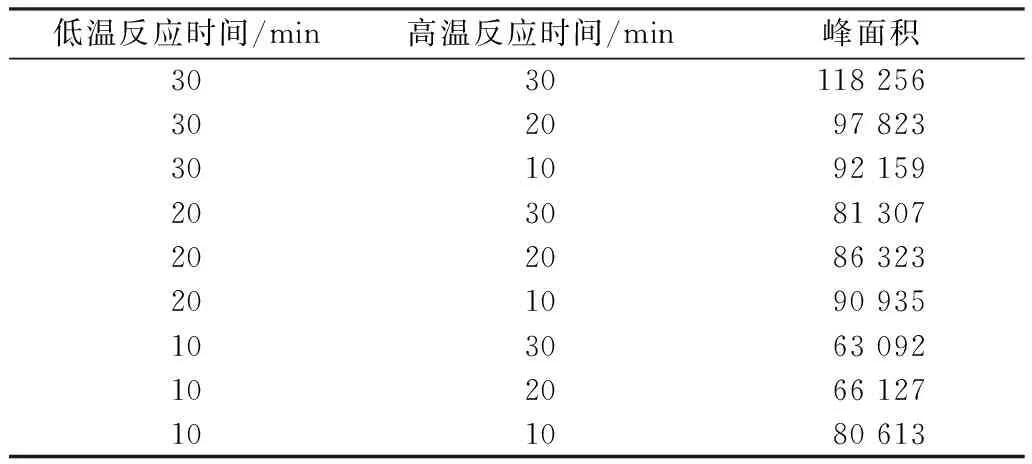
表1 反应时间对衍生化反应的影响
2.1.4 萃取剂用量的影响
在预处理过程中,萃取剂用量主要影响衍生物的萃取率和保留效果。由于BSC衍生化法需进行两次萃取,故在实验中设置两次萃取剂用量,探索萃取剂用量的最优组合。
取2.00 ng/L的DMA标准溶液,考察两次萃取剂用量对衍生化反应的影响。由表2可知,当两次萃取剂用量均为20 mL时,衍生物BSA的峰面积最大,此时萃取最完全。因此,两次萃取剂用量均取20 mL为最佳。
2.2 标准曲线
取低浓度(100、200、300、500、800、1 000 pg/L)和高浓度(1.00、5.00、10.00、50.00、80.00、100.00 ng/L)的DMA标准溶液,采用经优化的衍生化条件预处理后进行GC—MS分析,实验得出DMA标准溶液质量浓度为100~1 000 pg/L时,其标准曲线的线性回归方程为Y=89.691x-4 551.6,R2=0.999 8。DMA标准溶液质量浓度为1.00~100.00 ng/L时,其标准曲线的线性回归方程为Y=63 688x-13 994,R2=0.999 8。可见DMA含量与检测到的峰面积在两个浓度范围内均具有较好的线性关系。
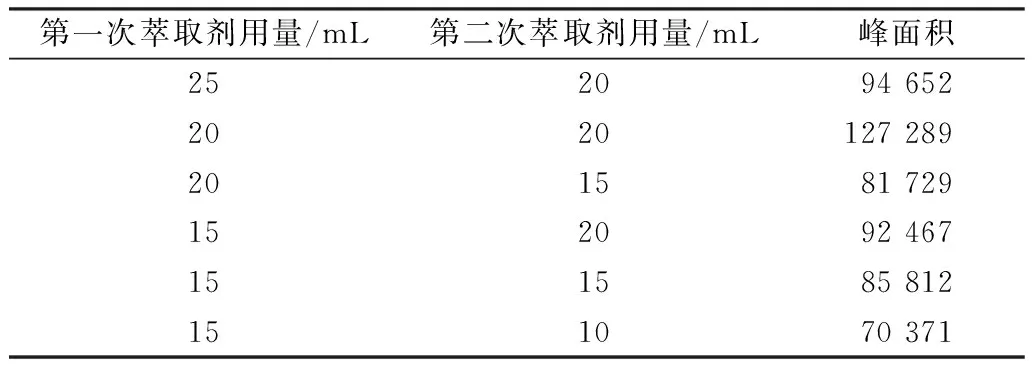
表2 萃取剂用量对衍生化反应的影响
2.3 方法检出限
在优化条件下,对5.00 ng/L的DMA标准溶液重复测定7次,算出方法检出限为0.01 ng/L。
2.4 重复性实验
在优化条件下,取DMA为0.50、2.00、20.00 ng/L的样品进行实验,每个浓度重复测定7次,考察分析方法的相对标准偏差(RSD)。
由表3可知,RSD≤9.29%,满足痕量分析中RSD≤15%的要求,表明优化后的方法重现性较好。
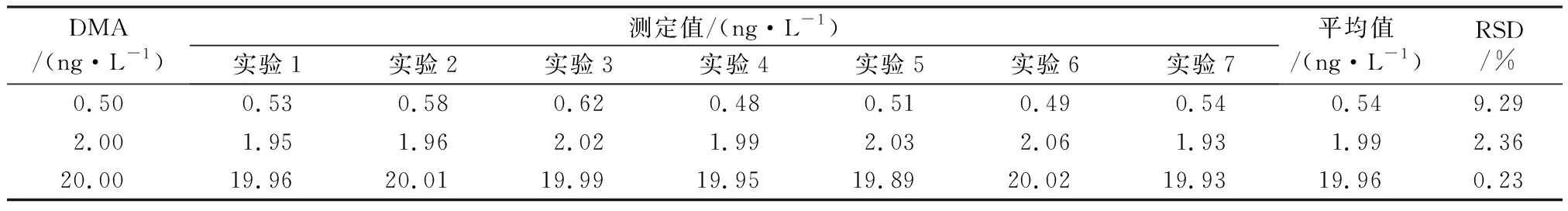
表3 RSD结果
2.5 加标回收率
在已知浓度的样品(DMA为3.00 ng/L)中分别加入不同浓度的DMA标准溶液,在相同的实验条件下,经衍生化预处理后,得出加标回收率为98.0%~102.4%(见表4)。
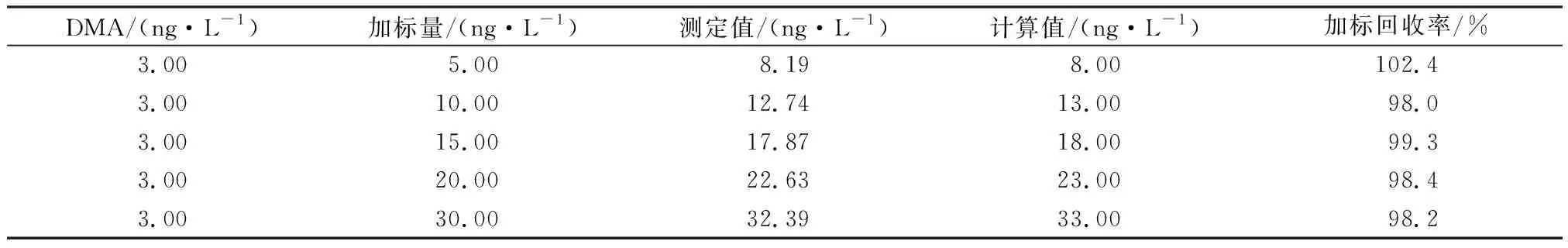
表4 加标回收率
3 结 语
(1) 衍生化—GC—MS法最佳衍生化温度为80 ℃,最佳pH为5.0~5.5,最佳反应时间为低温反应和高温反应均选择30 min,最佳的萃取剂用量为两次萃取剂用量均取20 mL。
(2) 衍生化—GC—MS检测DMA的线性关系良好,且方法的检出限为0.01 ng/L,RSD≤9.29%,加标回收率为98.0%~102.4%。
(3) 优化后的衍生化—GC—MS法线性关系好、检出限低、精密度及样品的回收率高,可用于饮用水中DMA含量的测定。

