一种β-内酰胺类抗生素的酶热检测方法
柳世超,李彬春,李深伟,吴长新,谢斌,孟庆来*
(1.山西大学 生物医学研究院,山西 太原 030006;2.山西大学 生物技术研究所,山西 太原 030006;3.上海国际旅行卫生保健中心,上海,200335;4.隆德大学 纯粹与应用生物化学系,瑞典 隆德 SE-2100)
0 引言
酶热传感器是一种流动注射量热生物传感器,可以通过检测酶催化反应过程中产生的热量对反应体系中的酶或其底物进行定量分析[1-2]。酶热传感器的检测特异性强,对光、电、浊度不敏感;但对热敏感性高,且检测的多个热信号可以叠加,相互间无干扰,因此检测灵敏度可达到1×10-5℃的温度变化。另外,酶热传感器完成样品的检测时间为5 min~10 min,检测速度快,适用于快速定量分析检测。基于这些检测优势,目前已经发展出多种酶热传感分析仪广泛应用于酶活性测定[3],全血代谢物临床监测[4](葡萄糖和乳酸),废水中农药及牛奶中外源添加的尿素和乳酸的检测[5]。近年来,有研究者通过组装有青霉素酶酶柱的酶热传感器(以下简称“青霉素酶酶热传感器”)发展了牛奶中非法外源添加的β-内酰胺酶(解抗剂)和青霉素类抗生素血药浓度进行快速检测的方法,并建立了病原菌抗生素耐药性快速分析模型[6-8]。但由于该传感器以青霉素酶为抗生素检测酶,因此对头孢霉素类及碳青霉烯类抗生素检测活性差而限制了其广泛应用。
新德里金属-β-内酰胺酶-1(New Delhi met allobeta-lactamase 1,NDM-1)是一种Ambler分类中的B 类 β-内酰胺酶[9],该酶对 β-内酰胺类抗生素中的碳青霉烯类、头孢霉素类及青霉素类抗生素都有强烈水解活性,其反应活性依赖Zn2+,而且其酶活性可被EDTA等金属离子螯合剂所抑制,但对β-内酰胺类自杀性抑制剂及阿维巴坦等新型抑制剂不敏感[10-11]。本研究以原核表达、纯化的NDM-1制备固相酶珠,组装酶柱,应用装配有NDM-1酶柱的酶热传感器(以下简称NDM-1酶热传感器)建立了一种快速定量分析青霉素类、头孢霉素类及碳青酶烯类抗生素的新方法并优化了反应条件。
1 材料与方法
1.1 材料与试剂
NDM-1基因及实验所需引物由生工生物工程(上海)股份有限公司合成,基因序列参考gene bank No.FN396876。 宿主菌大肠杆菌DH5α和BL21购买自TAKARA公司,表达载体pET-28购自Trans-Gen Biotech公司。通过引物去除NDM-1 N端信号肽同时引入 6个 His形成 his标签[12]。
DNA聚合酶2×Master Mix购买自天根生化科技有限公司;限制性内切酶Quick cut NdeⅠ和Quick cut XhoⅠ购买自TAKARA公司;T4 DNA连接酶购买自Promega公司;SanPrep柱式PCR产物纯化试剂盒、SanPrep柱式质粒DNA小量抽提试剂盒、DNA分子量标准品物(100~5 000 bp)、胰蛋白胨、酵母提取物、琼脂粉等购买自生工生物工程(上海)股份有限公司;各种盐类购买自国药集团化学试剂有限公司;实验所用各种生化试剂及抗生素购自北京索莱宝科技有限公司。Ni2+-NTA琼脂糖珠购自Qiagen公司。直径为125 μm ~ 140 μm且孔径为50 nm的丙氨基衍生的可控孔玻璃珠(CPG)购买自德国Steinachglas公司。
1.2 仪器与设备
ET-2010-02型酶热生物分析仪购自欧米克生物科技(武汉)有限公司;Cary 60 UV-Vis紫外分光光度计购自安捷伦公司;Nano-Drop one购自美国Thermo Fisher公司;HNY-200B摇床 购自天津欧诺仪器有限公司。
1.3 NDM-1酶的重组表达
利用质粒小提试剂盒提取经测序验证基因核苷酸序列正确的重组质粒,转化BL21大肠杆菌。挑单克隆于5 mL 2×YT培养基中,硫酸卡那霉素终浓度50 mg/L,37℃,220 r/min过夜培养。将种子液(体积分数1%)接种于1 L 2×YT培养基中(卡那霉素终浓度50 mg/L),37℃,220 r/min培养到菌密度OD 600 nm 0.8~1时加入IPTG,使其终浓度为0.5 mmol/L,然后16℃180 r/min过夜诱导表达。次日8 000 r/min、4℃离心收集菌体,用pH 8.0、50 mmol/L的PB缓冲液重悬,超声破碎13 000 r/min、4℃离心收集上清。将收集到的上清加到平衡好的镍柱中挂柱,然后用40 mmol/L咪唑柱洗涤杂蛋白,用200 mmol/L咪唑洗脱目的蛋白。将洗脱的NDM-1酶在4℃下用2 L pH 8.0、50 mmol/L的PB缓冲液透析两次。对于纯化的NDM-1酶,通过SDS-PAGE检测分子量和纯度,通过BCA试剂盒测定纯化蛋白浓度。
1.4 稳态动力学
以分光光度计(安捷伦)对NDM-1酶水解美罗培南的活性进行检测。反应条件为以含有10 μmol/L ZnSO4,pH值为7.0的PBS缓冲液在 30℃条件下进行检测,以294 nm波长对酶水解反应进行扫描,每5 min检测一次吸光值的变化来计算美罗培南的即时浓度。酶动力学常数(Km和kcat)通过计算NDM-1酶水解不同浓度美罗培南的初始反应速度而获取。浓度依赖的初始反应速度通过Graphpad Prism 5.0软件得到米氏方程。
1.5 NDM-1酶柱的制备
将450 μL CPG用戊二醛处理后在磷酸盐缓冲液中室温减压活化30 min,在常压下再活化30 min,用含 2 μmol/L ZnSO4的 1 × PBS清洗 CPG,加入NDM-1酶液500 μL,然后将CPG/酶液在室温下翻转孵育2 h,再4℃翻转过夜孵育。用含1 μmol/L ZnSO4的1× PBS缓冲液清洗CPG,静置去掉上清,加入等体积的0.4 mol/L乙醇胺室温孵育2 h,用含1 μmol/L ZnSO4的1× PBS缓冲液再次清洗CPG,静置去掉上清,装入柱中完成NDM-1酶柱的制备。
1.6 Zn2+依赖性的测定
分别配置pH 7.0的PBS上样缓冲液;含10 μmol/L ZnSO4、pH 7.0的 PBS上样缓冲液;同时含10 μmol/L ZnSO4及 1 mmol/L EDTA、pH 7.0 的PBS上样缓冲液。分别用这三种缓冲液配置终体积为 500 μL、浓度为500 mg/L的青霉素G(Penicillin G)、头孢曲松(Ceftriaxone)、美罗培南(Meropenem)溶液。然后将抗生素上样到NDM-1酶热传感器(上样时上样缓冲液与配置抗生素的缓冲液一致)并记录反应产生的热信号数据。每个反应3次重复。
1.7 最适pH的测定
分别配制 pH 6.0、pH 6.5、pH 7.0、pH 7.5、pH 8.0 含有10 μmol/L ZnSO4的1 × PBS上样缓冲液。分别用不同pH值的缓冲液配制终体积为500 μL、浓 度为 200 mg/L 的 青霉素 G(Penicillin G)、哌拉西林(Piperacillin)、头孢曲松(Ceftriaxone)、头孢唑啉(Cefazolin)、头孢吡肟(Cefepime)、美罗培南(Meropenem)。然后在不同pH值的上样缓冲液条件下测定抗生素通过NDM-1酶热传感器产生的热信号(上样时上样缓冲液与配置抗生素的缓冲液一致),并记录反应数据。每个反应3次重复。
1.8 对不同抗生素水解的测定
配制pH 7.0 、10 μmol/L ZnSO4的1× PBS上样缓冲液。用这种缓冲液配置终体积为500 uL、浓度为 31.25 mg/L、62.5 mg/L、125 mg/L、250 mg/L、500 mg/L、1000 mg/L的青霉素、哌拉西林、头孢曲松、头孢唑啉、头孢吡肟、美罗培南溶液。然后将不同抗生素按浓度从低到高的顺序上样NDM-1酶热传感器并记录反应产生的热信号数据。每个反应3次重复。
1.9 统计学分析
使用GraphPad Prism5统计分析,P值<0.05被认为两组间差异显著。P< 0.05、P< 0.01、P< 0.001分别用*、**、***进行表示。
2 结果与分析
2.1 重组NDM-1酶的表达、纯化及活性
得到重组质粒pET-28a-NDM-1并转化BL21大肠杆菌,获得重组菌株进行诱导表达,菌体超声破碎低温离心后取上清进行亲和层析纯化、透析,SDS-PAGE分析结果如图1所示,重组NDM-1酶理论分子量大小为27.9 kDa,在25 kDa标准品条带稍上的位置观察到单一蛋白条带,从分子量大小上证实了重组NDM-1酶的表达。纯化的重组NDM-1酶纯度>95%,浓度为1.8 mg/mL。纯化的蛋白在30℃及含有10 μmol/L ZnSO4的PBS缓冲液中对美罗培南的单位水解活性为108 IU/mg。在相同的反应条件下纯化的NDM-1对美罗培南水解的酶学常数,Km(μmol/L)、kcat(s-1)和kcat/Km(μ·(mol·L-1)-1·s-1)平均值分别为 47、86 和 0.55。这些结果表明纯化的蛋白可高效水解碳青霉烯抗生素美罗培南,具有NDM-1酶典型酶学特征。
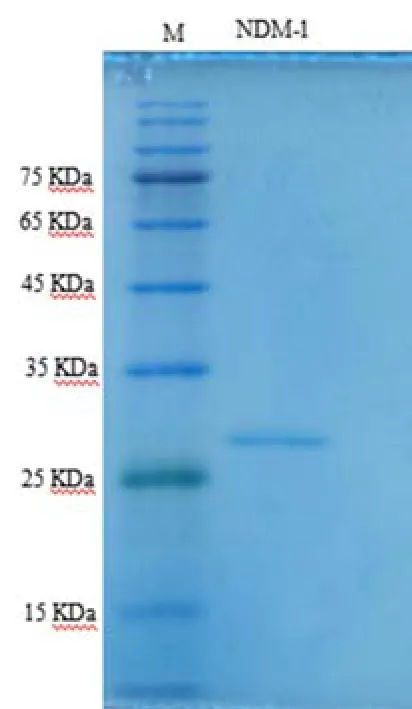
图1 重组NDM-1酶SDS-PAGE图Fig.1 SDS-PAGE analysis of recombinant of NDM-1
2.2 固相后的NDM-1仍很好保持其特征性酶活力
酶通过共价键固相后可能会由于结构的改变而影响其特征性酶学活性。NDM-1酶通过共价交联而固相与CPG玻璃珠上。NDM-1酶是一种金属离子依赖的碳青霉烯酶,其典型的酶学特征是对青霉素类、头孢霉素类及碳青霉烯类抗生素都有很强的水解活性,而且水解活性依赖于Zn2+的存在,根据NDM-1酶的这些酶学特征,分析组装有NDM-1酶柱的酶热传感器在反应液中不存在Zn2+或同时存在Zn2+及其螯合剂EDTA的条件下对500 mg/L哌拉西林(青霉素类)、头孢曲松(头孢类)及美罗培南(碳青霉烯类)的反应活性,发现在没有Zn2+或Zn2+与EDTA共存的条件下,NDM-1酶热传感器对哌拉西林、头孢曲松及美罗培南几乎没有检测活性,而 10 μmol/L ZnSO4则会同时提高 NDM-1 酶热传感器对以上三种抗生素的检测活性(图2)。这些数据表明经过共价固相并组装于NDM-1酶热传感器的NDM-1仍然很好地保持了NDM-1酶特征性酶活性。构建的NDM-1酶热传感器可以被用来进行多种类β-内酰胺抗生素的定量分析。
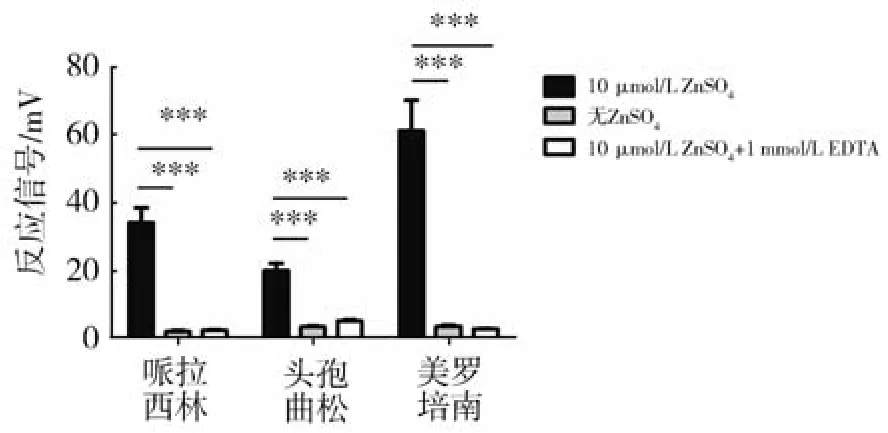
图2 在锌离子存在的条件下,NDM-1酶热传感器对哌拉西林、头孢曲松和美罗培南都表现出高水平检测活性Fig.2 NDM-1 sensor showed high hydrolytic activity to Penicillin G,Ceftriaxone and Meropenem in presence of Zn2+
2.3 应用NDM-1酶热传感器可对β-内酰胺类抗生素进行准确定量分析
本研究以青霉素类的青霉素G和哌拉西林;头孢霉素类的头孢唑啉(一代头孢)、头孢吡肟(四代头孢)和头孢曲松(三代头孢)、碳青霉烯类的美罗培南为代表性的抗生素进行检测。如图3所示,发现在31.25到1000 mg/L的浓度范围内,NDM-1酶热传感分析仪检测到的反应信号随加入的青霉素G、哌拉西林、头孢唑啉、头孢吡肟、头孢曲松、美罗培南的浓度增加而明显增加,且都呈显著线性相关(R2分 别 为 0.9972、0.9715、0.9598、0.9692、0.9596、0.9749)。这表明NDM-1酶热传感器可以在31.25 mg/L~1000 mg/L的浓度范围内对青霉素类、头孢霉素类及碳青霉烯类三大类β-内酰胺抗生素都进行有效定量分析。
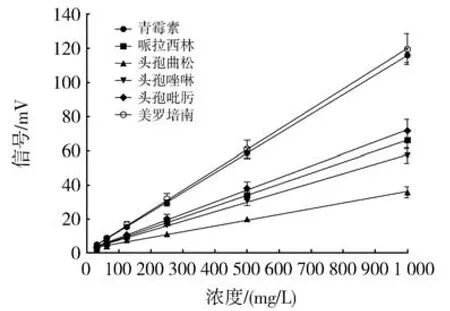
图3 NDM-1酶热传感器对六种不同抗生素的水解反应活性标准曲线Fig3 Calibration curves of response activity of the NDM-1 sensor to hydrolyze six antibiotics
2.4 NDM-1酶热传感器对各种抗生素检测的最优pH值确定
为了探明NDM-1酶热传感器对各种抗生素检测的最优条件,进一步分析在生理pH值附近范围内,NDM-1酶热传感器对200 mg/L浓度条件下各种抗生素的反应活性。发现在pH 6.0~8.0的范围内,NDM-1酶热传感器对青霉素G、哌拉西林、头孢曲松、头孢吡肟及头孢唑啉的反应活性在pH为6.5的条件下显著高于 pH 6.0、7.0、7.5和 8.0(图4AE);对美罗培南的反应活性在pH为8.0的条件下显著高于 pH 6.0、6.5、7.0和 7.5(图4)。这表明:NDM-1酶热传感器对青霉素G、哌拉西林、头孢曲松、头孢吡肟及头孢唑啉的最优检测pH值为6.5;对美罗培南的最优检测pH值为8.0。
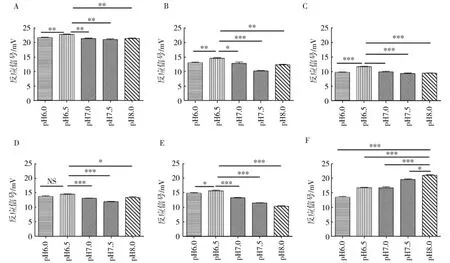
图4 NDM-1酶热传感器在不同pH条件下对青霉素G(A)、哌拉西林(B)、头孢曲松(C)、头孢吡肟(D)、头孢唑啉(E)、美罗培南(F)的反应活性Fig.4 Hydrolysis of Penicillin(A),Piperacillin(B),Ceftriaxone(C),Cefepime(D),Cefazolin(E),Meropenem(F)by the NDM-1 sensor under pH values from 6.0 to 8.0
3 讨论
β-内酰胺类抗生素主要由青霉素类、头孢霉素类、碳青霉烯类及单环类(氨曲南)抗生素组成,由于其抗菌谱广、杀菌作用强而成为目前全球最广为使用一类抗生素。对菌血症等危重症患者在抗生素治疗后进行血药浓度监测对于提高治疗有效率及安全性极为重要,而血药浓度快速检测技术则是保障血药浓度监测及时、有效的重要保证。目前国内外对β-内酰胺类抗生素的血药浓度检测目前还没有商业化可利用的方法,基本均为实验室自建方法[13]。高效液相色谱法串联紫外检测法或串联质谱检测法是当前检测β-内酰胺类抗生素血药浓度的常规方法,检测准确、灵敏性高[14-15],但该方法预处理血浆样品的时间可达几个小时,从而无法满足危重病人抗生素治疗需要快速确定血药浓度并据此及时调整抗生素治疗剂量的需求。因此发展一种可以实现即时(30 min左右)甚至实时的β-内酰胺类抗生素血药浓度检测方法目前仍是一个挑战。
有研究表明通过建立的青霉素酶酶热传感器实现在30 min内对人全血体外加标青霉素进行定量分析[6],因此该技术近期被同行专家评议为有望实现即时(point of care test,POCT)β-内酰胺类抗生素血药浓度检测的技术[13]。本课题组在近期研究中利用青霉素酶酶热传感器观察到阿莫西林(一种青霉素类抗生素)在口服药物者体内血药浓度的动态变化(未发表数据),然而由于青霉素酶本质上对头孢霉素类和碳青霉烯类抗生素水解作用差而使青霉素酶酶热传感器无法广泛应用于β-内酰胺类抗生素血药浓度检测。虽有研究者应用组装有一种金属β-内酰胺酶酶柱的(酶具体种类未知)酶热传感器能在一定程度上提高对碳青霉烯类抗生素亚安培南的检测活性,但该传感器对亚胺培南的反应活性与亚胺培南加入量之间仍缺少显著的线性关系[8],因此也无法适用于对碳青霉烯类抗生素血药浓度的分析。
本研究根据NDM-1酶对头孢霉素类和碳青霉烯类抗生素的强水解活性而组装了带有NDM-1酶酶柱的酶热传感器,该传感器对青霉素类、头孢霉素类和碳青霉烯类三类β-内酰胺类抗生素都具有高水平的反应活性,且严格依赖反应缓冲液中的Zn2+(图2)。这些表明固相后的NDM-1酶没有由于共价交联而改变其特征性酶学品质,这极大地增强了应用该传感器对多种类β-内酰胺抗生素进行定量分析的可行性。尤为重要的是,与前期报道的一种金属β-内酰胺酶酶热传感器不同[8],NDM-1酶热传感器由于对头孢类抗生素和美罗培南的反应活性随着这些抗生素剂量增加而明显线性增大(图3),因此该传感器可有效对头孢霉素类、碳青霉烯类及青霉素类多种类β-内酰胺抗生素进行定量分析。多项来自ICU抗生素治疗研究结果表明在抗生素静脉输液后2小时内美罗培南、亚胺培南、头孢吡肟、头孢曲松及哌拉西林这些抗生素的平均血浆血药浓度在几十mg/L的浓度范围内[16-20]。紫外分光光度法对不同类型的β-内酰胺类抗生素的检测线性范围有所差别,总体来讲检测的浓度都比较低,检测范围为零点几到十几mg/L,而且紫外分光光度法适合对比较纯的样品经行检测,不能用于对血浆等复杂体液的检测[21]。中性羟胺法用于抗生素浓度测定时检测范围为几百到几千mg/L,也不能用于对血浆等复杂体液的检测。而NDM-1酶热传感器有效检测抗生素浓度范围在31.25 mg/L~1 000 mg/L,因此从检测灵敏性上来讲应用该分析仪对ICU危重症患者进行β-内酰胺抗生素血药浓度快速分析理论上可行。此外,本研究最后还确定了NDM-1酶热传感器对各被检测抗生素的最大反应活性pH值(图4),为今后检测不同种类抗生素血药浓度探明了最佳pH值反应条件。
4 结论
本研究应用NDM-1酶热传感器建立了一种可以在较广泛的范围内对青霉素类、头孢霉素类及碳青霉烯类多种β-内酰胺抗生素进行定量分析的新方法。由于酶热传感技术有反应特异性好,基本不受待测样品的浊度和颜色背景的影响的特征。因此该检测方法在β-内酰胺类抗生素血药浓度快速检测,在线检测抗生素发酵液内抗生素浓度等领域将具有广阔的应用前景。

