急性脑梗死患者血清miR-151a-3p、MMP-9、hs-CRP的变化特点及临床意义
李崇祎
(中国平煤神马医疗集团总医院全科医学科,河南 平顶山 467000)
急性脑梗死患者在短期内病情进展的概率较高,病死率及远期致残率等生存预后较差。流行病学研究提示,ACI 的发病率维持在(344~456)/10 万人[1],同时在具有高血压或脑血管动脉粥样硬化人群中,ACI 发病率有进一步上升的趋势。
研究ACI 发病机制发现,不同的生物学因子能够导致脑组织缺血性损伤、加剧氧化应激障碍等,进而促进ACI 患者的生存预后恶化。miR-151a-3p作为非编码RNA,能够通过诱导下游炎症因子的分泌,促进单核细胞对于脑组织神经元细胞的毒性作用,参与到 ACI 的病情进展过程中[2]; MMP-9 的高水平则能够通过诱导间质成分的分解,扩大缺血性梗死的病灶范围[3];而hs-CRP 的水平能够诱导下游炎症信号通路的激活,加剧炎症反应对脑组织神经元完整性的破坏[4]。三者可能对ACI 的发生发展有重要作用[5,6]。为了分析 miR-151a-3p、MMP-9、hs-CRP 与ACI 病情间的关系,本研究选取我院收治的ACI 患者140 例,探讨相关指标的水平及其与患者NIHSS 评分间的关系。
1 资料与方法
1.1 一般资料 选取 2016 年 8 月至 2017 年 8 月间我院收治的 140 例 ACI 患者(ACI 组),另选取70 名同期的健康体检者作为对照组。
140 例 ACI 患者中,男性 82 例,女性 58 例;年龄为 55~83 岁,平均年龄为 62.35±10.62 岁;脑梗死部位为,基底节71 例,脑桥32 例,小脑20 例、颞叶17 例;98 例患者合并有高血压,50 例合并糖尿病,41 例合并高血脂。根据 NIHSS 评分[5],140 例ACI 患者可分为轻型 (NIHSS 评分<4 分)65 例,中型(4 分≤NIHSS 评分<15 分)50 例,重型(NIHSS评分>15 分)25 例。70 名健康对照者中,男性 44 例,女性 26 例;年龄为 52~82 岁,平均年龄为 63.51±10.94 岁。两组患者的年龄、性别比较,差异无统计学意义。
纳入标准:ACI 患者的纳入标准为, ⑴ACI 诊断符合神经内科疾病诊疗指南(第3 版)中的相应诊断标准[6];⑵患者起病后24h 内入院,经头颅CT、MRI 检查确诊为ACI; ⑶入院后未采取手术治疗,在我院神经内科接受保守治疗; ⑷治疗前获得患者家属的知情同意。
排除标准:排除标准为,⑴有颅内占位性病变、动脉瘤者;⑵出血性脑卒中患者;⑶合并肺部感染、严重的冠心病、肝肾功能疾病者;⑷对治疗药物具有严重的不耐受者。
1.2 方法 miR-151a-3p 检测:ACI 组患者均于入院24 小时内,对照组体检时,采集静脉血2 ml,加入 0.3ml 氯仿,室温下震荡 30s,放置 30min,取上层清亮液体移入另一EP 管,加入等体积的异丙嗪溶液,室温放置 30min,1000r/min 离心 10min,取沉淀物为RNA,加入75%乙醇溶液1ml,溶解后1000r/min 离心 10min,取上清液,加入 20μlDEPC 水, 紫外可见分光光度计(赛默飞公司)上测OD 值,计算RNA 浓度,单位为:ug/ul。采用 Invitrogen oligo(赛默飞公司)进行引物设计,采用SuperScript IV 逆转录试剂盒(Invitrogen SuperScript IV 反转录酶 赛默飞公司) 进行 cDNA 合成,β-actin 作为内参,miR-151a-3p 引物上游:CTTTGAGGTGCGTGTTT 下游:CAGTGCTCGCTTAGTGC 。设置 3 组复孔,取平均值,采用相对定量 2~(-ΔΔCt)法计算结果,PCR 仪器购自赛默飞公司。
MMP-9、hs-CRP 检测:ACI 组患者均于入院24 小时内,对照组体检时,采集外周静脉血3~5ml,室温下放置自然分层后抽取上层清亮液体待测。采用电化学发光全自动免疫分析仪 (罗氏E170)及试剂盒(罗氏公司)进行检测。
NIHSS 评分标准: 该量表主要包括了意识水平、凝视、视野、面瘫、上肢运动、下肢运动、肢体共济失调、感觉、语言、构音障碍、消退和不注意11个项目,总分0~42 分,评分越高,患者的神经缺损功能越严重。对患者入院时、入院24h、入院48h 三个时间点分别进行评价,取三个时间点中的最高分作为患者分组的依据。由我院神经内科具有10 年临床经验的2 位副主任医师对患者进行评分,在实施评分之前,均经过对NIHSS 量表的培训,两位医师评分后取平均值作为患者的最终评分。
1.3 统计学方法 采用SPSS 16.0 软件进行数据分析。血清 miR-151a-3p、MMP-9、hs-CRP 等计量数据表述采用(±s)表示,数据正态分布检验采用pp图或者qq 图。两组间计量数据统计分析采用t 检验,三组间比较单因素方差分析(如组间有差异,再采用LSD-t 检验进行两两比较),计数资料的组间比较采用χ2 检验,多因素分析法采用多元线性回归模型;血清 miR-151a-3p、MMP-9、hs-CRP 诊断 ACI 的效能采用 ROC 分析,P<0.05 为差异有统计学意义。
2 结果
2.1 两组的血清 miR-151a-3p、MMP-9、hs-CRP水平比较 ACI 组的血清 miR-151a-3p、MMP-9、hs-CRP 水平均显著高于对照组,差异有统计学意义(P<0.05),见表1。
表1 ACI组与对照组的血清miR-151a-3p、MMP-9、hs-CRP水平比较(±s)

表1 ACI组与对照组的血清miR-151a-3p、MMP-9、hs-CRP水平比较(±s)
组别 例数ACI 组对照组t 值P 值140 70 miR-151a-3p(2-△△ct) MMP-9(μg/L)2.29±0.68 1.26±0.44 11.51<0.01 192.62±44.11 78.23±18.56 20.78<0.01 hs-CRP(mg/L)5.04±2.11 1.39±0.40 14.33<0.01
2.2 不同NIHSS 评分ACI 患者的血清miR-151a-3p、MMP-9、hs-CRP 水平比较 重型 ACI 组的血清miR-151a-3p、MMP-9、hs-CRP 水平均显著高于轻型组、中型组,差异有统计学意义(P<0.05);中型ACI 组的血清 miR-151a-3p、MMP-9、hs-CRP 水平均显著高于轻型组,差异有统计学意义(P<0.05),见表2。
表2 不同NIHSS评分ACI患者的血清miR-151a-3p、MMP-9、hs-CRP水平比较(±s)
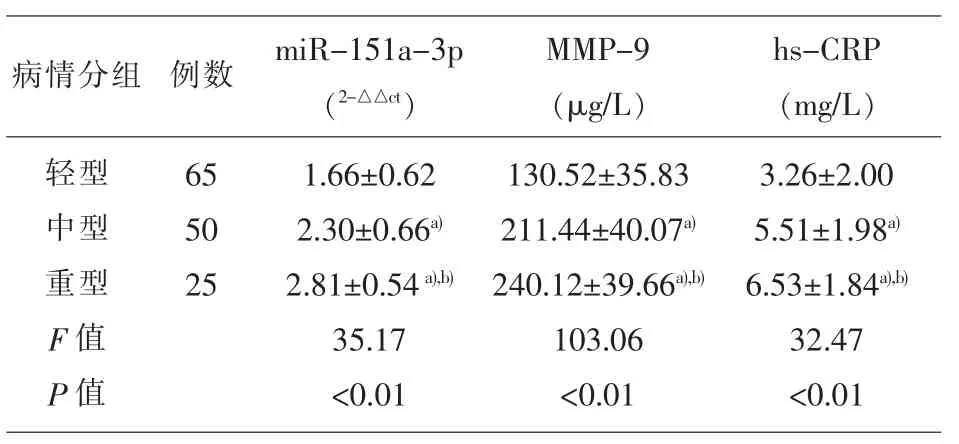
表2 不同NIHSS评分ACI患者的血清miR-151a-3p、MMP-9、hs-CRP水平比较(±s)
注:a):与轻型组比较,P<0.05;b) :与中型组比较,P<0.05
病情分组 例数miR-151a-3p(2-△△ct)MMP-9(μg/L)轻型中型重型F 值P 值65 50 25 1.66±0.62 2.30±0.66a)2.81±0.54a),b)35.17<0.01 130.52±35.83 211.44±40.07a)240.12±39.66a),b)103.06<0.01 hs-CRP(mg/L)3.26±2.00 5.51±1.98a)6.53±1.84a),b)32.47<0.01
2.3 NIHSS 评分与 ACI 患者血清 miR-151a-3p、MMP-9、hs-CRP 水平间的相关性分析 ACI 组患者的血清 miR-151a-3p、MMP-9、hs-CRP 水平与其NIHSS 评分间均呈显著正相关(P<0.05),见表3。

表3 ACI患者NIHSS评分与血清miR-151a-3p、MMP-9、hs-CRP水平间相关性分析
2.4 NIHSS 评分与 ACI 患者血清 miR-151a-3p、MMP-9、hs-CRP 水平的多元线性回归分析 采用多元性线性模型进行分析,NIHSS 评分作为因变量,血清 miR-151a-3p、MMP-9、hs-CRP 水平作为自变量,回归模型显示,miR-151a-3p、MMP-9、hs-CRP 水平升高是ACI 患者NIHSS 评分增高的独立危险因素(P<0.05),见表4。

表4 多元线性回归分析结果
3 讨论
脑血管内皮细胞的病变或动脉粥样硬化等,能够通过促进血栓的形成,促进ACI 的发生。ACI 是指脑血供突然中断后导致的脑组织坏死。通常主要是由于供应脑部血液的动脉出现粥样硬化和血栓形成,使管腔狭窄甚至闭塞,导致局灶性急性脑供血不足而发病;也有因异常物体(固体、液体、气体)沿血液循环进入脑动脉或供应脑血液循环的颈部动脉,造成血流阻断或血流量骤减而产生相应支配区域的脑组织软化、坏死。miRNA 是基因水平调控主要因子之一,参与生物体细胞增殖、分化、凋亡、代谢等生物学过程。外周血miRNA 具有不易降解且检测方法敏感、准确等特点,成为临床疾病潜在的诊断、 病情鉴别的新型标志物。miR-151a-3p 能够调控血脂的代谢,增加低密度脂蛋白水平,促进泡沫细胞等的沉积,增加血管内皮下组织的增生及脂肪化等病理改变,促进粥样硬化斑块的形成及ACI 的发生; 而miR-151a-3p 对于氧化应激过程的调控作用,能够增加氧化自由基对于脑血管内皮的损伤,增加局部血流灌注障碍的发生风险[8]。MMP-9MMP-9 参与了脑组织基质的分解代谢过程中,MMP-9 主要功能是降解和重塑细胞外基质的动态平衡,另外,MMP-9 可通过释放血管内皮生长因子以参与血管生成,其高水平能够导致患者局部脑组织炎症反应范围的扩散,增加缺血再灌注损伤的严重程度[9]。hs-CRP 是反映患者体内炎症反应的重要指标,同时是机体受到微生物入侵或组织损伤等炎症性刺激时肝细胞合成的急性相蛋白,在炎症开始数小时hs-CRP 就升高,48 小时即可达峰值,随着病变消退、组织、结构和功能的恢复降至正常水平,hs-CRP 水平上升能够导致患者体内的单核细胞或中性粒细胞浸润脑组织的风险增加[10]。部分研究结果揭示了ACI 患者体内MMP-9、hs-CRP 水平的变化情况,认为 MMP-9、hs-CRP的高水平是促进病死率升高、 生存预后恶化的重要因素[11,12],但对于二者与患者 NIHSS 评分间关系的研究尚不足,同时对于miR-151a-3p 的分析也不足。
血清学指标检测结果可见, 血清miR-151a-3p、MMP-9、hs-CRP 在 ACI 患者中水平较高,提示了血清 miR-151a-3p、MMP-9、hs-CRP 均影响着ACI 的病情进展过程,相关指标的高水平能够通过影响炎症反应、氧化应激障碍、缺血再灌注损伤等,加剧 ACI 的病情进展[13,14]。miR-151a-3p 的高水平能够加剧炎症信号通路NOTCH 的激活对激活下游炎症因子起到促进作用,从而从而可以间接判断评估脑组织的损伤程度; MMP-9 的高表水平则能够通过影响到脑组织基质成分的代谢,加剧胶原纤维分解,促进基质蛋白降解,从而促进梗死病灶组织的蔓延; hs-CRP 的高水平能够加剧中性粒细胞对于脑组织神经元细胞的浸润,促进神经元细胞的凋亡,导致中枢神经系统功能障碍[15,16]。曹红元等[17]分析了621 例ACI 患者的临床预后,认为hs-CRP高水平与患者的神经功能预后密切相关,同时hs-CRP 水平上升越明显,ACI 患者的病死率越高。分析血清中 miR-151a-3p、MMP-9、hs-CRP 等指标与ACI 患者病情严重程度间关系显示,患者的病情越重,血清中 miR-151a-3p、MMP-9、hs-CRP 等的水平越高,该趋势较为明显。杨泳、江钰等学者的研究表明[18,19],这种关系可能与miR-151a-3p、MM P-9、hs-CRP 指标能反应患者脑组织缺血再灌注损伤过程中侧支循环的建立、 血流恢复速度或炎症反应及氧化应激障碍有关。本研究结果可知,NIHSS 评分与 ACI 患者血清 miR-151a-3p、MMP-9、hs-CRP 水平间的相关关系较为显著,同时危险因素分析也可见,miR-151a-3p、MMP-9、hs-CRP水平上升是ACI 患者NIHSS 评分增高的独立危险因素,进一步提示了 miR-151a-3p、MMP-9、hs-CR P 水平与ACI 患者病情间有着密切的关系。
总之,ACI 患者的血清 miR-151a-3p、MMP-9、hs-CRP 水平显著高于健康人群,且与ACI 患者神经功能受损程度有一定的相关性。

