皮质肌肉相干的影响因素及康复应用
史献乐 徐 瑞#* 王瑶瑶 孟 琳 刘 源 明 东,#
1(天津大学精密仪器与光电子工程学院,天津 300072)
2(天津大学医学工程与转化医学研究院,天津 300072)
引言
近年来,电生理信号的耦合分析已被广泛用于研究神经肌肉控制和异常的神经振荡,成为运动医学和康复工程等领域的研究热点。神经元的振荡耦合和同步放电在人体运动的神经控制中起着至关重要的作用,运动神经系统通过神经振荡传递运动控制信息,而神经中枢通过与各个区域的相互作用实现功能调节和整合。神经损伤可阻止神经振荡的传导,并导致中枢神经系统病变患者的运功能障碍。
脑电信号(electroencephalogram,EEG)和表面肌电信号(surface electromyography,sEMG)分别反映了躯体运动控制信息和肌肉对大脑控制意图的功能响应信息,可以直接表征运动神经系统的功能状态,因此将两者结合,研究脑电和肌电信号特征及其神经振荡耦合关系,不仅可为理解运动控制过程和运动障碍的病理机制奠定理论基础,而且可以为康复运动的功能评估提供重要的生物标记,对于揭示运动康复疗法的神经生理机制和康复运动中的神经系统功能特征具有理论研究和临床应用价值。
通过分析皮层活动和肌肉活动的振荡同步以评价皮层与肌肉功能性连接的方法称为皮层肌肉相干(corticomuscular coherence,CMC),而皮层与肌肉的振荡活动主要体现在脑电与肌电信号中,因此,皮层肌肉相干通常指的是脑肌相干,揭示了在连续的肌肉收缩过程中皮层和肌肉之间的功能连接,这种相互作用代表了运动系统内的信息流,有助于理解大脑如何控制肌肉组织(即下降途径)以及肌肉组织如何对大脑产生影响(即上升途径)。
如今,信号采集技术朝着多样化发展,可以分析通过不同方法采集的不同类型的电生理信号,因此CMC 便有了更广泛的研究空间。文中首先对CMC 的定义及特征进行介绍,然后对影响CMC 的因素进行总结,接着对CMC 在脑卒中与其他运动障碍疾病中的康复运用进行归纳,最后对CMC 的现状进行总结,并对其未来的发展前景进行展望。
1 CMC 的定义与特征
1.1 CMC 的定义
相干性是在频谱上分析两个序列的相关程度,通过交叉谱的归一化获得的,计算公式为
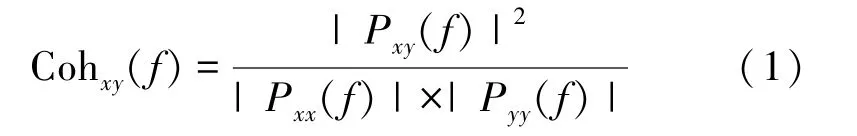
式中,x代表脑电信号,y代表肌电信号;Pxy(f)是信号的交叉谱密度,可表示为Rxy(m)是x,y的互相关序列;m表示互相关序列第m个采样点,Pxy则表示为Rxy的傅里叶系数。Pxx(r),Pyy(f)分别是信号x、y在频率f处的自谱密度,将相干性的值归一化处理后,其值始终在0 到1 范围之内,其中1 代表了两个信号完全相干,是一种理想状态,0 代表两个信号完全不存在相干性。
脑肌相干指的是大脑活动时的脑电信号和肌肉收缩时的肌电信号节律活动之间的线性耦合,可用来探索大脑皮层的脑电信号与表面肌电信号的关联性,又称皮质肌肉相干性。CMC 是一种公认的锥体通路完整性的测量方法,代表了运动皮层参与特定输出的指标[1],所以CMC 在感觉运动整合中起着至关重要的作用,是实现适当的运动控制的关键机制。
如今,国内一些学者在式(1)基础上将计算方法进行了改良。针对脑电和肌电信号是跨时频尺度耦合的特点,以及相干估计算法对数据平稳性的要求,提出了一种基于多元经验模态分解的相干分析方法[2]和基于时频谱估计的小波相干性分析方法[3]。考虑到神经肌肉信息流的传递是双向的,而传统的皮层相干分析并不能确定耦合的方向性,Gao 等[4]提出利用不同大脑功能区的脑电信号和动作相关的肌电信号,实现了相干函数对脑肌信号的双向耦合分析。Liang 等[5]提出了一种时滞最大信息系数方法,来准确识别EEG 和EMG 之间的信息流方向和强度,以此来揭示运动过程中的运动控制和反应机制。这些研究结果为探索基于CMC 的运动信息解码和运动功能障碍分析提供了依据。
1.2 CMC 的频率分布特征
大脑皮层和肌肉之间的振荡活动通常以不同的频带出现,已有许多研究发现了脑电与肌电信号在特定频段的相干性,并证明了大脑与肌肉之间的功能联系。而不同的频带代表大脑皮层和脊髓之间神经通讯的不同模式。因此,频率是CMC 的一个重要的特征。本小节将主要从α(8 ~12 Hz)、β(13~30 Hz)和γ(30~60 Hz)等3 个频带阐述。
CMC 被认为是一种有效的感觉运动整合过程,在运动控制中起着功能性作用。特别是α 频带的CMC 与感觉反馈信息有着很强的关系。一项通过CMC 来评估帕金森(Parkinson′s disease,PD)和衰老对行走过程中皮质肌肉交流的影响的研究发现,与健康老年人相比,PD 组的CMC 值在α 频带明显低于健康对照组,可能表明PD 感觉反馈异常和感觉运动整合受损[6]。同样,患有震颤的PD 患者在α频带上表现出更高的皮质-肌肉相干性,这一发现也表明了感觉运动皮层在帕金森小幅度姿势性震颤的产生中起着直接的作用[7]。
β 频带的相干性是众多学者研究的重点,越来越多有关CMC 频率的研究表明,β 频率范围内的皮质活动与脊髓运动神经元的放电行为有关。早在20世纪90年代,Conway 等[8]便运用MEG 技术发现人类主要感觉运动皮层(sensorimotor cortex,SMC)与稳态收缩过程中的EMG 信号在有限频带频率上是一致的,相干性的峰值主要存在于皮层活动的β范围内(15~35 Hz),这为皮层神经元参与运动神经同步化的产生提供了进一步的证据。随后Baker等[9]以猴子为实验对象,发现了与上述相同的结论,即这种β 范围的振荡会使皮质和肌肉振荡之间的相位关系保持恒定。近几年来,EEG 技术在信号采集与信号处理方面得到了迅速发展,使CMC 有了更广阔的研究空间。Ushiyama 等[10]量化了EEG 与胫骨前肌(tibialis anterior,TA)在稳态收缩时EMG之间的相干性,发现CMC 的峰值通常在健康受试者皮层活动的β 波段内观察到,如图1所示,但是在α频带和γ 频带中并未发现,即在稳态收缩中,CMC的峰值广泛存在于β 频段。
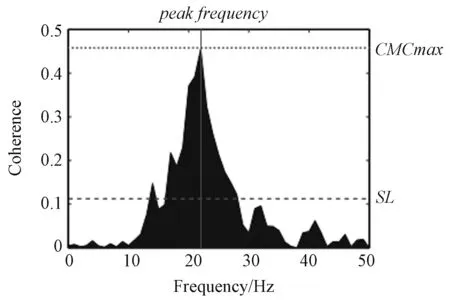
图1 在β 波段内观察到CMC 峰值[11]Fig.1 CMC peak observed in the β band[11]
相比于与稳态力收缩有关的β 带的CMC,γ 频带的EEG-EMG 相干性则与更强的肌肉力量的产生有关[12]。例如,Ushiyama 等[13]发现,在胫骨前肌由弱到中等强度的等距收缩中,CMC 也随着肌肉力量水平的增加而由β 频段振荡转换到γ 频带。由此表明,中枢神经系统会调节皮质肌肉耦合的频率,以发挥所需的肌肉力量水平。此外,Omlor 等[14]评估了在视觉运动任务中周期性调制的力(正弦力)产生过程中的脑电图-肌电相干性,在动态力的输出下,与β 波段相比,γ 波段的相干性会大大升高,可能是由于动态力的输出需要分配更高的注意力,需要视觉和体感信息更加复杂和持续的动态整合,因此也伴随着高频率的皮质脊髓振荡。
2 影响因素
频率是CMC 的一个重要特征,但是影响CMC幅值的因素尚未明确,对其影响因素进行分类和比较,可以更具体地了解CMC 的机理。总结前人的研究[15],从目前来看,影响皮质肌肉耦合的因素主要有作用力水平[16]、年龄[17]、病理状态[18]等。
2.1 作用力水平对CMC 的影响
维持肌肉力量的稳定是日常活动的一项重要能力,皮质肌肉相干能够阐明与个体稳定肌力能力相关的神经机制[19]。当前,有关CMC 的大多数研究是在不同的频率频带下研究不同的力级。其中,最大自主收缩力(maximal voluntary contraction,MVC)是限制常用力水平的标准。
在健康个体中,通过脑磁图观察受试者在用食指和拇指控制杠杆过程中运动皮层与手部肌肉之间的一致性,发现在15~30 Hz 范围内CMC 水平会随着肌力的增强而升高[20],这表明CMC 的强度依赖于肌力的输出。Fu 等[16]研究了不同MVC 水平下的CMC 的相干性。结果显示,在静态任务和动态手指移动任务中,CMC 的振幅有随着力的增加而增加的趋势,并且CMC 主要集中在β 频段。Lim[21]和Ushiyama 等[11]的研究均可证实稳定力伴有β 范围的CMC。Rong 等[22]发现握力增加时,感觉运动皮层会减少γ 波段的通讯以维持稳定。此外,也有研究认为,随着力的增加,CMC 有向γ 范围转移的趋势,Ushiyama 等[13]使胫骨前肌以10%~70%的MVC进行自主收缩,如图2所示。随着胫骨前肌收缩力水平的逐渐增加,CMC 出现的峰值逐渐从β 频带转移到γ 频带,其中在中度收缩水平时出现了两个明显的相干峰,这说明,随着力收缩水平的增加,皮质节律活动也显著增强。但是CMC 的振幅有所降低,这可能与诱发的肌肉疲劳有关[23]。由此可见,力的输入水平与CMC 频带密切相关。对CMC 向高频范围移动的合理推测为:在力稳定上升过程中,感知运动系统可能会依靠更高和更大CMC 频率范围来产生稳定的皮质脊髓相互作用[19]。同时,中枢神经系统会调节皮质肌肉耦合的频率,以发挥所需的肌肉力量水平。

图2 不同收缩力水平下CMC 出现的频带[13]。(从左至右收缩力水平依次为10%MVC、40%MVC、70%MVC)Fig.2 The frequency band of CMC at different levels of contractility[13].(The level of contractility from left to right is 10% MVC, 40% MVC, 70%MVC)
虽然已有研究指出,在静态和动态的低水平力等距补偿过程中,在β 范围中会发生皮层同步[16],但是β 范围内的同步过程在何种程度上随着力的增加而改变尚不清楚。针对这一问题,Chakarov等[24]的研究结果支持如下观点,即β 频带的CMC并非仅针对低水平静态力,是随动态力水平的升高而线性增加的,如图3所示。也就是说CMC 是高水平动态同步的过程,以便在力水平升高时产生稳定的皮质脊髓相互作用。这一发现加强了β 范围EEG-EMG 相干在感觉运动整合中的重要性。
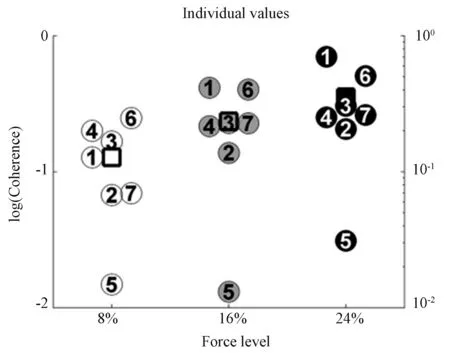
图3 15-45 Hz 内的7 位受试者在不同肌力下的CMC 的值[24]Fig.3 CMC values of 7 subjects within 15-45 Hz under different muscle strength[24]
2.2 年龄对CMC 的影响
年龄是影响运动过程中皮质肌肉交流的重要因素之一。大量研究报告了中枢神经和肌肉系统中与年龄相关的结构和功能退化的事实,这明显增加了运动功能障碍发生的可能。因此,皮质肌肉沟通的变化可能与年龄有关,这些变化包括运动神经元和灰质体积的减少[25],突触密度和神经递质水平的降低以及皮质内和皮质间抑制异常等[26]。随着年龄的增长,身体系统的退化也逐渐明显,而在该系统中,神经、肌肉和肌肉骨骼系统的退化直接影响运动功能和生活质量。
众所周知,在衰老过程中,大脑内部与运动功能相关的结构是有所变化的。James 等[17]对从婴儿期到成年的受试者进行了CMC 的比较,发现儿童与成年人相比,在运动发育过程中有着显著差异。此结论与Graziadio 等[27]的发现类似,即从儿童到中年的年龄,β 范围的CMC 随年龄的增加而增加,但到高龄却没有增加。Johnson 等[28]再次证实了这一发现,他们讨论了单边精细运动任务以及同时进行的运动和认知任务期间的CMC,要求参与者使用食指将力量从零增加到最大。这项研究的结果显示,与年轻对照组相比,老年人的β 波段CMC 较低。对此结果的合理解释即为高龄人的随意肌力有着明显的衰退,从而使得肌肉激活的阈值有所提高[29]。除此之外,研究还发现儿童和老年人比年轻人有更大的分布网络,这可能与年轻人和老年人在神经策略上的差异有关,如老年人在初级运动皮层之外的皮质区域的激活[30]。
虽然CMC 随着年龄的增长而变化,但是对于在青少年和老年人受试者中CMC 与力的关系却没有得到直接的比较。为此,Bayram 等[31]同时记录了老年人和年轻人的肱二头肌和肱三头肌在自主运动期间的EEG 和EMG 信号,来计算运动过程中的CMC。如图4所示,与年轻人相比,在所有测得的力水平下,老年人的CMC 明显减弱,并且CMC 与施加的力成正比。这表明老化过程中,大脑信号与目标肌肉之间的功能连接有所减弱或受损,这种损伤可能揭示了与年龄相关的运动能力的下降。同时,CMC 和肌力成比例关系的发现证实了Kilner 等[20]之前的报告,即CMC 在15 ~30 Hz 范围内随着肌力水平的增加而增加。这种线性关系表明CMC 可作为老年人和年轻人最大肌力输出的客观指标或预测指标。此外,老年人的衰老无力是神经和肌肉损伤的结果。例如,高龄者会表现出神经缺陷,导致最大程度地激活其肌肉的难度增加[32],这也符合肌肉衰老的自然规律。
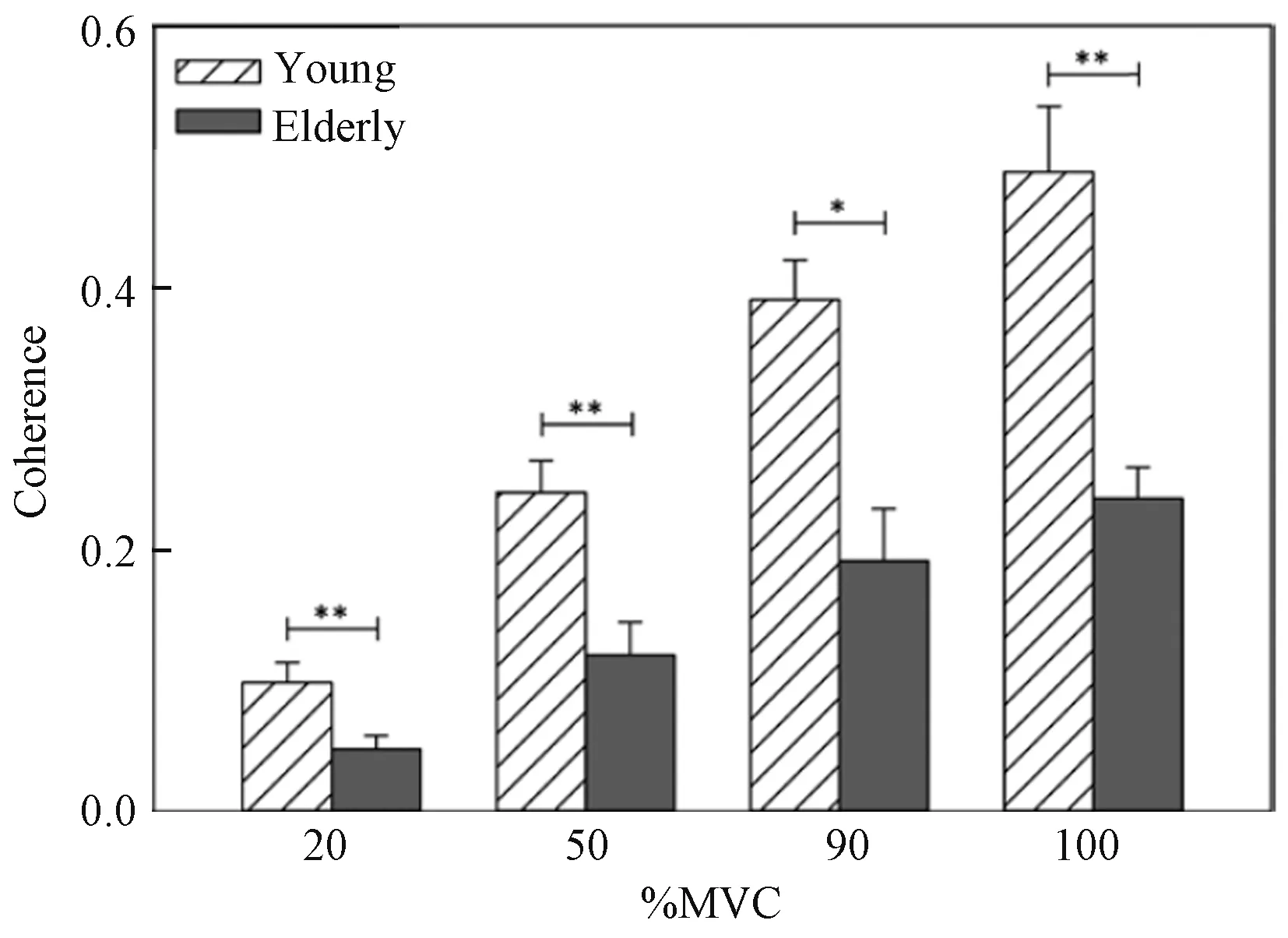
图4 年轻人与老年人在不同力水平下的CMC[31]Fig.4 CMC between young and old at different strength levels[31]
2.3 病理状态对CMC 的影响
由于健康人与患者在生理状态上有所差异,例如,神经系统受损,运动功能障碍等,都会导致CMC的不同。因此,健康人与患者的差异可被归结为病理状态对CMC 的影响。
比较健康受试者和运动障碍患者的CMC,为探索运动损伤对皮质肌肉耦合的影响以及CMC 的临床实践提供了可能。由于神经传递功能的损伤,健康受试者的CMC 水平要高于患者,已有很多研究发现了这一结论。在脑卒中患者中,中风导致中枢运动通路发生改变后,脑电图相干性也会发生变化。例如,Mima 等[18]评估了中风受试者对侧和同侧运动皮层之间的皮质肌肉功能连接,指出患者的皮层命令与相应肌肉活动之间的功能耦合要显著低于健康受试者,并且CMC 通常出现在对侧运动皮层,认为大脑与肌肉的直接功能连接起源于对侧运动皮层。同时与健侧相比,患侧的CMC 显著降低,表明在强直性收缩期间,中枢运动通路在EEG-EMG相干性的产生中扮演了重要角色。与此结果类似的是,Fang 等[33]通过获取健康受试者与中风患者的前三角肌和肱肌在执行伸手任务时的EEG 与EMG,发现在β 和较低的γ 范围内,卒中患者的的CMC 显著低于健康参与者。Gao[34]、Nielsen 等[35]也都证实了这一点。卒中患者的CMC 降低提示着大脑的运动控制中心与目标肌肉之间的通讯受损。这些发现均表明,与健康人相比,卒中患者的运动功能障碍会导致较差的EEG 和EMG 信号的整合及沟通能力,这是因为中风会中断控制运动的神经网络,也可能与患者运动区域的过度激活及半球之间异常的激活转移有关[36]。而为了保持感觉运动功能的塑性重组,中风患者的CMC 峰值皮质位置的分散程度要比健康受试者大得多[37]。在其他类疾病中也有类似发现。例如,震颤患者的β 频段的CMC的值处在置信水平之下[38],脑瘫患者γ 频带的CMC 要比健康人低[39]。
病理状态对CMC 的影响不仅体现在健康受试者有着较高的CMC 水平,还体现在其峰值在频段上也有所差异。健康受试者的CMC 峰值通常出现在β 频段,而帕金森患者的CMC 峰值一般出现在α 波段[7]。不仅如此,受试者的CMC 强度也会有所改变[40]。但是,CMC 强度会随着肢体运动功能的恢复而增加[41]。
3 CMC 在运动障碍方面的应用
健康人与患者之间CMC 的比较研究表明,CMC最直接的临床应用就是运动康复。从目前来看,CMC 研究关注的患者类型主要为脑卒中。这种运动障碍疾病影响着患者的生活、工作,给家庭造成沉重负担。目前,对此类疾病的康复评定主要以定性评价和半定量评价为主,所以如何规范的评价此类疾病的康复成为越来越多学者的研究重点。而通过对EEG 与EMG 相干的研究,可以更系统的解释运动控制过程及运动障碍的病理机制,同时也为神经康复的运动功能评价提供新的方法。
3.1 CMC 在脑卒中康复中的应用
脑卒中,又称“中风”,是一种急性脑血管疾病,分为出血性和缺血性脑卒中,具有发病率高、死亡率高、致残率高、复发率高等特点[42]。中风后的运动障碍主要由脊髓下行的损伤引起,这种损伤使大脑失去对四肢的控制,严重影响患者的生活质量,给患者的生活造成极大的不便。皮质-肌肉相干性被认为是卒中后运动缺陷的潜在生物标志物,可以对恢复进行量化,并可能指示参与功能恢复的皮质区域[41]。加强对脑卒中后不同区域如何参与运动恢复的了解,将有助于在康复计划中更好的针对这些区域,因此在中风患者中尝试CMC 实验非常普遍。
有证据表明,中风后的功能恢复涉及到不同的皮质区域来取代受损区域的功能。例如正电子发射断层成像(positron emission tomography,PET)扫描观察到感觉运动皮层和两个顶叶的脑血流量增加[43],功能性磁共振成像(functional magnetic resonance imaging,fMRI)也显示,在相同的运动区域及同侧半球之间中风患者比健康参与者有更大的激活[44]。而脑卒中后运动恢复中皮质区域的广泛参与可能与中风后生物分子的大量释放有关。
先前的研究表明中风患者的CMC 要显著低于健康受试者[18]。经颅磁刺激(transcranial magnetic stimulation,TMS)和脑磁图(magnetoencephalogram,MEG)检查的康复良好的患者中也发现与健康受试者相比,卒中患者的CMC 显著降低的相似结果[37]。此外,在高度受损的患者和功能恢复良好的中风患者中均发现CMC 的峰值存在于对侧半球[41],直接表明了对侧半球的大脑区域参与了中风患者的患侧肌肉的活动。虽然这些研究已经证明了中风后受试者的CMC 强度比健康人弱,但仍然尚不清楚皮层耦合是否会随着运动功能的恢复而增强,以直接反映卒中后四肢的运动功能状态。为此,Krauth 等设计腕部伸展实验,确定了健康参与者在手部运动的对侧皮层的β 频率范围内的EEG-EMG 相干性,并在缺血性中风患者运动恢复中观察到了这一标记物的发展。CMC 在最初的急性恢复期是最小的,随着时间的推移逐渐增加,β 频率范围内的EEGEMG 相干性也逐渐增强,甚至会达到比健康参与者更高的水平,如图5所示。此外,它的分布不同于在健康参与者中所发现的,CMC 在受损半球和对侧中均可观察到,并分布在β 范围内更多的频带和更大的皮质区域。相比之下,在涉及慢性中风的一项研究中,在腕部伸展过程中只有受损半球出现CMC[45]。这两种不同的结果可能是因为在卒中后的急性期,病变附近的皮质区域暂时承担了运动功能,以弥补皮质作用的缺失。而在康复过程中,皮质区域可能会再次恢复到与健康参与者相似的空间格局。
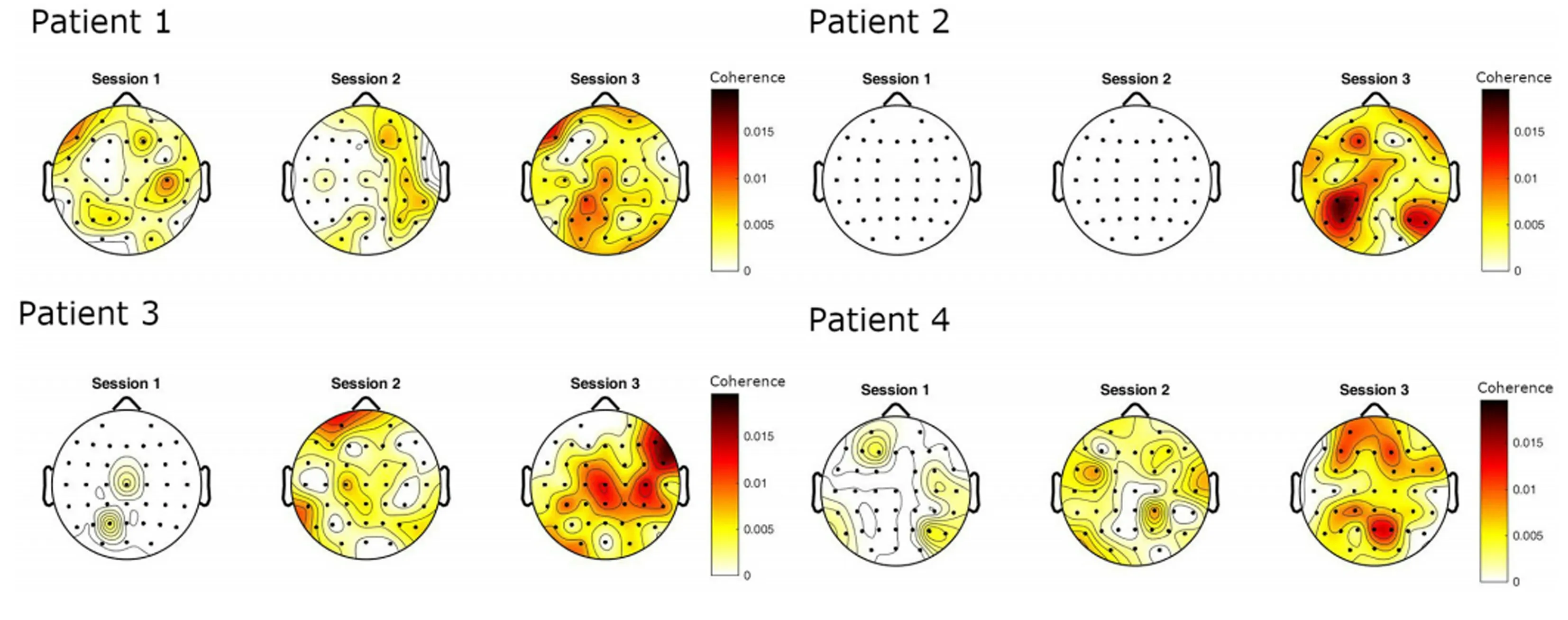
图5 4 名卒中患者在运动康复的3 个时间点(session1,session2,session3)的β 频段的CMC[45]Fig.5 The CMC of the β band of four stroke patients at the three time points(session1,session2,session3)of sports rehabilitation[45]
除了上述上肢研究,马培培等[46]分析了中风患者和健康人下肢膝关节"屈"、"伸"运动中脑、肌电相干性。同样发现了类似的结果,如图6所示,γ 频段患侧显著相干面积随着运动功能的康复有增大的趋势,健、患侧显著相干面积的差别也出现了逐渐减小的趋势(横轴1~4 表示4 个不同的康复进展时间,不同颜色的折线代表不同的受试者)。这表明,CMC 能够有效描述患者健侧与患侧的脑肌电相干性差异特征。这些结果与von Carlowitz-Ghori[47]和Belardinelli[48]的发现类似,即中风患者从急性期到慢性期以及经过4 周的康复治疗干预后,CMC 的值都有显著升高,同时Belardinelli 还发现行为的改善与CMC 同时发生。这些发现为康复过程运动功能的评价提供了基础,由此进一步说明CMC 可以用来描述卒中患者运动功能的康复状态。
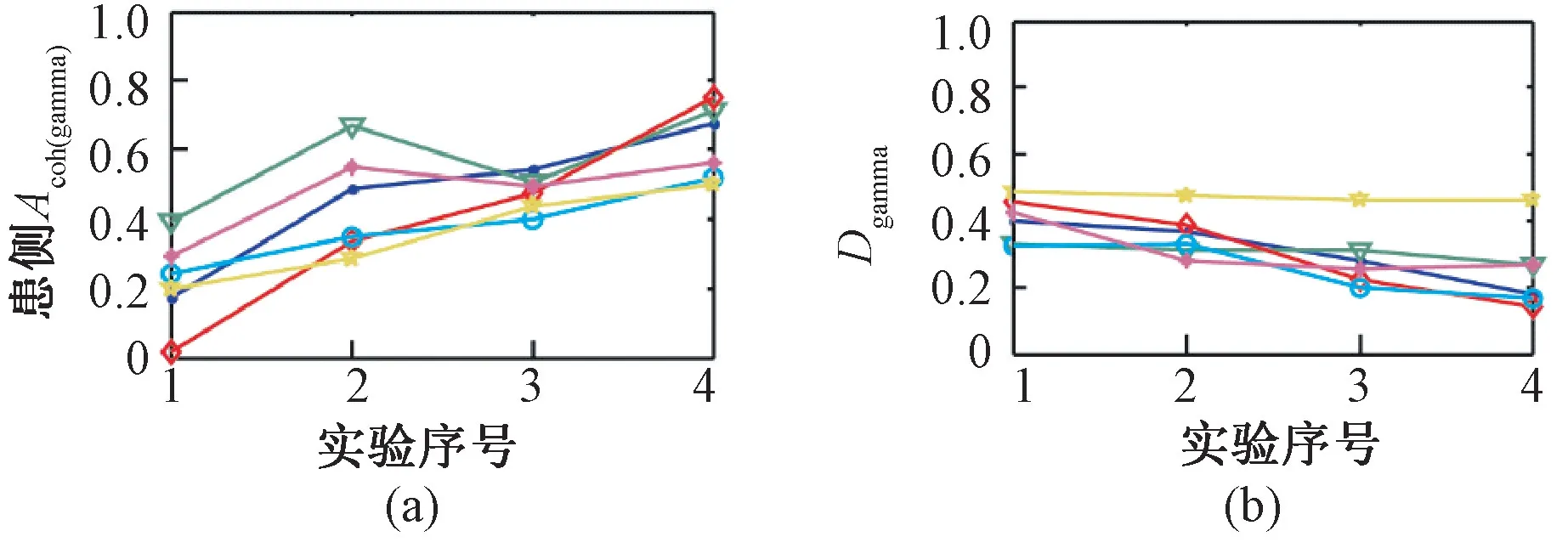
图6 患者患侧相干性指标在康复过程中的变化[46]。(a)患者患侧γ 频段CMC 显著面积指标(b)患者健、患侧γ 频段的显著CMC 面积差Fig.6 Changes of the coherence index of the patient′s affected side during the rehabilitation process[46].(a)Significant area index of γ band CMC on the affected side of the patient.(b)Significant difference in CMC area between healthy and affected side
除了评估卒中恢复过程中的康复指标外,CMC还被用于分析不同类型的卒中患者(慢性卒中和急性卒中)。通过追踪恢复过程,Larsen 等[49]研究了慢性和急性卒中的CMC,结果显示急性卒中健侧CMC 幅度在恢复中有所增加,患侧的CMC 频率降低,但慢性卒中CMC 参数在半球间没有差异。有学者认为,在急性和慢性卒中阶段,皮层皮质与肌肉相互作用的动态变化可能是CMC 临床应用的特征参数。
CMC 不仅可以用于患者的康复过程,还可以用于健康人的健康检查,例如,如果CMC 在一段时间内出现异常变化,则可能存在皮质脊髓束变性的风险,及时诊断有助于预防此类疾病。
3.2 CMC 在其他运动障碍疾病中的应用
除了脑卒中疾病,CMC 也被视为是评估其他运动障碍类疾病的一种指标,如帕金森病。
帕金森病是一种慢性、退行性、进行性疾病,主要症状是运动迟缓、肌肉僵硬、震颤、姿势和平衡不稳[50]。CMC 作为初级运动皮层与周围肌肉之间功能耦合的神经生理指标,被用作早期PD 症状变化的指标。例如,Roeder 等[51]发现与年轻人相比,老年人和PD 参与者在低β 频(13 ~21 Hz)处的CMC和EMG 功率显着降低,低β-CMC 的降低表明在双重支持阶段,老年人对脊髓运动神经元的皮质输入减少。而在最近的帕金森病研究中,丘脑底核(subthalamic nucleus,STN)的深部脑刺激(deep brain stimulation,DBS)具有改善运动症状和使病理改变的振荡正常化的作用。当DBS 启动时,β 带CMC 升高,这可能是患者等轴收缩的表现改善的简单表征。还有学者指出,DBS 改善了帕金森氏震颤,使震颤手的10~30 Hz 范围的CMC 幅度有所增加[52]。与此结果相似的是,8 例患者在植入DBS 后平均8 d 的研究中发现,在DBS 期间CMC 略有升高[40]。因为DBS 可能通过调节基底节区运动环路和运动神经元的适当同步而起作用,故DBS 下的CMC 可被用于追踪帕金森患者的康复情况。
脑瘫(cerebral palsy,CP)也是一种运动障碍疾病,可能会影响肌肉收缩以及运动皮层和相对肌肉之间的神经连接。CP 影响了正常的肌肉活动,例如自主收缩力的降低[53]。Riquelme[39]等比较了在CP患者和健康受试者的手部动作计划和执行过程中的CMC,从结果来看,CP 患者的特征是通过CMC分析改变了功能耦合,并且CMC 可以考虑作为探索早期脑损伤期间缺陷的工具。
4 存在问题及展望
虽然CMC 在康复领域已有一些研究与进展,为患者的康复进程预测奠定了基础,但是CMC 仍存在一些问题。
首先,在大多数的实验中都会遇到个体差异性问题,即并不是所有人都能表现出显著的相干性。Xu 等[54]在研究神经电刺激对中风患者的运动康复能力的影响时发现在13 个受试者中,有4 名患者无论是电刺激前还是电刺激之后都未出现显著的相干性。关于受试者之间CMC 差异最简单的解释就是,个体之间皮层神经元的同步放电趋势不同[55]。相干性越高,表明EMG 与激活皮层神经元的同步性越高。而皮层细胞群放电的同步趋势可能会调节EMG 的分组放电程度,因此也可能解释了个体间EEG-EMG 相干幅度的差异性。
其次,为了得到一个较为准确地结果,需要实验范式的大量试次的重复,这就需要较长的实验时间。例如,Matsuya 等[56]的实验。对于健康受试者来说,可能简单易行,但是对于有运动障碍的患者来说,无疑加大了实验的难度,并带有一定的风险,并且也有可能会造成受试者的肌肉疲劳,而肌肉疲劳也会影响CMC 的强度,从而在一定程度上会影响实验结果的准确性。
除此之外,有关CMC 的研究仍有需要改进与探索之处:1)采集高质量的脑电信号。脑电信号极其微弱,在采集过程中易受环境、执行动作等的影响。受试者可以佩戴便携式电极帽进行采集,最大程度的减小因头部移动而造成的伪影,以提高EEG 的精度。2)当前大多数的研究集中在了脑电信号与单块肌肉之间的功能耦合,对于多块肌肉的协同作用与EEG 之间的信息交流的研究相对较少,未来可增加此方面的探索,以更好地解释人类在运动控制中的神经机制。
已有研究充分证明,CMC 可作为一种生物标记物追踪脑卒中患者的康复进程,并且在衡量帕金森、脑瘫等疾病治疗效果上显示出巨大的潜力。在临床研究中,医师可将CMC 这一生理参数与临床量表进行综合分析比较,为患者提供更全面的康复评估。在此基础上,将CMC 的研究拓展到EEG 与多块肌肉的功能耦合分析上[57],以此来表征大脑对一组肌肉的神经运动控制策略,采用脑地形图等方法明确大脑各区域与某一组肌肉的相干性的大小,从而制定更精准的康复计划。此外,结合其他脑-脑与肌肉-肌肉等之间的相干性参数,运用信息融合等分析方法,建立高效全面的康复评估模型,以期为运动障碍类疾病的研究提供全新的视角和手段。
就目前的研究发现来看,CMC 一个重要的特征就是频率分布,并且受到作用力水平、年龄以及受试者的病理状态等多方面因素的影响。近些年来,CMC 在康复领域也得到了应用。当前,大多数的研究集中在了脑卒中患者的康复评估,同时在帕金森等运动障碍类疾病方面也有一定的进展。
虽然有关CMC 的研究已取得了一定的进展,但是仍存在一些不足,使得CMC 尚不能广泛应用于临床预测。未来的研究应以更新颖的实验方案、更精密的算法来不断地弥补不足。总之,CMC 的研究还处于初级阶段,不仅在CMC 其本身的影响因素方面,而且在患者的康复和临床中都需要进一步的探索。可以预见,随着现代科学技术的快速发展,未来的研究与挑战集中在更深入地了解皮层和肌肉活动之间的关系以及在康复领域和临床领域中的应用,使CMC 更好的造福于患者。

