水果发酵液中甲醇含量的测定分析
◎ 杨 潇,周 唯,张 燕
(1.合肥师范学院化学与化学工程学院,安徽 合肥 230601;2.华中科技大学生命科学与技术学院,湖北 武汉 430074)
在发展中国家,水果由于高产以及缺乏适当的保存和运输方法,常常产生大量的固体废弃物[1]。这些水果处理中的废弃物大多来自家庭厨房和食品工业[2],且此类固体废弃物包含大量有机物质[3],采用传统处理方法处理会带来严重的环境污染和健康威胁。从环保的角度出发,人们需要发展合适的新废弃物处理技术以更好地利用有机垃圾,减少其污染[4-6]。有机食品废弃物的特点是具有化学复杂性、易降解性、高含水量及富含营养物[7],这就使其可以通过发酵生产高附加值产品。全球对于从有机废弃物中获得生化产品的技术发展关注正与日俱增[8]。
水果和水果垃圾发酵原液,又称为酵素,是由水果或其果渣、果皮等通过与糖、水混合发酵的产物[9]。取材于新鲜水果的发酵原液完整保留了水果中的有益营养成分,能够长期保存,避免了新鲜水果在自然环境中的腐败变质而引起的环境污染。而取材于水果处理废弃物的发酵原液,也称为垃圾酵素,是一种多功能无毒杀菌清洁剂,能够净化空气,改善环境,可用于有机农业等环保事业中。因此,发酵原液的制备和利用能有效促进有机固体废弃物的循环利用。
制备发酵原液的过程中往往伴有醇类的产生。其中,甲醇对人体的伤害很大,通常在口服甲醇8 ~36 h 后人体就可产生头痛、头晕、乏力等症状,甚至痉挛,昏迷,死亡等[10],即使少量甲醇也能引起慢性中毒[11-13]。因此,在发酵原液的发酵过程中,需要监测甲醇的含量,以确保发酵原液在食用和使用上的安全性。
甲醇的检测方法有很多,如分光光度法、色谱法等[14]。分光光度法是利用物质的分子或离子对特定波长光的选择吸收作用,对物质进行定性、定量及结构分析。此法因操作简单、效率高、选择性好、灵敏度、精密度及准确度高等特性而得到广泛应用[15]。
到目前为止,对水果发酵原液发酵过程中甲醇含量变化的研究较少。基于此,本研究采用分光光度法[16]以品红-亚硫酸法[14]测定水果发酵液中的甲醇含量。在前期研究中,笔者对甲醇含量的测定条件进行了优化,得到了发酵液中甲醇含量的测定条件如下[17]:吸收波长为590 nm,氧化时间10 min,显色时间25 min。
研究分别用新鲜的苹果(作为新鲜水果)和香蕉皮(水果垃圾)为原料,以红糖、糖蜜和糖浆为糖原制备不同的发酵液。在为期3 个月的发酵过程中,对不同发酵液中的甲醇含量进行测量,通过分析甲醇含量的变化,比较不同糖原对发酵过程的影响,为选择最适合的糖原提供理论依据。同时,确定发酵原液的安全性,为水果发酵原液的应用和质量控制奠定基础。
1 材料与方法
1.1 实验材料与仪器
1.1.1 原料
苹果、香蕉皮、糖蜜、糖浆、红糖和矿泉水(市售)。
1.1.2 试剂
高锰酸钾(AR,国药集团化学试剂有限公司)、磷酸(85.0%,西陇科学股份有限公司)、草酸(AR,西陇科学股份有限公司)、硫酸(95.0%~98.0%,西陇科学股份有限公司)、碱性品红(AR,天津市津北精细化工有限公司)、亚硫酸钠(AR,西陇化工股份有限公司)、盐酸(36.0%~38.0%,西陇科学股份有限公司)、甲醇(AR,上海振兴化工一厂)、无水乙醇(AR,江苏强盛功能化学股份有限公司)、蒸馏水(AR,北京桑翌实验仪器研究所)和活性炭 (AR,天津市登科化学试剂有限公司)。
1.1.3 仪器与设备
721 型系列可见光分光光度计(上海菁华科技仪器有限公司)、79HW-1 恒温磁力搅拌器(江苏金坛市金城国盛实验仪器厂)和分析天平(舜宇恒平仪器)。
1.2 实验方法
1.2.1 溶液的配制
高锰酸钾-磷酸溶液:准确称取3 g 高锰酸钾,加入15 mL 85%磷酸溶液及70 mL 水的混合液中,待高锰酸钾充分溶解后用水定容至100 mL;草酸-硫酸溶液:准确称取5 g 无水草酸(H2C2O4),按照(1 ∶1)的比例溶于硫酸中,定容至100 mL;品红-亚硫酸溶液:称取0.l g 碱性品红,仔细研磨后加水(80 ℃) 60 mL,边加水边研磨使其溶解,待其充分溶解后吸取上清液滤于100 mL容量瓶中,冷却后加10 mL(10%)亚硫酸钠溶液,1 mL 盐酸,定容至100 mL,放置过夜;甲醇标准溶液:准确称取1.000 g 甲醇(相当于1.27 mL)置于预先装有少量蒸馏水的100 mL 容量瓶中,定容至100 mL。此溶液甲醇浓度10 g·L-1;甲醇标准应用液:吸取10 mL 甲醇标准溶液置于100 mL 容量瓶中,定容,此溶液甲醇含量1 g·L-1;60%无甲醇无甲醛的乙醇:取300 mL 无水乙醇,加高锰酸钾少许,振摇后放置24 h,蒸馏,最初和最后的1/10 蒸馏液弃去,收集中间的蒸馏部分即可;10%亚硫酸钠溶液:称10 g 亚硫酸钠固体,溶于90 mL 的蒸馏水中。
1.2.2 标准曲线的绘制
标准曲线的绘制,实验步骤如下:
(1)用移液管精确吸取0 mL、0.20 mL、0.40 mL、0.60 mL、0.80 mL 和1.00 mL 甲醇标准应用液(相当于0 mg、0.2 mg、0.4 mg、0.6 mg、0.8 mg 和1.0 mg 甲醇)分别置于25 mL 具塞比色管中,各加入0.5 mL 60%无甲醇无甲醛的乙醇。
(2)于标准管中各加水至5 mL,混匀,各管依次加入2 mL 高锰酸钾-磷酸溶液,混匀,氧化时间为10 min(自加第一管始计时)。
(3)各管加2 mL 草酸-硫酸溶液(自加第一管起每管间隔30 s),混匀后静置,使溶液褪色,放置15 min(自加第一管始计时)。
(4)立即依次加入5 mL 品红亚硫酸溶液,每管间隔30 s,混匀,于20 ℃以上静置,静置时间为25 min (自加第一管始计时)。
(5)用2 cm 比色杯,以零管调零点,于590 nm处测吸光度(每管间隔1 min)。
(6)记录实验数据,绘制标准曲线,见图1。1.2.3 发酵原液的制备
(1)准备好材料:水果(苹果和香蕉皮)、水、糖原(红糖、糖浆、糖蜜)。
(2)将水果∶糖原∶水分别按照质量比3 ∶1 ∶10 的比例放入发酵罐中,并盖好发酵罐盖,保证罐内是一个密封的环境,以利于发酵的进行。
1.2.4 发酵液中甲醇含量的测定
取1 mL 待测液于25 mL 具塞比色管中,然后加水至5 mL,混匀后加入2 mL 高锰酸钾-磷酸溶液,混匀,静置,放置时间10 min。然后加入2 mL 草酸- 硫 酸溶液,混匀后静置,使溶液褪色,放置15 min。再立即加入5 mL 品红亚硫酸溶液,混匀,于20 ℃静置。静置显色时间25 min。用2 cm 比色杯,以零管调零点,于590 nm 处测吸光度。将待测液测得的吸光度与标准曲线比较定量。在发酵过程中,按照上述方法每10 d 测量一次发酵液中甲醇的含量。整个测定过程时间为100 d。
2 结果与分析
品红-亚硫酸法[18]是应用于粮食发酵酿酒中测定甲醇的国家标准方法,酒精发酵过程与水果发酵过程有着类似之处,因此,研究采用品红-亚硫酸法测定发酵液中的甲醇含量。
2.1 甲醇的标准曲线
依据实验1.2.2 对标准含量甲醇样品溶液进行甲醇含量测定,得到甲醇含量标准曲线如图1 所示。
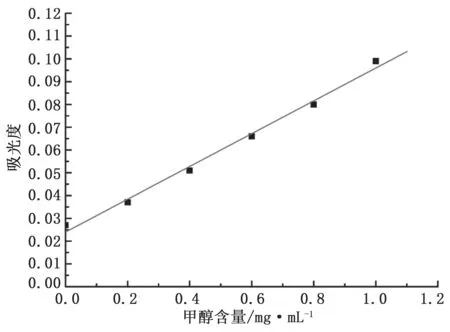
图1 甲醇溶液的标准曲线图
由图1 可知,在0 ~1.0 mg·mL-1浓度范围内甲醇标准溶液的吸光度与甲醇含量成正比,其线性方程为:y=0.072x+0.024,即:A=0.072c+0.024。其中,c 为甲醇浓度,单位为mg·mL-1,A 为吸光度,单位是Abs。相干系数R2=0.992 6,偏差较小,因此该标准曲线线性方程可用于甲醇含量的测定计算。
2.2 发酵过程中甲醇含量的变化
在发酵液的原料选择上,研究选用了日常生活中较为常见的苹果作为水果食用酵素的原料,由于制备的苹果发酵液以食用为主,在糖原的选择上,选用了红糖、糖蜜和果葡糖浆。研究选用香蕉皮作为水果垃圾酵素的原料,香蕉皮发酵液以日常生活使用为主(非食用),因此,研究选用红糖和糖蜜制备香蕉皮发酵液的原料。
由实验1.2.4,对不同发酵液进行甲醇含量的测定,时间为100 d,每间隔10 d 进行一次甲醇含量测定。由测得的吸光度根据甲醇标准曲线得到甲醇的相应含量,测定结果如图2 ~图6 所示。
如图2 所示,香蕉皮红糖发酵原液中,甲醇含量从第10 d 开始下降,第30 d 后有所上升,40 ~50 d变化不明显。第50 d 后增加,第70 d 甲醇含量达到峰值。80 d 之后甲醇含量持续下降至接近为0 mg·mL-1。这一变化主要与香蕉皮的成分及其发酵过程有关。香蕉皮中除水分外,主要含有糖类、少量蛋白质、脂肪、酚类、维生素及矿物质[19-20]。
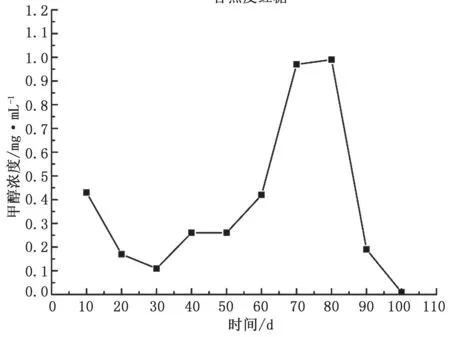
图2 香蕉皮红糖发酵原液中甲醇含量与测量天数的关系图
糖类物质中,主要含有果胶、膳食纤维和多糖[21],其中,果胶含量较高[22],果胶质是甲醇生成的基础[23]。发酵前期,甲醇由香蕉皮自身所含少量果胶酶分解果胶产生[24-26],甲醇含量在达到低峰值后逐渐降低。发酵30 d 后,香蕉皮逐步水解,香蕉皮自身所带菌群微生物代谢产生果胶酶,且含量逐渐增加[27-28],发酵产生的果胶酶进一步分解香蕉皮中的果胶产生甲醇[25-26]。果胶质分解加快使得甲醇含量增加并达到峰值。之后,果胶含量因分解逐渐下降,甲醇含量也持续下降至痕量。
如图3 所示,香蕉皮糖蜜发酵液中的甲醇含量在40 d 左右就达到峰值,50 d 后略有起伏,之后下降至痕量。

图3 香蕉皮糖蜜发酵原液甲醇含量与测量天数的关系图
有所不同的是,香蕉皮糖蜜中甲醇含量的峰值时间较香蕉皮红糖提前了30 d。两种发酵液均由香蕉皮发酵。其发酵变化的不同可能是由于糖原的不同导致的。因为糖蜜中含有大量的可发酵糖及发酵所需的生物素,是微生物进行发酵的理想复合原料[29]。糖蜜的存在加速了香蕉皮发酵液中微生物的代谢,使大量果胶酶的产生时间提前,因此经由果胶酶分解果胶得到的甲醇含量在第40 d 即达到峰值。值得注意的是,在第60 d,仍有一个甲醇含量的小高峰,这可能是由于糖蜜自带杂菌引起的[30],不同菌群的竞争使其代谢速度不同,在第50 d 后仍有少量菌群参与代谢产生少量果胶酶,引起甲醇含量的略微增加,并在第60 d 后持续下降。
如图4 所示,苹果红糖发酵原液中甲醇含量在第10 d 即达到峰值,峰值出现时间早,之后呈波动变化直至含量下降。与香蕉皮不同,在苹果中所含有的可溶性糖、有机酸、酚类、维生素和矿物质中[31-32],可溶性糖含量较高,其中果糖含量最高,占可溶性糖的43.7%~55.7%[33],较高的糖含量有利于微生物的代谢,使苹果红糖发酵液在发酵初期即经由微生物代谢产生果胶酶,果胶酶分解苹果中的果胶产生甲醇[34],果胶酶含量的增加使得发酵液中的甲醇含量增加[35],促使甲醇在第10 d 就达到峰值。不同峰值的波动可能是由于不同菌群的代谢所致。70 d 以后,苹果中果胶含量因分解而下降,使甲醇含量逐渐降低至微量。
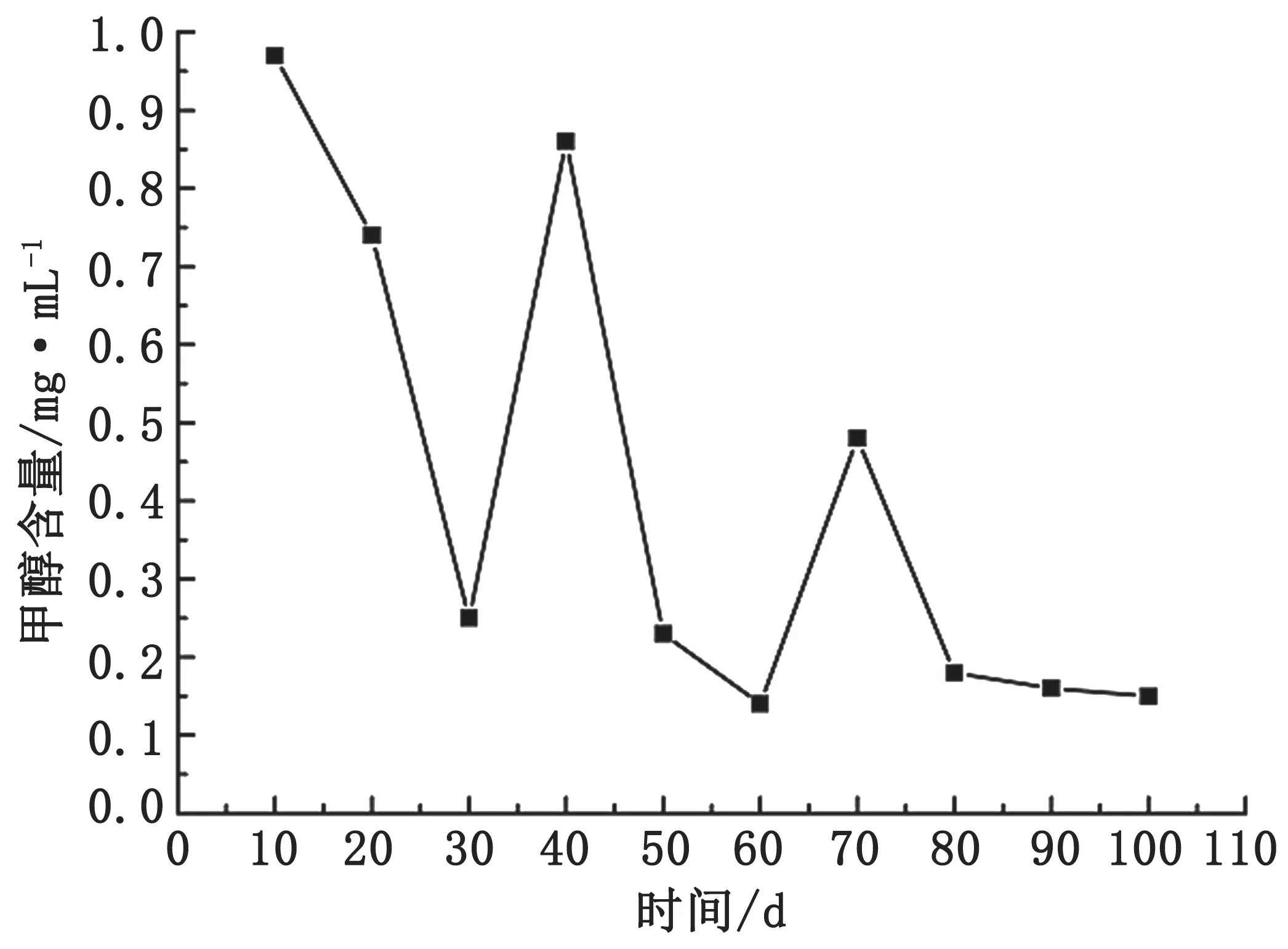
图4 苹果红糖发酵原液甲醇含量与测量天数的关系图
如图5 所示,苹果糖蜜发酵原液中甲醇含量的变化与苹果红糖中的变化类似,呈现波动的趋势。所不同的是,苹果糖蜜的甲醇含量峰值出现时间较晚,在第40 d 左右。之后持续下降在60 d 达到低点,然后上升,到第70 d 达到第二峰值,之后下降并有微小波动。主要原因可能是糖原的不同对发酵过程产生的影响。与红糖相比,糖蜜对于以苹果为原料的液体发酵似乎在前期有所抑制,甲醇含量在前30 d 并不高,这有可能是糖蜜中自带的杂菌对苹果自身微生物菌群代谢产生了抑制[26]。随着发酵天数的增加,微生物代谢逐渐活跃,发酵产生果胶酶,在第40 d 时,在果胶酶的促进下甲醇含量达到峰值[34]。在发酵90 d 后,甲醇含量仍有微小上升,说明苹果糖蜜发酵液在90 d 后仍未完全稳定。

图5 苹果糖蜜发酵原液甲醇含量与测量天数的关系图
如图6 所示,苹果糖浆发酵原液中甲醇含量随测量天数呈现波动变化,其中在第70 d 左右甲醇含量达到最大值,之后持续下降。甲醇最大值出现时间比苹果红糖与苹果糖蜜发酵液要晚,这是发酵基质和糖浆共同作用的结果。由于糖浆的主要成分是葡萄糖和果糖,两者都属于单糖,能被酵母直接利用,发酵速度快,含量较高的单糖糖原参与发酵在一定程度上抑制了前期甲醇的大量产生[26,35]。发酵过程中,糖原的消耗以及不同菌群代谢,使甲醇含量呈现波动性变化,总糖浓度的降低促进果胶酶的产生[26],使甲醇含量在第70 d 达到峰值。而70 d 以后,发酵液中果胶质含量的下降使甲醇生成量减少,甲醇含量逐渐降低。
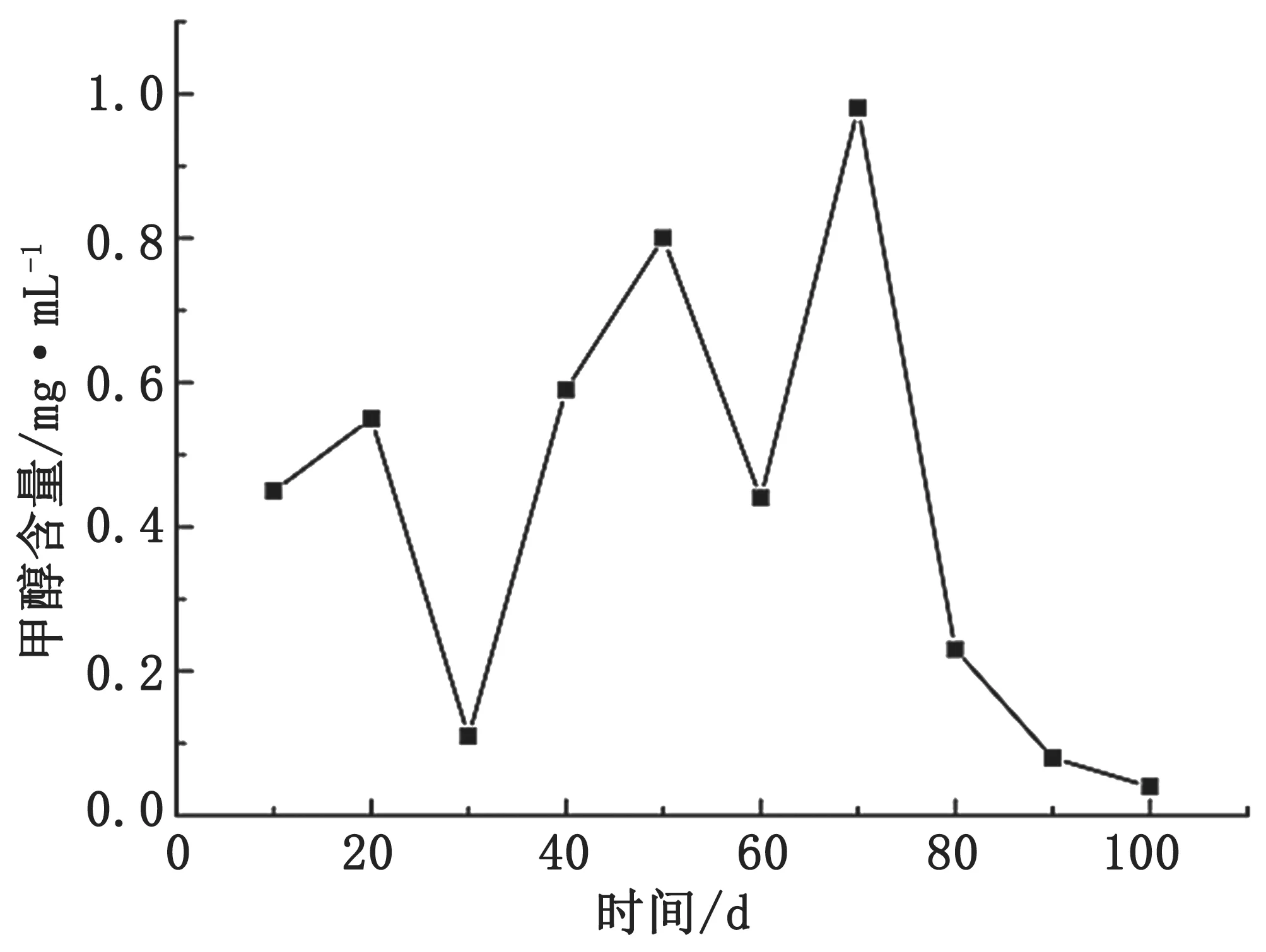
图6 苹果糖浆发酵原液甲醇含量与测量天数的关系图
2.3 不同发酵液的比较
由图2 ~图6 可知,5 种水果发酵液中的甲醇含量变化并不相同。以香蕉皮红糖和苹果红糖发酵液为例(如图2 和图4 所示),在糖原相同的情况下,由于发酵基质的不同,甲醇含量随时间的变化趋势有所不同,香蕉皮发酵过程中甲醇含量先升后降,苹果发酵过程中甲醇含量呈波动性变化。这主要是由于香蕉皮和苹果的成分不同及其各自所带菌种的不同引起的。
同时,不同糖原对发酵液的影响也不相同。由图2 和图3 可知,对于红糖和糖蜜作为糖原的两种香蕉皮发酵液,以糖蜜为糖原的发酵原液发酵速度较快,其中的甲醇含量也相对较低,因此,糖蜜适宜作为日用香蕉皮发酵液的糖原。
由图4 ~图6 可知,以红糖、糖蜜和糖浆作为糖原的不同苹果发酵液中,红糖发酵液的发酵速度最快,糖蜜发酵液发酵速度最慢,糖浆发酵液发酵速度在前两者之间。发酵100 d 时,苹果糖浆发酵液的甲醇含量最低。因此,果葡糖浆作为食用苹果发酵原液的糖原更为适用。
2.4 发酵液甲醇含量的安全性分析
图7 为100 d 的发酵过程中,5 种发酵原液的甲醇含量最大值(以下简称为MMax)。其中香蕉皮糖蜜的MMax最低,其他4 种MMax值相当。发酵过程中,5 种发酵液的MMax均不超过1 mg·mL-1。目前,我国对饮品中的甲醇含量没有统一的国家标准,依据国家卫生标准,甲醇含量最大量不能超过2 g·L-1(按100%酒精度折算),即2 mg·mL-1[36-37]。欧洲传统果酒中甲醇的限定量在10 g·L-1[38]。图7 中的横线为我国甲醇限定量,如图所示,5 种发酵原液的MMax均低于甲醇限定量,即在发酵过程中,甲醇含量始终低于甲醇限定量。因此,5 种发酵液在发酵过程中的甲醇含量都是安全对人体无害的。
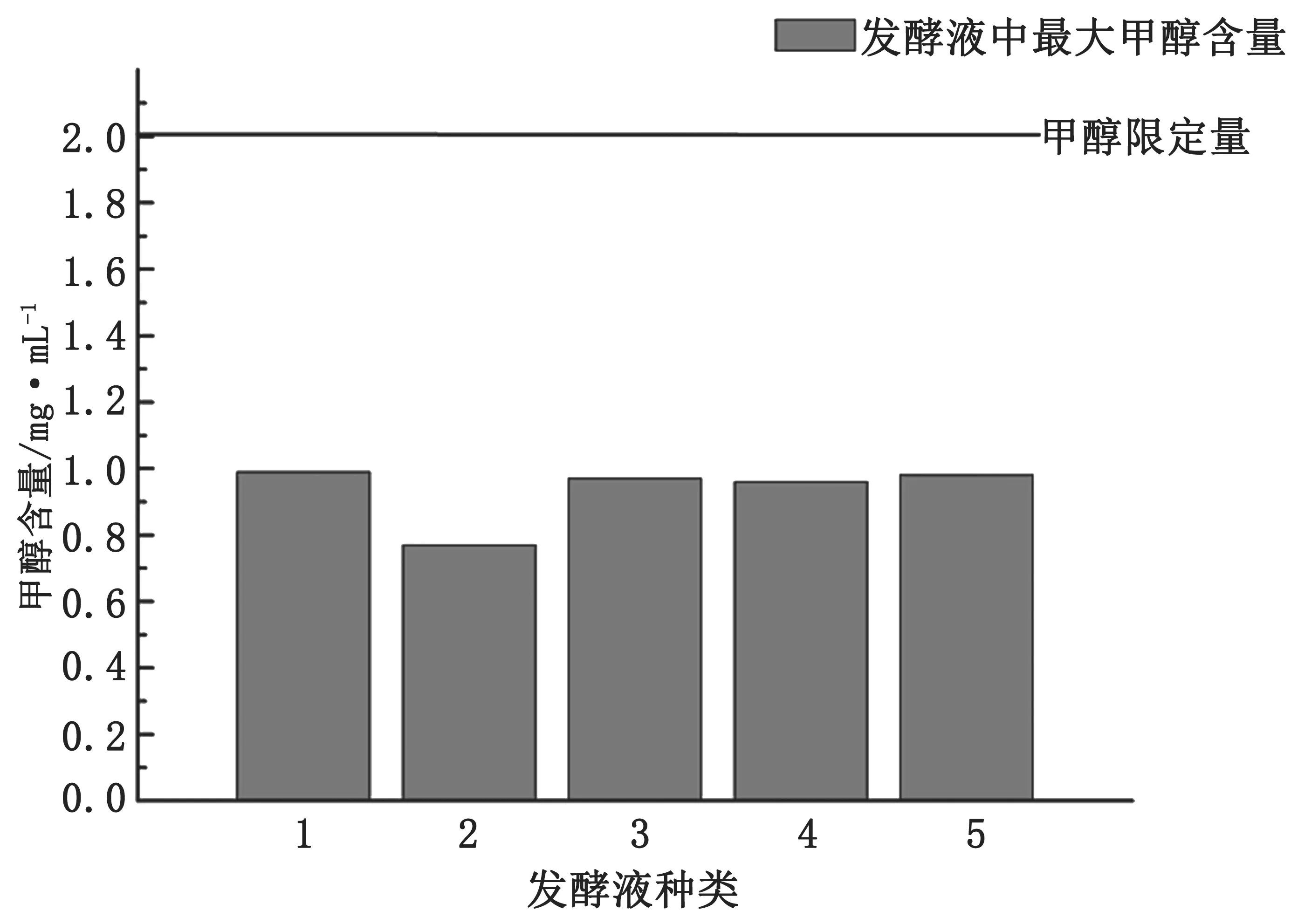
图7 5 种发酵原液甲醇含量最大值图
图8 是在发酵第90 d 和100 d 时的发酵液中的甲醇含量。如图8 所示,发酵90 d 后不同发酵液中的甲醇含量均未超过0.2 mg·mL-1,远低于甲醇限量值 2 mg·mL-1。由此可知自酿发酵液发酵90 d 后的甲醇含量是安全的。
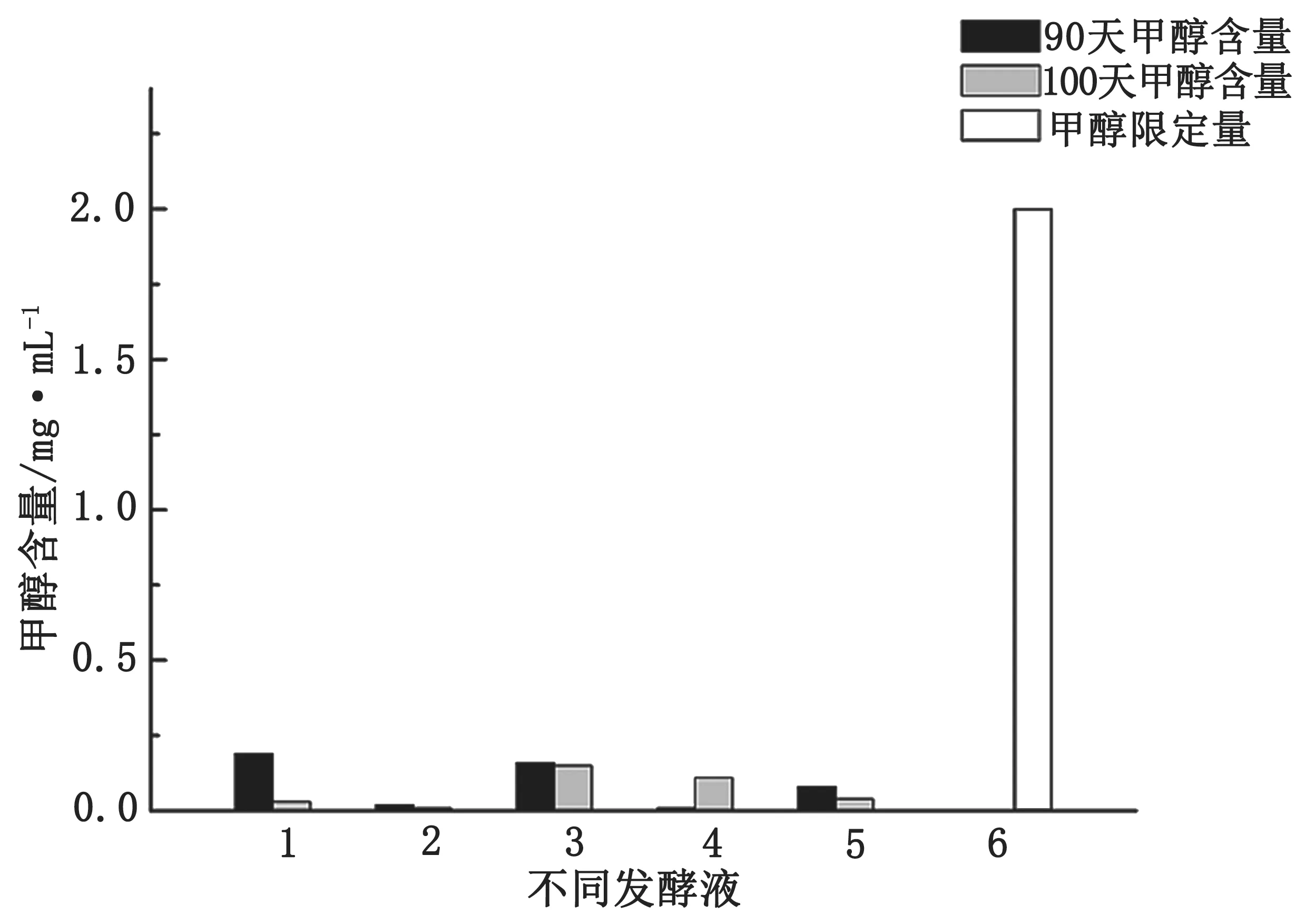
图8 90 d 和100 d 时发酵液中甲醇含量图
3 结论
本研究利用分光光度法以品红-亚硫酸法测定水果发酵原液在100 d 发酵过程中甲醇含量的变化。由甲醇含量变化得出,对于香蕉皮制作的垃圾酵素,糖蜜适宜用作糖原。对于苹果发酵液,果葡糖浆更适于作为糖原。苹果发酵液发酵过程中甲醇含量的波动性变化反映出苹果自酿发酵液中多菌群存在的可能性,在后续研究中可以对其微生物组成作进一步分析。
发酵过程中,5 种发酵液的甲醇含量均未超过国家卫生标准规定限定量2 g·L-1,且发酵90 d 后均未超过0.2 mg·mL-1,因此可知这5 种发酵液的甲醇含量是安全的。苹果及香蕉皮发酵液原料易得,有其独特的食用和使用价值。发酵液的制备充分利用了水果废弃物香蕉皮和食品工业副产物糖蜜,是真正减少排放,实现有机固体废弃物综合利用的环保途径。

