松果菊苷对大鼠抑郁模型线粒体损伤的修复作用
岳凌峰马 敬王 宁
(1.新乡医学院第二附属医院精神四科,河南 新乡 453002; 2.新乡医学院第二附属医院心境障碍科,河南 新乡 453002; 3.新乡医学院第二附属医院精神三科,河南 新乡 453002)
目前,随着中国老年人口数量日益突出,人们的健康问题已经从传染性疾病逐渐转变为慢性疾病,如高血压、糖尿病和抑郁症等[1]。 抑郁症是一个重要的公共卫生问题,它会增加其他疾病的发病率、自杀风险增加、身体、认知和社会功能下降,最后增加死亡率[2]。 目前抗抑郁药临床上已应用很多,如抗惊厥药、神经阻滞剂、单胺氧化酶抑制剂等,但这些药物容易对人体产生副作用[3]。 因此迫切需要寻找疗效确切,毒副作用小的抗抑郁药物。松果菊苷(echinacoside, EA),又名淫羊藿苷,从肉苁蓉中分离出的一种活性物质,化学成分是苯乙烷苷。 松果菊苷具有广泛的生物活性,如清除自由基、抗氧化和抗炎作用[4]。 研究表明,松果菊苷可改善5-Fu 抑制的小鼠的骨髓造血功能[5];松果菊苷可以改善心肌细胞缺氧/复氧损伤[6];松果菊苷通过抑制淀粉样蛋白沉积,改善淀粉样β 肽引起的记忆障碍和胆碱能缺陷[7];基于胃肠道代谢,松果菊苷具有改善抑郁症症状的作用[8]。 但松果菊苷对抑郁症的具体作用机制还未见报道。 本文旨在研究松果菊苷对抑郁症模型大鼠的影响,以期为松果菊苷临床应用治疗抑郁症提供参考。
1 材料和方法
1.1 实验动物
50 只4 ~6 周龄清洁级雄性Sprague Dawley(SD)大鼠,140~150 g,购自中国科学院实验动物中心[SCXK(沪)2015-0004]。 实验前一周,大鼠可以自由获得食物和水来适应环境。 均饲养于新乡医学院第二附属医院动物中心SPF 环境[SYXK(豫)2018-0014],饲养环境保持在温度22℃左右,相对湿度约55%~60%,12 h 昼夜交替。 本研究通过新乡医学院第二附属医院动物伦理委员会动物伦理审查(IACUC-20190205-03),实验过程中依照3R原则给予所有动物人道主义关怀。
1.2 主要试剂与仪器
EA(货号:S3783)购自Selleck chem,母液用DMSO 配制,使用时用生理盐水稀释;聚丙烯酰胺凝胶配制试剂盒(货号:CUS531)、PVDF 膜(货号:ISEQ00010) 和 ECL 化学发光试剂盒(货号:WBKLS0500)购自美国Millpore 公司;氟西汀购自美国Sigma-Aldrich;膜蛋白、核蛋白和胞质蛋白抽提试剂盒(货号:NO.C510002)购自上海生工生物工程公司;Drp1(货号:ab56788)、p-Drp1(货号:ab193216)兔多克隆抗体购自英国ABCAM 公司;辣根过氧化物酶标记山羊抗兔IgG(货号:sc-2004)购自美国Santa Cruz 公司;大鼠IL-6(货号:D6050)、IL-1β(货号:201-LB-005)、TNF-α(货号:210-TA-005)和IL-10(货号:M1000B)ELISA 试剂盒购自美国R&D Systems 公司;丙二醛(Malondialdehyde,MDA)(货号:A003-1-2)、乳酸脱氢酶(lactate dehydrogenase,LDH)(货号:A020 - 2 - 2) 和超氧化物歧化酶(Superoxide dismutase,SOD)(货号:A001-3-2)试剂盒购自南京建成生物技术研究所;TUNEL 细胞凋亡检测试剂盒(货号:C1091)购自上海碧云天生物技术公司;MultiskanTMFC 酶标仪(货号:1410101)购自美国Thermo Fisher 公司;BX43 显微镜购自日本Olympus;ChemiDoc MP 化学发光成像系统(货号:1708280)购自美国Biorad 公司。
1.3 实验方法
1.3.1 动物分组及模型制备
50 只大鼠首先在笼子里饲养,(5 只大鼠/笼)可自由取食物和水3 d,以适应昼夜节律。 将大鼠随机平均分为对照组和抑郁模型组。 对照组大鼠正常饲养,密度为5 只/笼。 抑郁模型组大鼠饲养密度为1 只/笼,采用Willner 报道的方法构建抑郁模型[9]。 模型组的大鼠受到14 类型的不同刺激,包括颠倒白天/黑夜(24 和48 h),重复45 度倾斜鼠笼(每隔4、12 和24 h),断水(6 ~12 h),缺食物(12 ~24 h),噪音(金属冲突2 h 和大鼠大声叫嚷2 h),湿垫,外来异物,无垫(6 h),尾巴夹紧(轻微),同笼,水平振动,笼子交换和喂养环境变化。 每只大鼠每天接受一种方法的刺激,且第2 天不重复,并在笼子里单独饲养35 d。 从第4 周开始,观察总指标(体重、饮料量和食物量)和糖水摄入量百分比。 将20只对照组大鼠随机分成对照组和单纯EA 组:腹腔内注射EA 30 mg/(kg·d),连续35 d;将30 只模型组大鼠随机分成模型组、治疗组和氟西汀组:治疗组腹腔内注射EA 30 mg/(kg·d),氟西汀组灌胃氟西汀20 mg/(kg·d)[10],连续35 d;对照组和模型组注射等量的DMSO。
1.3.2 糖水偏好实验(Sucrose preference test,SPT)
让大鼠习惯于饮用两瓶1%蔗糖溶液24 h,第2天用清水更换其中1 瓶蔗糖溶液。 经过24 h 后禁食、禁水后,允许大鼠饮用1%的蔗糖溶液(100 mL)和等量的水3 h。 糖水偏好指数%=蔗糖水消耗量/(纯水消耗量+蔗糖水消耗量)×100%。
1.3.3 ELISA
取各组大鼠血清,96 孔板布局,绘制标准曲线。标准浓度是以1 ∶3稀释的最高标准。 用标准曲线测定样品浓度。 根据说明书操作步骤,反应孔加入样品50 μL,37℃孵育40 min,洗涤液洗涤3 次,每次2 min,然后加入生物素标记的抗体37℃避光孵育30 min,洗涤3 次后加入链霉亲和素混匀,37℃避光孵育30 min,最后加入显色剂避光显色15 min,加入终止液终止反应,终止反应后于酶标仪450 nm 处检测IL-6、IL-1β、TNF-α 和IL-10 吸光值。
1.3.4 HE 染色
将各组大鼠脑海马区组织进行石蜡切片,厚度为4 mm,用二甲苯脱蜡,梯度乙醇脱水,苏木素染色,水洗,盐酸乙醇分化,水洗蓝化,伊红染色,梯度乙醇脱水,二甲苯透明,中性树胶封片,在显微镜下观察组织并拍照。
1.3.5 TUNEL 染色
将各组大鼠脑海马区组织切片进行脱蜡、水合、透明处理,在标本上分别加入TUNEL 反应混合液,加入盖玻片反应1 h, 随后用PBS 溶液漂洗3次,加入DAB 底物反应10 min 后漂洗3 次后用荧光显微镜观察凋亡细胞形态。 TUNEL 阳性细胞核在镜下呈现棕色,正常细胞为蓝色。 于荧光显微镜下随机选取5 个视野统计TUNEL 阳性细胞及细胞总数,细胞凋亡率(%)= TUNEL 阳性细胞/总细胞数×100%。
1.3.6 流式分选检测线粒体膜电位
将各组大鼠脑组织细胞接种于6 孔板后用PBS清洗3 次,孵育24 h,加入JC-1(5 μg/mL)室温避光反应30 min。 用流式分选仪检测,记录红色和绿色荧光强度。
1.3.7 Western blot
根据说明书,提取脑组织中细胞质蛋白;200 mg脑组织剪切成小块,加入适量的冰冷PBS 洗涤两次后,4℃离心3000 r/min,3 min,弃上清;收集的组织中加入1000 μL 预冷的溶液A(使用前每1 mL 溶液A 加入1 μL DTT,10 μL PMSF,1 μL 蛋白酶抑制剂和5 μL 磷酸酶抑制剂),研磨组织;涡旋震荡10 s,冰上放置20 min,期间取出震荡3 ~5 次,于4℃下12000 r/min 离心10 min,上清为胞质蛋白部分。 取等量胞质蛋白与适量Loading buffer 混合,100℃水浴10 min;经SDS-PAGE 分离、转膜、封闭后,采用一抗anti-P-Drp1 进行孵育,4℃过夜,TBST 溶液洗涤3 次后采用标记HRP 的二抗进行孵育,1.5 h 后加入发光液,显色处理,并统计灰度值,计算相应蛋白表达量,实验重复3 次。
1.3.8 氧化应激检测
取各组大鼠脑组织,用商业化试剂盒根据说明书检测MDA、LDH 和SOD 的浓度。
1.4 统计学方法
本文所有对比实验数据用SPSS 16.0 软件进行统计学分析。 计量数据以平均数±标准差(±s)表示,两两比较用独立的t检验,多组间比较采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 松果菊苷增加抑郁症大鼠体重增长和糖水偏嗜度
与对照组(179±19)g 相比,模型组(90±18)g大鼠建模2 个月后平均增加体重远低于对照组,大约减少89.0 g;且模型组大鼠糖水偏嗜度减少,约减少33.3%。 同时用松果菊苷处理治疗组表现出增加模型大鼠增重和糖水偏嗜度(见图1),与模型组相比,治疗组(149±14)g 大鼠体重平均增加59.5 g,糖水偏嗜度平均增加24.2%,氟西汀组大鼠平均体重增加70.5 g,糖水偏嗜度平均增加28.1%。
2.2 松果菊苷降低抑郁症大鼠炎症细胞因子
单纯EA 组与对照组细胞因子浓度差异无统计学意义;与对照组相比,模型组促炎症因子IL-6、IL-1β 和TNF-α 水 平 增 加(F= 64.51、25.87、3.989,P<0.01),抗炎症因子IL-10 水平差异无统计学意义;与模型组相比较,治疗组和氟西汀组促炎症 因 子IL-6、IL-1β 和TNF-α 水 平 下 降(t=2.526、2.391、8.283 和1.792、1.943、7.839,P<0.01),抗炎症因子IL-10 水平增加(F= 3.000、3.667,P<0.01)。 见图2。
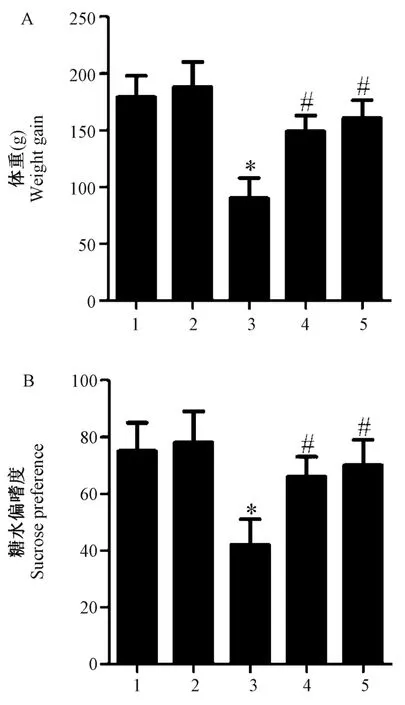
注:A:各组大鼠体重增长直方图;B:各组大鼠糖水偏嗜度直方图。1:对照组;2:单纯EA 组;3:模型组;4:治疗组;5:氟西汀组。 与对照组比较,*P<0.01;与模型组比较,#P<0.01。图1 松果菊苷增加抑郁症大鼠体重增长和糖水偏嗜度Note. A,Weight gain histogram of rats in each group. B,Histogram of sugar water preference of rats in each group.1,Control group.2,Simple EA group.3,Model group. 4, Treatment group. 5, Fluoxetine group. Compared with Control group, *P<0.01. Compared with Model group, #P<0.01.Figure 1 EA increased weight gain and sugar water preference in depressed rats
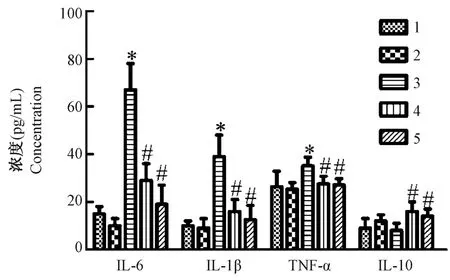
注:1:对照组;2:单纯EA 组;3:模型组;4:治疗组;5:氟西汀组。与对照组比较,*P<0.01;与模型组比较,#P<0.01。图2 松果菊苷对抑郁症大鼠炎症细胞因子IL-6、IL-1β、TNF-α、IL-10 水平的影响Note. 1, Control group. 2, Simple EA group. 3, Model group. 4,Treatment group. 5, Fluoxetine group. Compared with Control group, *P<0.01. Compared with Model group, #P<0.01.Figure 2 EA Effects of EA on levels of inflammatory cytokines IL-6, IL-1β, TNF-α and IL-10 in depressed rats
2.3 松果菊苷改善抑郁症大鼠脑损伤,减少脑组织细胞凋亡
单纯EA 组与对照组脑损伤差异无统计学意义,说明EA 对正常大鼠无细胞毒性。 模型组相较于对照组大鼠脑海马区组织出现大量空泡、染色质浓缩、边缘化,细胞凋亡率升高(F= 92.84,P<0.01);与模型组相比较治疗组和氟西汀组大鼠脑海马区组织损伤程度减轻,空泡减少,细胞凋亡率降低(t=2.034、1.933,P<0.01)。 见图3。
2.4 松果菊苷降低抑郁症大鼠脑线粒体膜电位
通过流式分选检测细胞线粒体膜电位的变化,与对照组相比,模型组线粒体膜电位升高(F=202.03,P<0.01);与模型组相比,治疗组和氟西汀组线粒体膜电位降低(t=3.486、2.074,P<0.01)。见图4。
2.5 松果菊苷改善抑郁症大鼠脑线粒体损伤
通过Western blot 检测线粒体损伤标志物表达情况,与对照组相比,模型组胞质内磷酸化线粒体动力相关蛋白(p-Drp1 蛋白)表达水平降低(F=94.82,P<0.01);与模型组相比,治疗组和氟西汀组p-Drp1 蛋白提高(t=1.200、1.188,P<0.01)。 见图5。
2.6 松果菊苷改善抑郁症大鼠脑氧化应激损伤
与对照组相比,模型组胞质内乳酸脱氢酶(LDH) 和丙二醛(MDA) 水平增加(F= 15.93、66.01,P<0.01),超氧化物歧化酶(SOD)水平降低(F=4.503,P<0.01);与模型组相比,治疗组和氟西汀组LDH 和MDA 水平下降(t= 5.154、3.815 和4.778、3.952,P<0.01),SOD 水平提高(t=6.133、6.500,P<0.01)。 见图6。
3 讨论
抑郁症是一种慢性情绪障碍疾病。 抑郁症的形成原因多种多样,比如压力和创伤、吸烟、饮食不规律、缺乏锻炼、睡眠状况、牙周疾病以及糖尿病等[11]。 CUMS 是其中一种抑郁症动物模型,即低水平的慢性和不可预测的应激源,类似于人类在日常生活中可能经历的刺激,会在脆弱的个体中诱发抑郁[9]。 CUMS 会导致一系列行为缺陷,包括蔗糖偏好降低、奖励刺激动机减少、性行为以及攻击性增加、焦虑样行为和睡眠模式改变。 研究表明,CUMS在雄性和雌性大鼠中均诱导了类似抑郁的表型[12]。本研究采用了14 种不同类型的轻度刺激,诱导了成年雄性大鼠抑郁模型。 结果表明,模型大鼠体重减少,蔗糖偏好降低。

注:A:HE 染色检测各组大鼠脑组织损伤;B:TUNEL 染色检测各组大鼠脑组织细胞凋亡;C:各组大鼠脑组细胞凋亡率直方图。 1:对照组;2:单纯EA 组;3:模型组;4:治疗组;5:氟西汀组。 与对照组比较,*P<0.01;与模型组比较,#P<0.01。图3 松果菊苷改善抑郁症大鼠脑损伤Note. A,He staining was used to detect brain tissue damage in each group. B,TUNEL staining was used to detect the apoptosis of brain tissue cells in each group. C, Histogram of apoptosis rate in brain groups of rats. 1, Control group. 2, Simple EA group. 3, Model group. 4, Treatment group. 5,Fluoxetine group. Compared with Control group, *P<0.01. Compared with Model group, #P<0.01.Figure 3 EA improves brain damage in depressed rats

注:A:流式分选检测各组大鼠线粒体膜电位的变化;B:各组大鼠JC-1 红/绿比值。 1:对照组;2:单纯EA 组;3:模型组;4:治疗组;5:氟西汀组。 与对照组比较,*P<0.01;与模型组比较,#P<0.01。图4 松果菊苷降低抑郁症大鼠脑线粒体膜电位Note. A, The changes of mitochondrial membrane potential in each group were detected by flow sorting. B, Red/green ratio of JC-1 in each group.1, Control group. 2, Simple EA group. 3, Model group. 4, Treatment group. 5, Fluoxetine group. Compared with Control group, *P <0.01.Compared with Model group, #P<0.01.Figure 4 EA decreased mitochondrial membrane potential in depressed rats

注:A:Western blot 检测线粒体损伤标志物表达;B:p-Drp1 蛋白表达直方图。 1:对照组;2:单纯EA 组;3:模型组;4:治疗组;5:氟西汀组。与对照组比较,*P<0.01;与模型组比较,#P<0.01。图5 松果菊苷改善抑郁症大鼠脑线粒体损伤Note. A, The expression of mitochondrial injury markers was detected by Western blot. B, Histogram of p-Drp1 protein expression. 1, Control group. 2, Simple EA group. 3, Model group. 4, Treatment group. 5, Fluoxetine group. Compared with Control group, *P<0.01. Compared with Model group, #P<0.01.Figure 5 EA reduced mitochondrial injury in depressed rats

注:A:各组大鼠LDH 水平直方图;B:各组大鼠SOD 水平直方图;C:各组大鼠MDA 水平直方图。 1:对照组;2:单纯EA 组;3:模型组;4:治疗组;5:氟西汀组。 与对照组比较,*P<0.01;与模型组比较,#P<0.01。图6 松果菊苷改善抑郁症大鼠脑氧化应激损伤Note. A, Histogram of LDH level in each group. B, histogram of SOD level of rats in each group. C, Histogram of MDA level in each group. 1,Control group. 2, Simple EA group. 3, Model group. 4, Treatment group. 5, Fluoxetine group. Compared with Control group, *P <0.01.Compared with Model group, #P<0.01.Figure 6 EA reduced oxidative stress injury in depressed rats
松果菊苷已经被证明具有增强肾功能、治疗血栓、阳痿、早泄和男性不育症,且有助于减轻老年人便秘[13]。 炎症是抑郁症的重要病因之一,抑郁症患者具有炎症反应的所有主要特征,包括促炎症细胞因子及其受体的表达增加以及急性期反应物、趋化因子和可溶性粘附分子在外周血和脑脊液中的水平增加[14]。
冯磊等[15]研究发现抑郁症患者血浆BDNF 降低,IL-6、IL-1 抑上升,参与抑郁症的发生发展过程。IL-10 是Th2 细胞分泌的一种多功能性细胞因子,起免疫抑制作用[16]。 本文研究表明,松果菊苷具有治疗抑郁症的潜力。 研究表明松果菊苷可以减轻炎症,从而减轻脂多糖诱导的急性肝损伤和肠炎[17-18]。 与上述文献一致,本研究也证实了松果菊苷抗炎的特性。 实验证明松果菊苷可以降低炎症因子如IL-6、IL-1 文水平,增加抗炎细胞因子IL-10水平,说明松果菊苷可能通过减少炎症反应缓解大鼠抑郁症。
线粒体异常是抑郁症的常见发病机制,线粒体在能量代谢中起着重要作用[19]。 众所周知,线粒体氧化磷酸化系统产生自由基,电子传递链本身易受到自由基的损伤[20]。 由于线粒体DNA 不受组蛋白的保护,线粒体在ATP 合成过程中产生活性氧,因而容易发生氧化损伤[21]。 线粒体损伤是由生化级联的改变引起的,电子传递链的损伤被认为是一系列精神障碍的重要因素, 如重度抑郁障碍(MDD)[22-23]。 LDH、MDA 和SOD 是氧化应激的标志物,含量高低可反映细胞氧化应激损伤程度[24]。发动蛋白相关蛋白1(dynamin-related protein 1,Drp1)在细胞新陈代谢、凋亡和线粒体自噬中发挥重要作用,当神经元线粒体功能异常,导致神经元损伤和突触联系建立异常[25]。 研究表明,松果菊苷可以减少ROS 的产生来保护PC12 细胞中由6-羟多巴胺引起的线粒体功能障碍和炎症反应[26]。 本文研究表明,松果菊苷可以降低抑郁症大鼠线粒体膜电位、氧化应激水平和线粒体损伤,体现在松果菊苷抑制MDA 和LDH,增加SOD 和p-Drp1 蛋白。
综上所述,松果菊苷可以减少炎症反应、降低抑郁症大鼠氧化应激水平和线粒体损伤,从而缓解大鼠抑郁症。 本研究表明松果菊苷可能成为抗抑郁的潜在药物。

