家兔颈总动脉血管内膜增生模型的探讨
曹 旺李 霞刘彩霞邓常清
(湖南中医药大学中西医结合心脑疾病防治湖南省重点实验室,长沙 410208)
冠状动脉粥样硬化性心脏病(coronary heart disease, CHD)是严重危害人类健康的心血管疾病。经皮冠状动脉介入术( percutaneous coronary intervention, PCI)治疗可以很好地实现冠脉血运重建,改善患者的生存质量,明显降低患者的死亡率,但术后由于血管内膜损伤后引起的血管再狭窄是困扰介入治疗的难题,也是影响患者预后和再发缺血性心脏病的重要原因。 众所周知,血管再狭窄的基本病理特征是血管内膜增生,在PCI 术后,由于血管内膜损伤,导致内膜下血管平滑肌细胞(vascular smooth muscle cell,VSMC)迁移至内膜并发生增殖,使血管内膜增厚而致血管再狭窄的发生[1-3]。 因此,防治PCI 术后血管内膜增生引起的血管再狭窄是当前迫切需要解决的问题。 而建立动物血管内膜增生模型是其防治研究的前提。 目前,血管内膜增生模型的建立方法主要有球囊导管损伤血管内膜引起内膜增生和高脂喂养引起动脉粥样硬化血管内膜增生等方法[4-6]。 球囊导管可损伤血管内皮,引起内膜增生,可用于大鼠、家兔等内膜增生模型的建立,但手术操作复杂,动物存活率较低,引起病变的程度变异较大,不利于防治方法的评价。 动脉粥样硬化模型主要用于小鼠和家兔,可在一定程度上引起血管内膜增生,但实验周期长,病变部位难以控制[7-10]。 家兔是动脉粥样硬化的易感动物,高脂高胆固醇饲料喂养可以形成类似人动脉粥样硬化的病变,而单纯用高脂高胆固醇喂养虽然可诱发动脉粥样硬化病变,但血管内膜增生病变不典型,实验周期长。 因此,建立一种病变明确、操作简单的血管内膜增生模型是研究其病理生理和防治的重要前提。 本实验采用家兔高胆固醇饲料喂养联合硅橡胶管颈总动脉套管术使颈总动脉狭窄的方法,建立了一种颈总动脉血管内膜增生模型,为血管内膜增生病理生理和防治方法的研究提供了有效手段。
1 材料和方法
1.1 实验动物
普通级新西兰种大白兔雌雄各15 只,10 周龄体重1.8~2.0 kg,均购于湖南太平生物科技有限公司[SCXK(湘)2015-0004]。 实验在湖南省中医药研究院动物中心进行[SYXK(湘)2015-0008],动物实验得到湖南中医药大学医学动物实验伦理委员会批准(2019-0027),并按实验动物使用的3R 原则给予人道的关怀。
1.2 主要试剂与仪器
改良Masson 三色染色试剂盒(北京索莱宝科技有限公司,批号20190613);二步法免疫组化法检测试剂盒(北京中杉金桥,批号2015G0115);DAB 显色试剂盒(北京中杉金桥,批号K196721D);小鼠抗α-smooth muscle actin(α-SMA)单克隆抗体(abcam,批号GR3257713-3);小鼠抗Osteopontin(OPN)单克隆抗体(NOVUS,批号NB110-89062);兔抗TNFα多克隆抗体(Bioss,批号bs-2150R);兔抗1 L-1β 多克隆抗体(Bioss,批号bs-0812R);兔抗Collagen 1(Col-1)多克隆抗体(Bioss,批号bs-0578R)。 石蜡切片机(英国Shado 公司,HM325);光学显微镜(日本Olympus 公司,BA410E)。
1.3 实验方法
1.3.1 动物分组及处理
实验前适应性饲养1 周,饲养于普通级动物实验室,室温25℃、湿度45%~65%,喂食标准饲料,自由摄食和水。 将家兔随机分为假手术组(A 组),高脂+单侧套管组(B 组,按造模时间分为B1、B2 亚组),高脂+双侧套管组(C 组,按造模时间分为C1、C2 亚组),每组6 只,雌雄各3 只排除性别干扰。 按颈总动脉套管法改良制作颈总动脉血管内膜增生模型[11]:动物术前12 h 禁食不禁水,耳缘静脉注射2.5%戊巴比妥钠(1 mL/kg)麻醉后仰卧固定,颈部正中切口,分离两侧颈总动脉。 高脂+单侧套管组将一个无活性的柔软的硅橡胶管(长度20 mm,内径1.0 mm)沿长轴剪开后,套在分离的左侧颈总动脉外面,用丝线结扎固定。 高脂+双侧套管组将两个硅橡胶管分别套在分离的左右侧颈总动脉外面,用丝线结扎固定。 术后第1 天起连续喂养高脂饲料(2%胆固醇+3%橄榄油+95%普通饲料)。 假手术组只进行手术操作分离颈总动脉,不进行血管套管,从术后第1 天起连续喂养普通饲料。 术中A组、B1 组、C1 组麻醉意外死亡1 只,各组术后肌注青霉素7 d 抗感染,术后未有动物死亡。 分别于术后2 周、3 周处死动物检测,取材时硅橡胶管脱落者即为造模不成功,其中B2 组1 只,C1 组1 只,C2 组2 只。
1.3.2 检测指标
血管内膜增生形态学计量分析:取损伤段颈总动脉,在PBS 缓冲液中将血管剥离干净,放入4%多聚甲醛固定7 d,乙醇梯度脱水,石蜡垂直定向包埋,每段血管间断均匀切取8 片后按试剂盒说明行Masson 染色,以病理图像分析系统测定中膜面积(media area,MA),内膜面积(intimal area,IA)、内膜中线周长、中膜中线周长,计算中膜厚度(media thickness,MT)、内膜厚度(intimal thickness,IT)、内膜面积增生比率(hyperplasia ratio of intimal area,HRIA)、内膜厚度增生比率(hyperplasia ratio of intimal thickness,HRIT),以评价血管内膜增生程度。计算公式如下:

免疫组化法测定损伤段颈总动脉增生内膜中α-SMA、OPN、TNF-α、1L-1β、Col-1 蛋白表达:按照免疫组化试剂盒说明书操作:将损伤段血管组织置4%多聚甲醛固定7 d,乙醇梯度脱水,石蜡垂直定向包埋,石蜡切片机均匀切片,每厚约4 μm;60℃烤片过夜;脱蜡水化;微波抗原修复;冷却至室温后每张切片滴加一抗50 μL(小鼠抗α-SMA 单克隆抗体,稀释浓度1 ∶2000,小鼠抗OPN 单克隆抗体,稀释浓度1 ∶200,兔抗TNF-α 多克隆抗体,稀释浓度1 ∶200,兔抗1L-1β 多克隆抗体,稀释浓度1 ∶200,兔抗Col-Ⅰ多克隆抗体,稀释浓度1 ∶200),4℃孵育过夜;然后按PV-9000 二步法检测试剂盒滴加二抗,37℃温育30 min;DAB 显色,苏木素复染,脱水与透明后封片。 光镜下可见阳性表达呈棕黄色点状或纤维状染色,每张切片选择5 个不同视野进行拍照,用Image-Pro Plus6.0 图像分析软件测量阳性染色积分光密度(integrated optical density,IOD)值以及阳性染色面积,并计算出平均IOD 值以反映目的蛋白的表达强度。 平均积分光密度值=IOD Sum/Area Sum(μm2)。
1.4 统计学方法
2 结果
2.1 血管内膜病理形态学改变
Masson 染色显示,假手术组血管内膜内弹力膜完整,呈单层,未见明显增生。 各实验组血管内膜呈均一或不均一增生,大量VSMC 增生,细胞排列紊乱,内膜增生明显,向血管管腔呈向心性或偏心性增厚。 其中单侧套管组术后2 周和3 周内膜均呈局限性增生,术后3 周的增生程度大于2 周。 双侧套管组内膜多呈向心性增厚,术后2 周增生程度较轻,术后3 周见明显的内膜增生,血管管腔狭窄明显(图1)。
2.2 各组增生内膜形态计量学指标的比较
假手术组血管内膜无明显增生。 与假手术组比较,单侧套管2 周组HRIA、HRIT 显著增加(P<0.05),单侧套管3 周组IA、IT、HRIA、HRIT 均显著增加(P<0.05);单侧套管3 周组与2 周组比较,IA、IT、HRIA、HRIT 差异无统计学意义(P>0.05)。 双侧套管2 周组、3 周组IA、IT、HRIA、HRIT 均较假手术组显著升高(P<0.01);双侧套管3 周组与2 周组比较,IA、IT、HRIA、HRIT 均显著升高(P<0.05-0.01)。 双侧套管2 周组与单侧套管2 周组比较,IA、IT、HRIA、HRIT 均显著升高(P<0.05),双侧套管3 周组与单侧套管3 周组比IA、IT、HRIA、HRIT均显著增加(P<0.01)。 (表1)
2.3 各组增生血管内膜中α-SMA、OPN、TNFα、1L-1β、Col-1 表达的比较
与假手术组比较,单侧套管2 周组、3 周组和双侧套管2 周组增生内膜中血管平滑肌细胞收缩表型标志蛋白α-SMA 表达差异无统计学意义(P>0.05),双侧套管3 周组增生血管内膜中α-SMA 表达显著降低(P<0.05)。 (图2)与假手术组比较,单侧套管2 周组、3 周组和双侧套管2 周组、3 周组增生内膜中血管平滑肌细胞合成表型(去分化型)标志物蛋白OPN、细胞外基质成分Col-Ⅰ、炎性反应因子IL-1β、TNF-α 表达显著增高(P<0.05)。 (图3、图4、图5、图6)
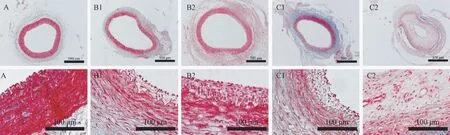
注:A:假手术组;B1:单侧套管2 周;B2:单侧套管3 周;C1:双侧套管2 周;C2:双侧套管3 周。图1 颈总动脉Masson 染色Note. A, Sham operation group. B1, Unilateral cannula for 2 weeks. B2, Unilateral cannula for 3 weeks. C1, Bilateral cannula for 2 weeks. C2, Bilateral cannula for 3 weeks.Figure 1 Masson staining of common carotid artery
表1 各组血管形态学计量指标的比较(±s )Table 1 Comparison of blood vessel morphology measurement indexes in each group
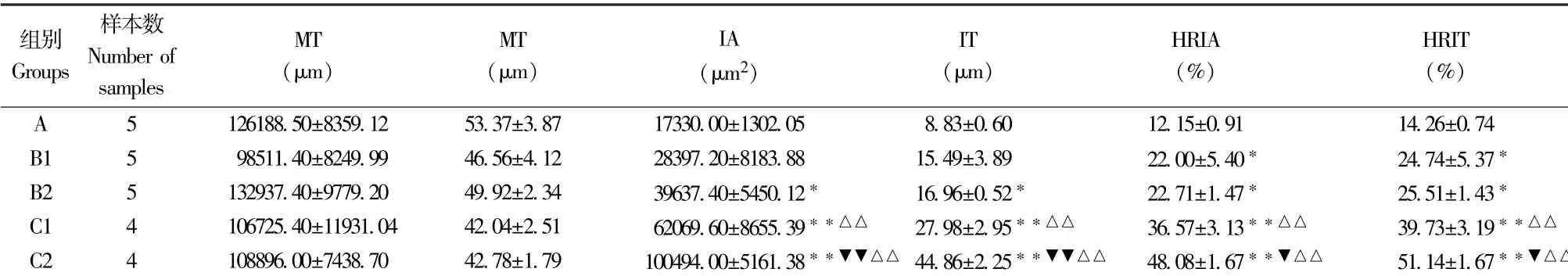
表1 各组血管形态学计量指标的比较(±s )Table 1 Comparison of blood vessel morphology measurement indexes in each group
注:A:假手术组;B1:单侧套管2 周;B2:单侧套管3 周;C1:双侧套管2 周;C2:双侧套管3 周。 与假手术组比较,*P<0.05,**P<0.01;与2 周比较,▼P<0.05,▼▼P<0.01;与同时间单侧比较,△P<0.05,△△P<0.01。Note. A, Sham operation group. B1,Unilateral cannula for 2 weeks. B2,Unilateral cannula for 3 weeks. C1,Bilateral cannula for 2 weeks. C2,Bilateral cannula for 3 weeks.Compared with sham operation group, *P < 0.05, **P < 0.01. Compared with 2 weeks, ▼P < 0.05, ▼▼P < 0.01. Compared with the same time, △P <0.05, △△P<0.01.
组别Groups样本数Number of samples MT(μm)MT(μm)IA(μm2)IT(μm)HRIA(%)HRIT(%)A 5 126188.50±8359.12 53.37±3.87 17330.00±1302.05 8.83±0.60 12.15±0.91 14.26±0.74 B1 5 98511.40±8249.99 46.56±4.12 28397.20±8183.88 15.49±3.89 22.00±5.40* 24.74±5.37*B2 5 132937.40±9779.20 49.92±2.34 39637.40±5450.12* 16.96±0.52* 22.71±1.47* 25.51±1.43*C1 4 106725.40±11931.04 42.04±2.51 62069.60±8655.39**△△ 27.98±2.95**△△ 36.57±3.13**△△ 39.73±3.19**△△C2 4 108896.00±7438.70 42.78±1.79 100494.00±5161.38**▼▼△△ 44.86±2.25**▼▼△△ 48.08±1.67**▼△△ 51.14±1.67**▼△△
3 讨论
目前采用套管制作血管狭窄模型有两种方法,一种是在血管外包裏硅橡胶圈,血管套管可使颈总动脉狭窄,造成局部血流动力学变化,同时动脉套管的机械刺激可诱导血管局部特别是血管外膜的炎症反应,从而促进动脉内膜增生[12]。 但单纯的血管套管法造成血管狭窄的时间较长,且病变不稳定。 另一种方法是在血管套管的基础上加高脂饲养[13-14]。 家兔属于动脉粥样硬化易感动物,与啮齿类动物相比,由于啮齿类动物缺乏胆固醇酯转移酶,仅给予高脂饲料无法引起明显的动脉粥样硬化斑块,因此,啮齿类动物不容易发生动脉粥样硬化性病变,而兔体内存在胆固醇酯转移酶,给予高脂饲料可引起脂质在内膜沉积,因此高脂饲料可诱发家兔动脉粥样硬化[15]。 但单纯高脂饮食饲养往往实验周期较长,且病变部位难以控制,故可在高脂基础上施以损伤血管及其他干预手段,诱导内膜出现动脉粥样硬化性改变而出现血管内膜增生。 因此,本实验采用血管套管法加高脂饲料喂养,目的是促进动脉粥样硬化和血管狭窄,使病变固定在某个部位,便于对血管狭窄病理生理机制和防治方法的研究。 实验证明,无论是单侧还是双侧颈总动脉套管加高脂喂养,均可诱导血管内膜增生,且随着时间的延长,病变逐渐加重,并且双侧血管套管诱导的病变较单侧套管法更重。 说明采用硅橡胶圈血管套管加高脂喂养法能诱导明显的血管狭窄,可缩短血管狭窄形成时间,并使血管狭窄局限发生在颈总动脉,从而为特定目的的研究提供合适的动物模型。 这种方法引起的血管狭窄与人类动脉粥样硬化引起的血管狭窄近似,由于套管和高脂刺激,使血管内皮细胞损伤,产生血管炎症反应,诱导血管平滑肌细胞迁移、增殖,导致内膜增生而产生血管狭窄。 该方法保存了血管内膜的完整性,对血管的损伤小,具有成模时间短、病变固定等优点。

注:A:假手术组;B1:单侧套管2 周;B2:单侧套管3 周;C1:双侧套管2 周;C2:双侧套管3 周。 与假手术组比较:*P <0.05,**P<0.01,***P<0.001。下图同。图2 α-SMA 免疫组化染色Note. A, Sham operation group. B1, Unilateral cannula for 2 weeks. B2, Unilateral cannula for 3 weeks. C1, Bilateral cannula for 2 weeks. C2,Bilateral cannula for 3 weeks. Compared with sham operation group, *P<0.05, **P<0.01,***P<0.001. The same as below.Figure 2 Immunohistochemical staining of α-SMA

图3 OPN 免疫组化染色Figure 3 Immunohistochemical staining of OPN

图4 TNF-α 免疫组化染色Figure 4 Immunohistochemical staining of TNF-α

图5 1L-1β 免疫组化染色Figure 5 Immunohistochemical staining of 1L-1β

图6 Col-1 免疫组化染色Figure 6 Immunohistochemical staining of Col-1
血管内膜增生发生机制十分复杂,目前认为与内皮功能障碍与损伤、血小板聚集与血栓形成、血管平滑肌细胞向内膜迁移、增殖、炎症反应及合成大量细胞外基质等多种因素有关[16-17]。 正常情况下,血管壁自内向外依次分为内膜、中膜、外膜。 内膜主要由内皮细胞和内皮下成分组成;中膜主要由血管平滑肌细胞与胶原纤维构成;外膜由疏松结缔组织组成,细胞成分以外膜成纤维细胞为主。 本研究表明,在血管套管后不同时间,出现明显的内膜增生,新生内膜中血管平滑肌细胞数量明显增多,排列紊乱,增生内膜中细胞外基质沉积明显增多,局部增生的内膜中炎性反应显著增强,表明在炎性反应下中膜VSMC 向内膜迁移、增生并合成大量细胞外基质诱导了血管内膜增生。
VSMC 增殖是血管内膜增生的中心环节。VSMC 增生的前提是其发生了表型转化。 在成熟的血管中,VSMC 呈现“收缩”或分化的表型,其特征是可见到VSMC 特异性收缩标志物如α-SMA、平滑肌22α(smooth muscle22α,SM22α)的表达,它们在收缩调节中起重要作用[18-19]。 当血管损伤后,VSMC去分化并重新进入细胞周期,发生细胞增殖,表达OPN 等特异性合成表型(去分化型)标志物。 这种去分化表型在动脉粥样硬化、PCI 术后再狭窄以及高血压血管重构的发生发展中具有重要的病理生理意义[20]。 有研究发现,在大鼠血管损伤模型,增生内膜中α-SMA 表达下调,表明血管受损后VSMC发生了由分化型向去分化型的表型转化。 血管损伤后局部炎性反应可以诱发全身的慢性炎性反应,进而促进VSMC 迁移与增殖引起内膜增生。 血管中膜的VSMC 增殖并迁移至内膜后合成大量细胞外基质并在血管壁沉积,从而进一步促进内膜的增生。我们的研究也发现,在双侧套管3 周,增生血管内膜中VSMC 收缩型标志物α-SMA 表达显著降低,合成表型标志物OPN 表达显著增高,细胞外基质成分Col-Ⅰ表达显著增高,炎性反应因子IL-1β、TNF-α表达显著增高,提示在这种模型的血管内膜增生中,VSMC 由收缩表型转化成合成表型,使VSMC 自血管中膜向内膜迁徙,发生过度增殖,并合成和分泌多种生物活性物质和细胞外基质,导致血管内膜增生。
此外,我们在实验中还发现,在血管套管后,如果硅橡胶管套管与血管贴合不紧密,可能导致套管脱落,导致造模失败。 因此,在血管套管时,可以采用多重丝线结扎的方法,使血管套管能紧密地贴合血管,这样可保证血管狭的形成并且可以保证模型的一致性。
总之,本文采用颈总动脉血管套管加高脂喂养的方法,可以造成明显的颈总动脉局部血管内膜增生,使血管腔狭窄。 而且,在使用这种方法时,双侧颈总动脉套管比单侧的成模效果好,套管后3 周血管狭窄的程度更明显。 因此,在应用这种方法造模时,建议采用双侧血管套管加高脂喂养,造模时间以3 周以上为宜。

