胃癌合并肝硬化行腹腔镜胃癌根治术对患者免疫功能的影响
申辽辽,高艳菊
(榆林市第二医院检验科,陕西 榆林 719000)
胃癌是临床常见的恶性肿瘤之一,该病早期无特异性症状,发病率与病死率一直比较高,多伴随有各种基础疾病[1]。改善胃癌患者预后的原则是早发现、早诊断、早治疗,不过肝硬化患者行胃癌根治术的围手术期病死率是无肝硬化患者的3~4倍,术后多伴随有各种并发症[2-3]。胃癌伴肝硬化的血清标记物主要有高尔基体跨膜糖蛋白73(Golgi protein 73,GP73)、甲胎蛋白L3(Alpha-fetal protein L3,AFP-L3)。研究认为肿瘤的发生、发展与机体免疫系统的紊乱密切相关,当机体免疫功能低下时,免疫系统不能及时发现、清除恶性增殖的肿瘤细胞,从而诱发恶性肿瘤的发生[4]。根治术能提高胃癌患者的生存率,降低病死率,但是传统开腹手术与麻醉可导致患者机体恢复慢,其所致的应激反应会不同程度地干扰机体免疫功能[5]。特别是当患者免疫功能低下时,开腹手术可使患者能量消耗增加,机体感染风险加大,从而造成机体出现免疫抑制情况[6]。随着现代科技、医疗设备的发展,腹腔镜技术得到了广泛应用,其具有近期疗效好、微创效果明显、术后并发症控制效果好等特点[7]。本文拟探讨胃癌合并肝硬化患者行腹腔镜胃癌根治术对免疫功能的影响,以明确腹腔镜胃癌根治术的应用价值。
1 资料与方法
1.1 一般资料 2017年9月至2020年4月选择在本院诊治的胃癌合并肝硬化患者72例,病例纳入标准:所有患者及其家属在自愿条件下签署知情同意书;患者年龄20~70岁;本院伦理委员会批准了此次研究;符合胃癌伴肝硬化的诊断标准;具有完整的临床资料;术前均未进行免疫治疗、化疗、放疗、生物学治疗等。排除标准:围手术期肝功能评估为Child C级患者;妊娠与哺乳期妇女;有严重心、肺、肾等疾病,不能耐受手术者;长期服用激素的患者;入院前4周内有腹部手术者;有心脏病病史、心力衰竭病史的患者。根据随机信封抽签原则把患者分为腹腔镜组与对照组各36例,两组患者的肿瘤最大直径、手术方法、性别、年龄、组织学分化、Child分级、临床分期等对比差异均无统计学意义(均P>0.05),见表1。
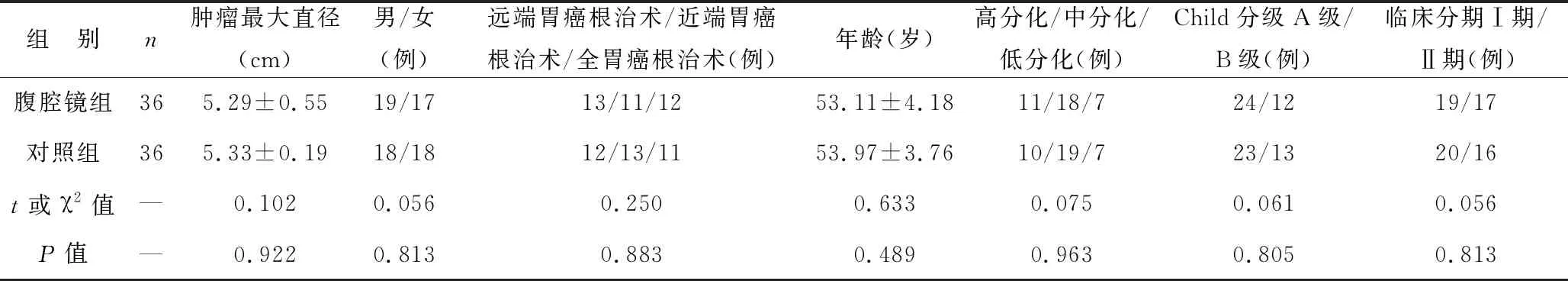
表1 两组患者一般资料对比
1.2 手术方法 两组手术均由同一组医师施行,所有患者术前1 d进食流质食物,手术当日预防性使用抗生素并禁食。腹腔镜组给予腹腔镜胃癌根治术治疗,其中13例行腹腔镜远端胃癌根治术,11例行近端胃癌根治术,12例行全胃癌根治术。患者取仰卧位,进行气管内插管全麻,建立人工CO2气腹(气腹压力为12~15 mm Hg),将10 mm套管针 (Trocar) 置入后常规行腹腔镜探查,依据肿瘤部位决定切除术式,对患者进行肿瘤切除,术中清扫淋巴结,离断胃与十二指肠,切除病灶,从切口拖出,胃部行结肠前胃空肠侧吻合,丝线间断缝合,逐层缝合切口。对照组行传统开腹手术,其中12例行远端胃癌根治术,13例行近端胃癌根治术,11例行全胃癌根治术。于上腹部正中作一20~30 cm切口,按传统胃癌D2根治术进行,手术范围、淋巴结清扫和手术顺序同观察组。
1.3 观察指标 ①记录两组手术时间、术中出血量、淋巴结清扫数目、术后胃肠道恢复时间、术后拔除胃管时间、术后住院时间等。②记录两组术后7 d出现的并发症情况,包括发热、出血、吻合口漏、肠梗阻、胃瘫等。③在术前1 d与术后7 d抽取患者的空腹静脉血2~3 ml,室温静置2 h,3000 r/min离心10 min,取上层血清,采用生化分析仪检测血清GP73、AFP-L3含量。④取上述的血液样本,采用密度梯度离心法分离出单个核细胞,用流式细胞仪(美国BD公司)检测CD3+T细胞、CD4+T细胞的表达水平。⑤随访结果:随访到2021年1月,记录患者的复发情况。
2 结 果
2.1 两组围手术指标对比 两组手术时间、淋巴结清扫数目对比差异均无统计学意义(均P>0.05),腹腔镜组的术中出血量、术后胃肠道恢复时间、术后拔除胃管时间、术后住院时间均少于对照组(均P<0.05),见表2。
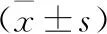
表2 两组围手术指标对比
2.2 两组并发症发生情况对比 腹腔镜组术后7 d的发热、出血、吻合口漏、肠梗阻、胃瘫等并发症发生率为8.3%,低于对照组的33.3%(χ2=6.821,P<0.05),见表3。
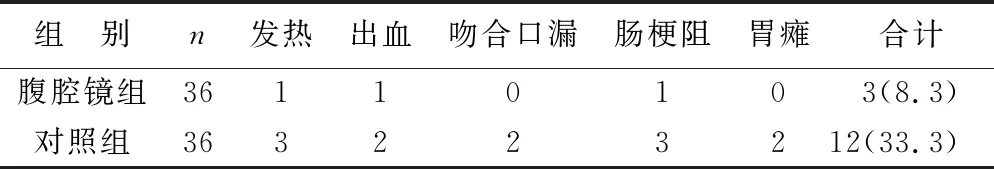
表3 两组术后并发症发生情况对比[例(%)]
2.3 两组手术前后血清GP73、AFP-L3含量对比 腹腔镜组与对照组术后7 d的血清GP73、AFP-L3值低于术前1 d(P<0.05),腹腔镜组低于对照组(P<0.05),见表4。
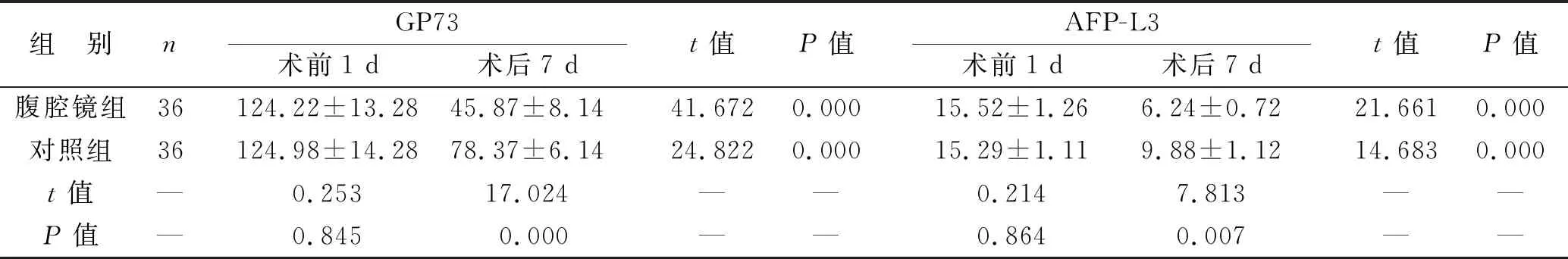
表4 两组手术前后血清GP73、AFP-L3含量对比(ng/ml)
2.4 两组手术前后免疫功能变化对比 两组术后7 d的CD4+T细胞比例高于术前1 d(P<0.05),腹腔镜组高于对照组(P<0.05),两组手术前后CD3+T细胞比例对比差异无统计学意义(P>0.05),见表5。
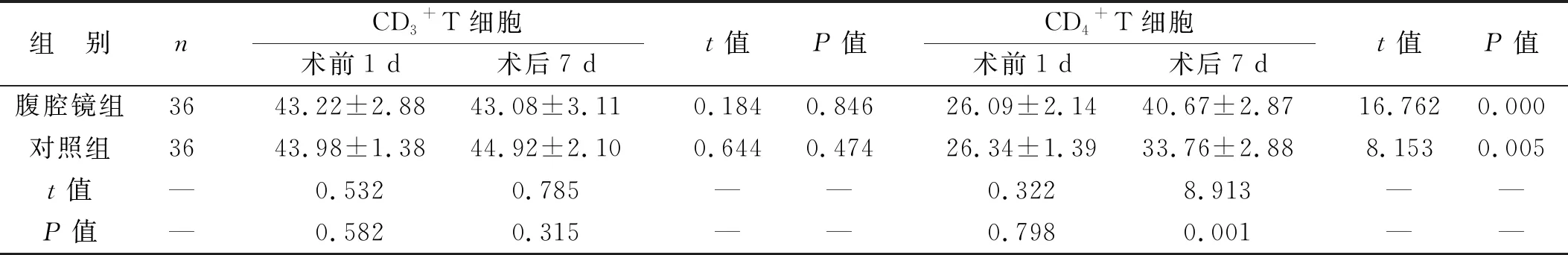
表5 两组手术前后免疫功能变化对比(%)
2.5 两组复发情况对比 随访到2021年1月,腹腔镜组的复发率为5.6%,低于对照组的22.2%(χ2=4.181,P<0.05),见表6。
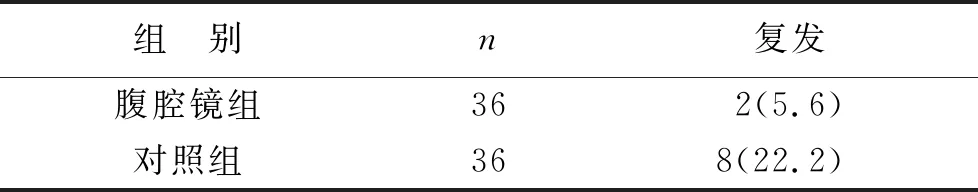
表6 两组随访复发情况对比[例(%)]
3 讨 论
胃癌患者早期无特异性症状,就诊时多伴随有各种基础疾病。特别是我国属乙肝感染高发地区,肝炎病毒携带者发生胃癌的相对危险性比非携带着高10倍左右[8]。外科手术为胃癌合并肝硬化的根治性方法,但是疾病创伤、手术与麻醉可损伤患者的肝脏功能,也容易导致肠道细菌易位与机体凝血机制障碍,造成患者术后并发症发生率比较高[9]。本研究显示两组手术时间、淋巴结清扫数目对比差异无统计学意义,腹腔镜组的术中出血量、术后胃肠道恢复时间、术后拔除胃管时间、术后住院时间少于对照组;腹腔镜组术后7 d的发热、出血、吻合口漏、肠梗阻、胃瘫等并发症发生率为8.3%,低于对照组的33.3%。从机制上分析,随着随着医学技术的快速发展,腹腔镜广泛应用于各种外科手术,腹腔镜胃癌根治术具有恢复快、失血少、创伤小等优点[10-11]。特别是在腹腔镜的辅助下,术野被放大数倍,患者病灶周围的组织被充分暴露,使得组织的解剖层次更明显,保障了手术的安全性,能减少对患者的创伤,减少术后并发症的发生[12]。不过手术中要注意以下事项:手术者熟悉胃癌在腹腔镜下的解剖特点,行淋巴结清扫时力求整块切除原则,一定要在正常的解剖平面进行手术操作,从而彻底清扫各组相关淋巴结,减少对患者免疫功能的影响。
肝硬化为一种弥漫性肝损害,多为肝炎后肝硬化,病理特征表现为有广泛的肝细胞坏死、结缔组织增生、残存肝细胞结节性再生[13]。肝硬化合并胃癌可导致机体出现上消化道出血、脾功能亢进、肝性脑病、继发感染等并发症,需要早期进行手术治疗。GP73、AFP-L3为肝硬化筛查的重要标志物,两者都与HBV-DNA载量密切相关,特别是胃癌的发生在一定程度上可导致肝细胞的损伤,高尔基体、内质网等细胞器结构的破坏,导致GP73、AFP-L3等指标水平异常升高[14]。腹腔镜组与对照组术后7 d的血清GP73、AFP-L3值低于术前1 d,腹腔镜组低于对照组,表明胃癌伴肝硬化患者行腹腔镜胃癌根治术能改善患者的肝功能。
胃癌容易通过血液传播产生继发性损害,使得很多患者伴随有肝硬化。不过对处于浅筋膜中含有较多脂肪的患者,解剖层次比较模糊,易发生伤口渗血的情况,不利于组织结构的辨认,增加了手术的难度。同时肿瘤与机体的之间相互作用决定了肿瘤的发展,胃癌形成后可刺激机体而诱发免疫应答,出现抗肿瘤免疫效应,从而促进机体清除体内的恶性肿瘤细胞[15-16]。另外胃癌本身也可通过一系列机制抑制机体的抗肿瘤免疫效应,来逃避免疫细胞的攻击。若免疫抑制效应或免疫逃逸效应占主导地位,则可促进肿瘤的增殖[17]。若抗肿瘤免疫效应占主导地位,则能抑制肿瘤的增殖。在机体的免疫应答中,T淋巴细胞起着中心调控作用,可起着相互诱导、相互制约的作用,从而共同维持机体正常的细胞免疫[18]。同时手术创伤后机体产生可逆性的特异性免疫功能改变,主要表现为细胞免疫功能损害。本研究显示 两组术后7 d的CD4+T细胞比例高于术前1 d,腹腔镜组高于对照组,两组手术前后CD3+T细胞比例对比差异无统计学意义,随访到2021年1月,腹腔镜组的复发率为5.6%,低于对照组的22.2%。从机制上分析,腹腔镜成像系统具备局部放大、视野广等优点,能很好处理曲张的胃周血管,有利于保持患者内环境的稳定,从而有利于患者免疫功能的恢复,降低随访复发率[19-20]。本研究也有一定的不足,没有进行长期随访,且纳入样本数量较少,将在后续研究中深入分析。
综上所述,胃癌合并肝硬化患者行腹腔镜胃癌根治术能促进恢复免疫功能,抑制肝功能标志物的表达,减少对患者的创伤与并发症的发生,从而促进患者康复,降低复发率。

