PCIA 联合局部浸润罗哌卡因的多模式镇痛在胃癌患者腹腔镜根治术后的应用效果评估
殷小坤
(河南省安阳市肿瘤医院 安阳455000)
胃癌是起源于胃黏膜上皮的恶性肿瘤,在我国各种恶性肿瘤中发病率居前列。 胃癌早期多数患者无明显症状,进展到中晚期之后,会在颈部和左侧锁骨上窝处发现淋巴结肿大,发生肝转移等,并可伴有幽门梗阻、贲门梗阻、胃穿孔、腹膜炎等病症[1]。 胃癌治疗以手术切除为主,且要尽可能早期进行根治手术,以有效提高患者术后的生存能力。 与传统根治性手术相比,腹腔镜根治术具有以下优点:(1)微创、切口比较小;(2)视野更清晰,通过腹腔镜放大技术可以让局部清晰度更高;(3)对腹腔影响小,恢复很快;(4)完整的医学影像保留,资料容易保存。 因此腹腔镜根治术常作为胃癌根治手术的首选[2]。 但在术后患者仍会出现一定的痛感,给患者带来许多生理和心理问题,从而延缓患者术后恢复进程。 常规阿片类药物滴注镇痛模式往往难以达到预期的镇痛效果,而局部浸润镇痛具有安全性高、并发症少、对患者生理功能影响最小等优点,配合罗哌卡因酰胺类局麻药,有麻醉和镇痛双重效应,大剂量可产生外科麻醉,小剂量时则产生感觉阻滞(镇痛)仅伴有局限的非进行性运动神经阻滞。 大量研究表明局部浸润罗哌卡因镇痛在术后镇痛中的效果显著,且安全性较高。因此本研究采取自控静脉镇痛(PCIA)联合局部浸润罗哌卡因的多模式镇痛与常规的PCIA 镇痛模式相比较,以期为胃癌腹腔镜根治术后患者提供更好的镇痛方法。 现报道如下:
1 资料与方法
1.1 一般资料 选取2018 年7 月~2020 年7 月于我院行腹腔镜根治术的胃癌患者100 例,按随机数字表法分为实验组和对照组,各50 例。对照组男28例,女22 例;年龄28~66 岁,平均(44.58±8.59)岁;美国麻醉医师协会(ASA)分级:Ⅰ级21 例,Ⅱ级29例。 实验组男27 例,女23 例;年龄29~63 岁,平均(45.18±9.19)岁;ASA 分级:Ⅰ级19 例,Ⅱ级31 例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。 本研究经医院医学伦理委员会批准。
1.2 入组标准 纳入标准: 符合胃癌诊断标准,且进行腹腔镜根治术治疗; 患者签署知情同意书。 排除标准:伴心、肝、肾功能不全或受损;凝血功能异常;对本研究药物过敏;免疫功能异常。
1.3 镇痛方法 对照组给予PCIA 镇痛, 即根治手术完成后外周静脉连接镇痛泵,采取0.9%氯化钠注射液100 ml 及注射用舒芬太尼(国药准字H20054172)100 μg, 负荷剂量4 ml/h, 持续剂量2ml/h,追加量5 ml,锁定时间15 min。 实验组在对照组基础上额外采用0.375%罗哌卡因(国药准字H20193218)20 mg 进行切口局部浸润。 同时两组静脉滴注2 mg 托烷司琼(国药准字H20050075),预防不良反应发生。
1.4 观察指标 (1)术后12 h、24 h 用视觉模拟评分法(VAS)[3~4]对两组患者进行疼痛感评估,0~10分,分数越高,疼痛感越强。(2)记录术后两组患者舒芬太尼使用总量。(3)术后24 h 抽取两组患者静脉血, 采用双抗体夹心酶联免疫吸附测定(ELISA)法检测血清C- 反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)。(3)术后密切监测两组患者身体状况,记录晕眩、食欲不振、呕吐、呼吸抑制等不良反应发生情况。
1.5 统计学方法 采用SPSS22.0 软件进行数据处理。 数据均符合正态分布,计量资料以(±s)表示,组间用独立样本t检验;计数资料以率表示,进行χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组炎症介质水平比较 两组术前血清CRP、TNF-α、IL-6 水平比较无显著差异(P>0.05);实验组术后24 h 血清CRP、TNF-α、IL-6 水平低于对照组(P<0.05)。 见表1。
表1 两组炎症介质水平比较(±s)

表1 两组炎症介质水平比较(±s)
注:与同组术前比较,*P<0.05。
CRP(mg/L)术前 术后24 h对照组实验组组别 n TNF-α(ng/L)术前 术后24 h IL-6(pg/L)术前 术后24 h 50 50 t P 50.15±15.63 49.45±15.41 0.225 0.822 79.33±15.22*73.33±14.96*1.987 0.049 24.12±11.25 24.31±11.14 0.084 0.932 42.18±13.55*35.66±12.89*4.733<0.001 25.12±11.45 24.88±11.24 0.105 0.916 40.29±12.44*32.66±12.35*3.077 0.002
2.2 两组术后疼痛评分及舒芬太尼使用总量比较实验组术后12 h、24 h 疼痛评分低于对照组,舒芬太尼使用总量少于对照组(P<0.05)。 见表2。
表2 两组术后疼痛评分及舒芬太尼使用总量比较(±s)
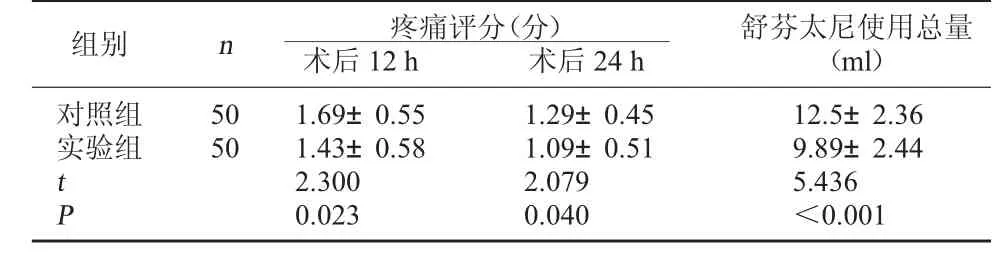
表2 两组术后疼痛评分及舒芬太尼使用总量比较(±s)
舒芬太尼使用总量(ml)对照组实验组组别 n 疼痛评分(分)术后12 h 术后24 h 50 50 12.5±2.36 9.89±2.44 t P 1.69±0.55 1.43±0.58 2.300 0.023 1.29±0.45 1.09±0.51 2.079 0.040 5.436<0.001
2.3 两组不良反应发生情况比较 实验组不良反应总发生率低于对照组(P<0.05)。 见表3。
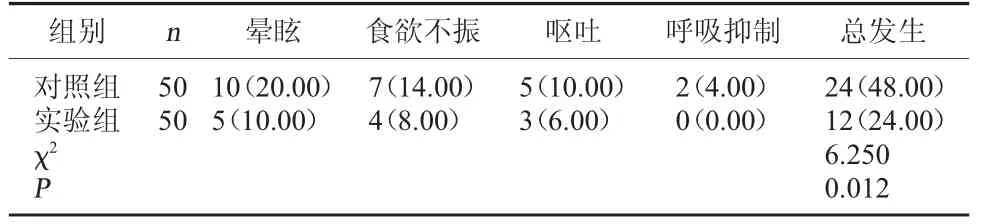
表3 两组不良反应发生情况比较[例(%)]
3 讨论
疼痛的产生过程极为复杂,可分为伤害性疼痛和神经性疼痛,还包含着众多介质的共同作用[5]。 因此单一镇痛模式的镇痛效果有限,即使追加用量,收效也不是很明显。 而多模式镇痛也称为平衡镇痛,可联合不同机制的镇痛药物或镇痛方法,在不同时间和不同部位进行镇痛,镇痛效果显著,可有效缓解疼痛感,减少药物对人体的伤害,维持内环境的相对稳定[6]。 多模式镇痛主要是通过联合应用主要作用于外周以抑制疼痛信号的触发为目的的非甾体类抗炎药(NSAIDs)和区域阻滞以及能减弱CNS 疼痛信号的阿片类药而实现。
本研究采用PCIA 联合局部浸润罗哌卡因的多模式镇痛对胃癌腹腔镜根治术后患者进行镇痛,结果显示实验组术后12 h、24 h 疼痛评分明显低于对照组,表明多模式镇痛的效果明显,究其原因为舒芬太尼与罗哌卡因具有互补作用,联合使用可增强镇痛效果。 CRP 作为炎症的标志物质,可在手术创伤后数小时内急剧增加,可反映伤口感染及应激反应程度,且与其他炎症介质也有紧密关联,而实验组术后24 h 血清CRP、TNF-α、IL-6 均低于对照组,表明多模式镇痛可缓解炎症反应, 原因可能在于损伤组织会释放TNF-α、IL-6 等炎症介质, 会间接导致致痛因子的产生,同时导致外周敏感化,痛感增强[7],用局麻药浸润切口进行镇痛, 可抑制损伤组织神经信号的传递,从而减轻神经源性炎症。而且随着体内炎症介质水平的降低, 可减弱外周性伤害性感受器的敏感度,减少自发性疼痛。 此外实验组晕眩、食欲不振、呕吐、呼吸抑制等不良反应总发生率低于对照组,原因在于实验组额外采取罗帕卡因进行镇痛,减少了患者对舒芬太尼的使用量。 当舒芬太尼进入人体时,会让内源性快乐物质失去竞争力,从而产生依赖性,且当舒芬太尼过量时,会让人嗜睡、困惑和恶心,再有甚者会出现低血压,呼吸抑制、死亡等严重不良反应[8]。而本研究通过采用PCIA 通过负荷剂量、持续剂量及自主给药,可实现个性化给药,根据患者个人感受用药量精确, 使镇痛药物处于较低有效血药浓度, 从而减少舒芬太尼这类阿片类药物给人体带来的伤害[9]。 综上所述,PCIA 联合局部浸润罗哌卡因的多模式镇痛对于胃癌患者腹腔镜根治术后镇痛效果明显,可缓解炎症反应,减少舒芬太尼使用总量,降低不良反应发生率。

