超声功率对鸡蛋清蛋白聚集行为的影响
李媛媛,刘丽莉,杨晓盼,郝威铭
(河南科技大学 a.食品与生物工程学院,b.食品加工与安全国家级教学示范中心,河南 洛阳 471023)
0 引言
蛋清作为食品加工中最常见的原料之一,其蛋白质功能多样,其中凝胶性能在食品制造中发挥着重要的作用[1]。凝胶是一种规则的蛋白网状结构,其特性受蛋白质变性聚集的影响[2]。而聚集是蛋白质的特征行为之一[3]。蛋清凝胶对于食品的形态、质地、感官等有一定的改善作用,也可提高其持水力和增稠等性能[4]。
目前,通过改变外界条件,如离子强度、热处理方式、温度等,对蛋清蛋白聚集的途径或机制进行调控,使其发生不同程度的聚集进而影响蛋白凝胶的结构和特性的相关研究成为热点[5-13]。文献[6]研究发现:在高压均化条件下可通过诱导蛋白的非折叠、聚集现象和蛋白结构来调节蛋清的表观黏度和蛋清凝胶的硬度。文献[7]通过研究发现:适度氧化导致蛋清蛋白疏水基团暴露,过度氧化导致表面疏水性降低,高浓度氧化导致蛋清蛋白聚集,平均粒径变大。文献[8]研究了卵白蛋白(ovalbumin,OVA)在75 ℃干燥加热21 d的聚集行为,发现随着反应时间的增加,OVA聚集体增加,并生成不溶性聚集体。文献[9]研究发现:pH值变化使蛋清蛋白凝胶的机械性能和持水性明显降低,改变蛋清蛋白聚集行为,即添加盐和糖可以改善蛋清蛋白凝胶的硬度和弹性。文献[10]通过研究黄原胶的浓度对蛋清蛋白凝胶形成的影响,发现低浓度黄原胶可诱导蛋清蛋白发生聚集,其凝胶的硬度和弹性增加。文献[11]研究发现:酸洗过程中添加不同类型的金属盐离子可以加剧蛋白质的β-折叠,进而促进其聚集,影响蛋清凝胶内部结构的密度和分子力,从而改变凝胶的理化和消化特性。文献[12]通过研究发现:蛋清蛋白(egg white protein,EWP)溶液相对较高的pH可以抑制EWP的热诱导胶凝作用,从而在预热步骤中以相对较高的蛋白质浓度产生热聚集的EWP。以上研究表明:外界条件的改变可以使蛋清蛋白发生不同程度的聚集行为,从而影响蛋白质凝胶的形成。
目前已经发现超声的空穴效应可以改善蛋清蛋白的一些功能特性[14-15],如文献[16]通过研究超声处理对蛋清蛋白结构和凝胶特性的影响,发现超声可改善其凝胶特性。然而,超声作用对蛋清蛋白聚集行为的影响缺乏系统研究,大多集中在其他蛋白质,如:大豆蛋白、肌原纤维蛋白、乳清蛋白等[17-19]。文献[17]研究发现:高强度超声会增加大豆蛋白高相对分子质量聚集体的百分比,并改变芳香族和脂肪族侧链的微环境。文献[18]利用高强度超声修饰肌原纤维蛋白,发现适度的超声强度可促进蛋白质的聚集行为并有效改善其凝胶特性。文献[19]通过研究发现:超声预处理促进了乳清蛋白乳液凝胶微观结构中油滴颗粒聚集体网络和蛋白质聚集体网络的复合,可有效改善乳清乳液的机械性能。因此,超声技术为蛋清蛋白聚集行为的调控提供了一种新思路。
本研究采用不同超声功率处理蛋清液,分析蛋清蛋白的流变学、蛋白结构及其凝胶特性的变化。系统地探究超声功率对蛋清蛋白聚集程度的影响,从而改变其凝胶特性,可为进一步调节蛋清蛋白这一混合蛋白源的聚集行为、探究该行为对其凝胶制品的影响和充分开发利用蛋清资源提供一定的参考。
1 材料与方法
1.1 材料与试剂
鲜鸡蛋,河南省洛阳市大张超市;脲(分析纯),苏州安必诺化工有限公司;溴化钾(分析纯),天津光复经济化工研究所;ANS、三羟甲基氨基甲烷(TRIS)、EDTA-二钠(分析纯),国药控股(上海)化学试剂有限公司。
1.2 主要仪器设备
数控超声波清洗器:KQ-500DE型,昆山市超声仪器有限公司;流变仪:DHR-2型,美国TA公司;紫外分光光度仪:UV2600型,日本日立公司;荧光分光光度计:Cary eclpise型,美国Aglient Cary elipse公司;真空冷冻干燥机:TF-FD-27S型,上海田枫实业有限公司;傅里叶变换红外光谱仪:VERTEX70型,德国Bruker公司;垂直电泳槽:DYCZ-24DN型,上海博通化学科技有限公司;稳压稳流型电泳仪:DYY-6C型,上海博通化学科技有限公司;凝胶成像系统:Gel Doc XR+型,美国伯乐BIO-RAD公司;台式高速离心机:H 1650型,湖南湘仪实验室仪器开发有限公司;食品物性分析仪:SMS TA.XT Epress Enhanced型,英国SMS公司;扫描电子显微镜(scanning electron microscope,SEM):TM3030Plus型,日本岛津公司。
1.3 方法
超声处理蛋清液。在参照文献[20]关于蛋清液制备及超声处理方法的基础上,稍作修改。设计试验组:50%(体积分数)的蛋清蛋白溶液,固定超声时间为20 min,改变超声功率(100 W、200 W、300 W、400 W)。设置对照组为相同体积分数的蛋清蛋白溶液,在其他条件不变的情况下,得到超声处理前后的一系列样品。
流变学分析。根据文献[21]和文献[22]的方法并稍作修改,测定蛋清液的流变特性。在1.0~100 rad/s的振动频率范围内,0.3%的振荡应变,进行样品的动态频率扫描,测量超声处理前后蛋清液的储能模量(G′)和损耗模量(G″)的变化;设置剪切速率为0~300 s-1,20 ℃下,测量样品溶液的表观黏度变化;设置振荡频率为0.1 Hz,应变为1%,以5 ℃/min的速率,测量样品从30 ℃程序升温至90 ℃的黏度变化。
浊度分析。参照文献[23]的方法及公式计算得溶液浊度τ。
表面疏水性分析。采用文献[24]的试验方法,稍作修改。稀释蛋白溶液至体积分数为0.08%,取4 mL蛋白溶液,以ANS作为荧光探针,加入20 μL磷酸盐缓冲液(pH7.4),旋涡振荡,避光静置,设置与参考方法相同的参数,进行荧光光谱测试,所得的最大荧光强度表征疏水性。
巯基含量分析。在文献[25]的试验方法基础上,结合样品稍作修改,测定不同超声功率下蛋清样品的总巯基及游离巯基含量。游离巯基含量测定:用Tris-Gly缓冲液(pH7.4)稀释样品,在蛋白溶液(5 mg/mL)中加入50 μL Ellman试剂,避光1 h,测得离心上清液在412 nm处的吸光值A412。总巯基含量测定:将样品用缓冲液(8 mol/L尿素、Tris-Gly缓冲液、pH7.4)稀释蛋白溶液(1 mg/mL),加入50 μL的Ellman试剂,避光,在412 nm处测得离心上清液的A412。根据文献[25]方法计算巯基含量。
傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)分析。根据文献[26]的方法对冻干后的蛋清粉进行红外扫描分析。
SDS聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分析。将12%(质量分数)的分离凝胶和5%(质量分数)的堆积凝胶在15 mA凝胶的恒定电流下进行电泳。上样量为20 μL,用考马斯亮蓝对蛋白条带进行染色,2 h后脱色至透明。使用标准蛋白(相对分子质量为10~180 ku)为对照,评价其相对分子质量[27]。
凝胶特性分析。将超声处理前后的蛋清液置于80 ℃水浴中加热45 min,制成蛋清蛋白凝胶,冷却,冷藏保存,确保其完整性。
(Ⅰ)凝胶强度分析。参考文献[28]的方法,用食品物性分析仪测量样品的凝胶强度。
(Ⅱ)凝胶失水率分析。将一定质量且大小均等的凝胶,离心10 min后取出,水分吸干后,称质量,计算公式为:
凝胶的持水性=(W0-W1)/W0×100%,
(1)
其中:W0为离心前凝胶质量,g;W1为离心后凝胶质量,g。
(Ⅲ)扫描电子显微镜观察。将制得的凝胶切成大小规则的薄片,参考文献[29]的方法,用SEM观察凝胶样品。
1.4 数据处理
试验所涉及到的测试均作3次重复。用Origin 2018软件作图,SPSS软件进行显著性分析。
2 结果与分析
2.1 超声功率对蛋清液聚集行为的流变特性分析
2.1.1 蛋清液动态频率变化
图1为超声功率对蛋清蛋白动态流变特性的影响。如图1a和图1b所示,样品的储能模量G′均高于损耗模量G″,这表明样品的弹性均大于黏性,即样品中弹性成分更突出,表现出黏弹性固体的性质[30]。高的G′值代表蛋白质具有更好的凝胶化能力,随着动态扫描频率的增加,超声样品的G′和G″值均高于对照组,这与文献[31]的研究结果一致。表明蛋清中的蛋白质种类和组成在超声处理下发生的变化会影响蛋清蛋白溶液的流变性,超声增加了蛋清蛋白的凝胶化能力,这可能是因为蛋清蛋白在超声过程中,由于空化作用,促进了蛋清蛋白聚集行为的发生,降低了蛋白的流动性[32]。此外,由图1c可知:随着扫描频率的增加,试验组样品的相位角正切值(tanδ)均先低于对照组后逐渐升高,说明当扫描频率达到高频区时,超声样品更偏向于黏性流体。
如图1a和图1b所示,试验组在低扫描频率范围内,G′和G″急剧上升,达到25 rad/s后上升的趋势变慢。当频率达到40 rad/s之后,G′及G″的大小均为:200 W>300 W>400 W>100 W>对照组,表明在其他条件相同的情况下,当超声功率为200 W时,蛋清蛋白凝胶化能力的增强效果最佳。
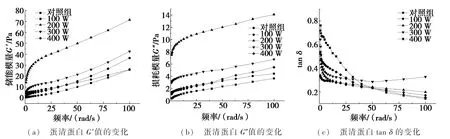
图1 超声功率对蛋清蛋白动态流变特性的影响
2.1.2 蛋清液黏度分析
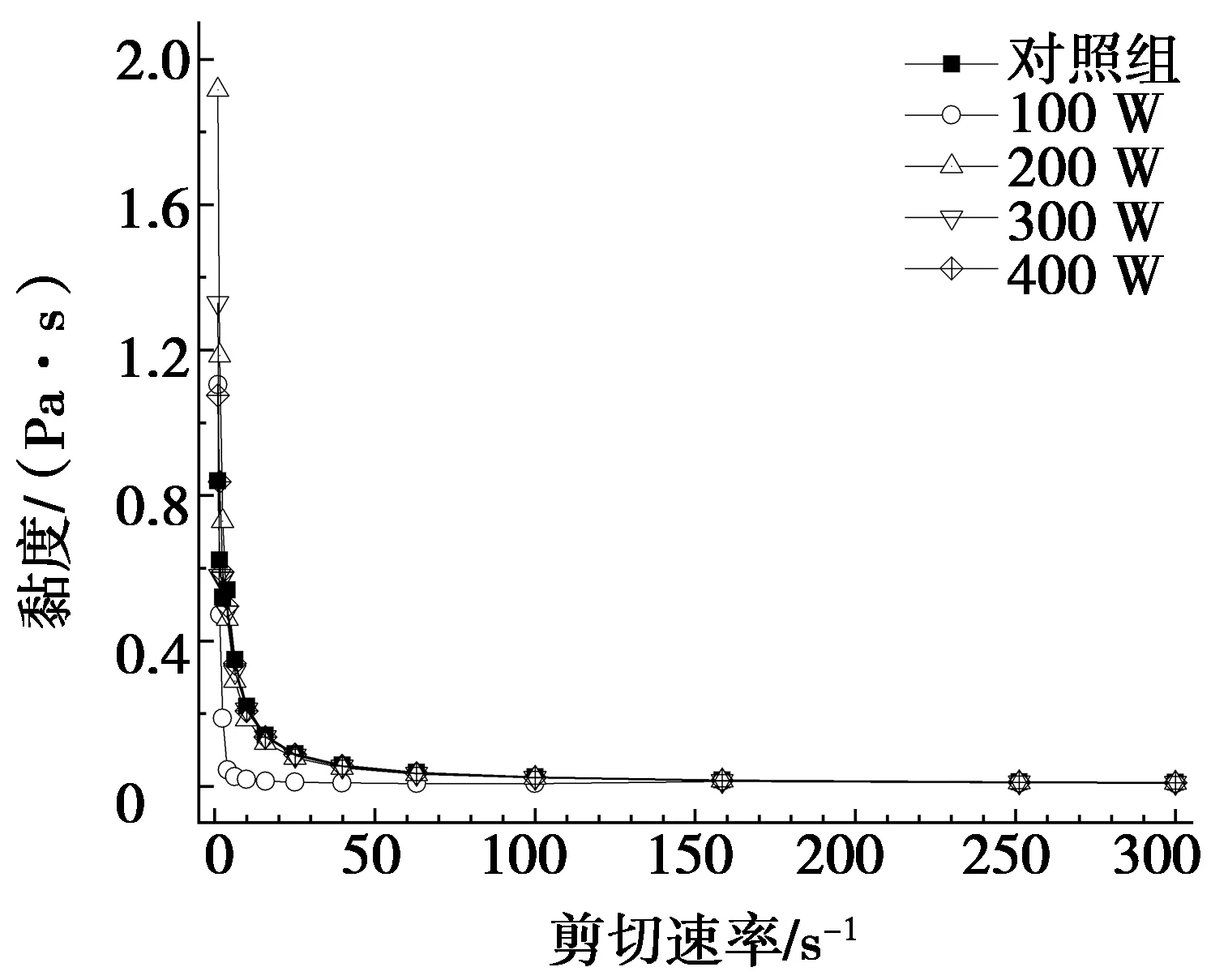
溶液黏度的大小是蛋白在外力作用下的内部摩擦力大小的表征[33]。超声功率对蛋清蛋白溶液黏度的影响见图2。由图2a可知:随着剪切速率的增大,蛋清蛋白溶液黏度逐渐降低,呈剪切稀化现象;随着剪切速率的增大,分子之间结构重新排列后趋于相同,黏度逐渐稳定[34]。当剪切速率为1 s-1,对照组的初始黏度为0.841 Pa·s,而超声样品的黏度均高于对照组,由此可以看出,超声组溶液有较高的黏度。其中,200 W超声组的初始黏度最大,相比对照组增大了1.075 Pa·s。这可能是因为超声的空化效应使蛋清蛋白发生去折叠及聚集,导致溶液中聚集体颗粒较大,使其相互之间的作用加剧,黏度增大。此外,随着剪切速率的增大,黏度出现连续下降的趋势,说明超声并没有改变蛋白溶液的非牛顿流体特性。随着剪切速率的增大,蛋白质聚集体微弱的交联作用被破坏,因而剪切稀化。
如图2b所示,在升温过程中,蛋清蛋白溶液的黏度会出现指数增长区,其中对照组仅在80~85 ℃时开始变性,而超声处理后的蛋清蛋白在60~65 ℃发生变性,并表现出两个变性区,这与文献[30]的研究结果一致。结果表明:超声作用可以有效改善蛋清蛋白凝胶形成的速度。这可能是因为超声可使蛋清蛋白溶液内部发生聚集行为,而蛋白聚集状态形成弱强度弹性蛋白凝胶,从而加快其凝胶化过程。
2.2 超声功率对蛋清液聚集行为的浊度分析
在蛋白质聚集过程中,浊度是表征蛋白质聚集程度的重要指标之一[35]。超声功率对蛋清蛋白溶液浊度的影响见图3。由图3可知:随着超声功率的升高,各样品的浊度相对于对照组先增后降,分别增加了29.27%、61.03%、27.12%和13.56%。超声功率小于200 W时,蛋白溶液的浊度变化呈增长趋势,而当超声功率超过200 W时,溶液的浊度随超声功率的增加而发生不同程度的降低,这与文献[36]的研究结果一致。这可能是因为蛋白质容易复性而导致其溶液体系不稳定,说明超声在一定功率范围内,会使蛋清蛋白发生不同程度的聚集,导致光发生散射,溶液浊度升高。当超声功率为200 W时,蛋清蛋白溶液浊度为1.876 cm-1,较其他试验组显著增加(P<0.05),表明此功率作用下,蛋清蛋白发生的聚集程度最大,蛋白凝胶化能力最强,与图1a和图1b的结果一致。
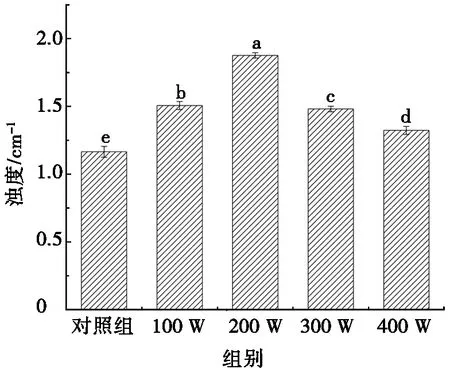
注:小写字母不同表示有显著性差异(P<0.05), 下同。图3 超声功率对蛋清蛋白溶液浊度的影响
2.3 超声功率对蛋清液聚集行为的结构分析
2.3.1 表面疏水性及巯基含量的变化
图4为超声功率对蛋清蛋白溶液表面疏水性及巯基含量的影响。如图4a所示,有无超声处理对蛋清蛋白荧光光谱的整体形状并无显著影响,但光谱位移以及荧光强度却发生了不同程度的改变。与对照组相比,超声处理后样品的荧光光谱发生蓝移,最高荧光强度均有所降低。这表明超声破坏了蛋清蛋白的分子结构,使发色基团暴露在溶剂中,荧光强度降低,表面疏水性下降。这可能是因为超声使溶液内部发生聚集,聚集体的形成使疏水基团被包埋所引起的。
蛋清蛋白巯基含量的变化代表其分子结构的改变。图4b中,图柱上方的大、小写字母不同均表示差异性显著(P<0.05),下同。蛋清蛋白的总巯基含量由大到小为:对照组>400 W>100 W>300 W>200 W(P<0.05);游离巯基含量由大到小为:对照组<400 W<100 W<300 W<200 W(P<0.05)。由图4a和图4b可知:超声样品的荧光强度、总疏水基团显著降低(P<0.05),游离巯基显著增加(P<0.05),这可能是因为蛋白质聚集过程中,分子间相互作用,而分子间发生去折叠,使疏水基团暴露到表面[32]。表明超声作用引起蛋清蛋白发生的疏水聚集,影响暴露巯基的含量和形成二硫键的能力,从而改变分子的二级结构。

2.3.2 FT-IR分析
蛋清蛋白聚集行为不仅改变了表面疏水性和巯基含量,也改变了其蛋白质的二级结构。不同超声功率时蛋清蛋白的FT-IR光谱图见图5。如图5所示,不同超声功率处理的蛋清蛋白在3 750~3 100 cm-1位置的峰强度存在很大差异(400 W>200 W>300 W>100 W>对照组),表明超声功率会影响其蛋白的水合能力。1 700~1 600 cm-1处为酰胺Ⅰ带,其不仅与氢键作用力紧密相关,而且影响蛋清蛋白的二级结构。超声前后的蛋清蛋白均在酰胺Ⅰ带出现了特征吸收现象,因此将不同超声功率的样品中蛋清蛋白的酰胺Ⅰ带的红外谱图做二阶导数,采用高斯(Gauss)面积法拟合,通过峰位判断二级结构种类并确定其相对含量[37],结果见表1。

图5 不同超声功率时蛋清蛋白的FT-IR光谱图

表1 不同超声功率处理的蛋清蛋白酰胺Ⅰ带二级结构相对含量
蛋清蛋白二级结构的组分随超声处理功率的变化而变化,结合表1可知,对比对照组蛋白,4种超声处理蛋清液中蛋清蛋白二级结构发生如下变化:(1)对照组蛋清蛋白二级结构最主要的组成成分是α-螺旋结构,占总量的34.36%。α-螺旋是最稳定的蛋白质二级结构,随着超声功率的增大,α-螺旋相对含量显著降低(P<0.05)。此过程中,蛋清蛋白结构的稳定性下降,导致α-螺旋中氢键逐渐断裂,发生解螺旋。(2)随着超声功率的增大,无规则卷曲相对含量先升后降,200 W时蛋清蛋白的相对含量为21.20%,明显高于对照组蛋清蛋白的18.77%(P<0.05)。表明超声使蛋白质二级结构部分被破坏,结构的随机性增强。(3)相比于对照组的蛋清蛋白,超声处理蛋清蛋白中的β-折叠和β-转角相对含量在超声过程中分别呈先增加后降低和先降低后增加的趋势。这种变化趋势与蛋清蛋白的变性及形成聚集体有关。因而可以推断不同超声功率处理过程中β-折叠、β-转角结构对蛋清蛋白的聚集行为具有重要作用。
当超声频率为200 W时,α-螺旋结构相对含量明显下降(P<0.05),且随着超声功率的增加,该变化更加明显,这种变化趋势与蛋白质的聚集程度有关;在400 W时,无规则卷曲相对含量明显下降(P<0.05),这与在400 W功率时蛋清蛋白中不同聚集体之间的平衡性变化有关。根据文献[38]关于蛋白α-螺旋相对含量与凝胶硬度之间呈负相关的报道,随着超声频率的增加,α-螺旋相对含量降低,其氢键作用减弱,使蛋清蛋白分子结构展开。

M. Marker; 0.对照组; 1. 100 W; 2. 200 W; 3. 300 W; 4. 400 W。 图6 不同超声功率下蛋清蛋白的SDS-PAGE图
2.3.3 SDS-PAGE分析
图6为不同超声功率下蛋清蛋白的SDS-PAGE图。如图6所示,蛋清蛋白在超声之后蛋白质条带没有明显变化,这说明超声并没有改变蛋清蛋白的一级结构。超声作用引起的蛋清蛋白聚集对蛋白质的一级结构并没有造成影响,聚集行为仅发生在蛋白质多肽链之间,从而影响其内部空间结构,使分子之间作用力发生改变。
2.4 蛋清蛋白凝胶特性的分析
影响蛋清蛋白凝胶特性的主要是蛋白质变性和聚集程度,图7为超声功率对蛋清蛋白凝胶强度和凝胶失水率的影响。由图7可知:相比对照组,超声样品的凝胶强度均有明显提高(P<0.05),其值大小为:200 W>300 W>400 W>100 W>对照组,这与图1a、图1b和图3所示结果一致,可能是因为超声作用使蛋白质变性,发生分子间聚集有利于形成规则的蛋白质网络结构,从而有助于蛋清蛋白凝胶性能的提高。随着超声功率的增加,蛋清蛋白的凝胶强度呈先增加再降低的趋势;当超声功率达到200 W时,蛋清蛋白凝胶强度达到最高,为140.85 g,相较对照组增加了132.54%,且与其他功率相比有明显的增大(P<0.05)。这可能是因为大于200 W功率的超声处理使蛋清蛋白溶液中的蛋白质逐渐展开,并发生了一定的降解。由图7可以看出:失水率由小到大依次为200 W<300 W<400 W<100 W<对照组,当功率为200 W时,失水率为47.61%,相较对照组降低了32.02%,且明显低于其他试验组(P<0.05),这可能是因为超声波的空穴效应使蛋清白质发生了一定的去折叠和聚集,从而蛋清蛋白凝胶形成的空间网络结构更加均一、稳定,对水分子的绑定更加坚固。凝胶硬度越大,失水率越小,可能是因为当超声功率为200 W时,蛋白质变性程度增大,分子间相互结合,形成相对紧密的三维网状结构,孔隙变小,导致凝胶与水的结合能力最强,失水率最低[32]。
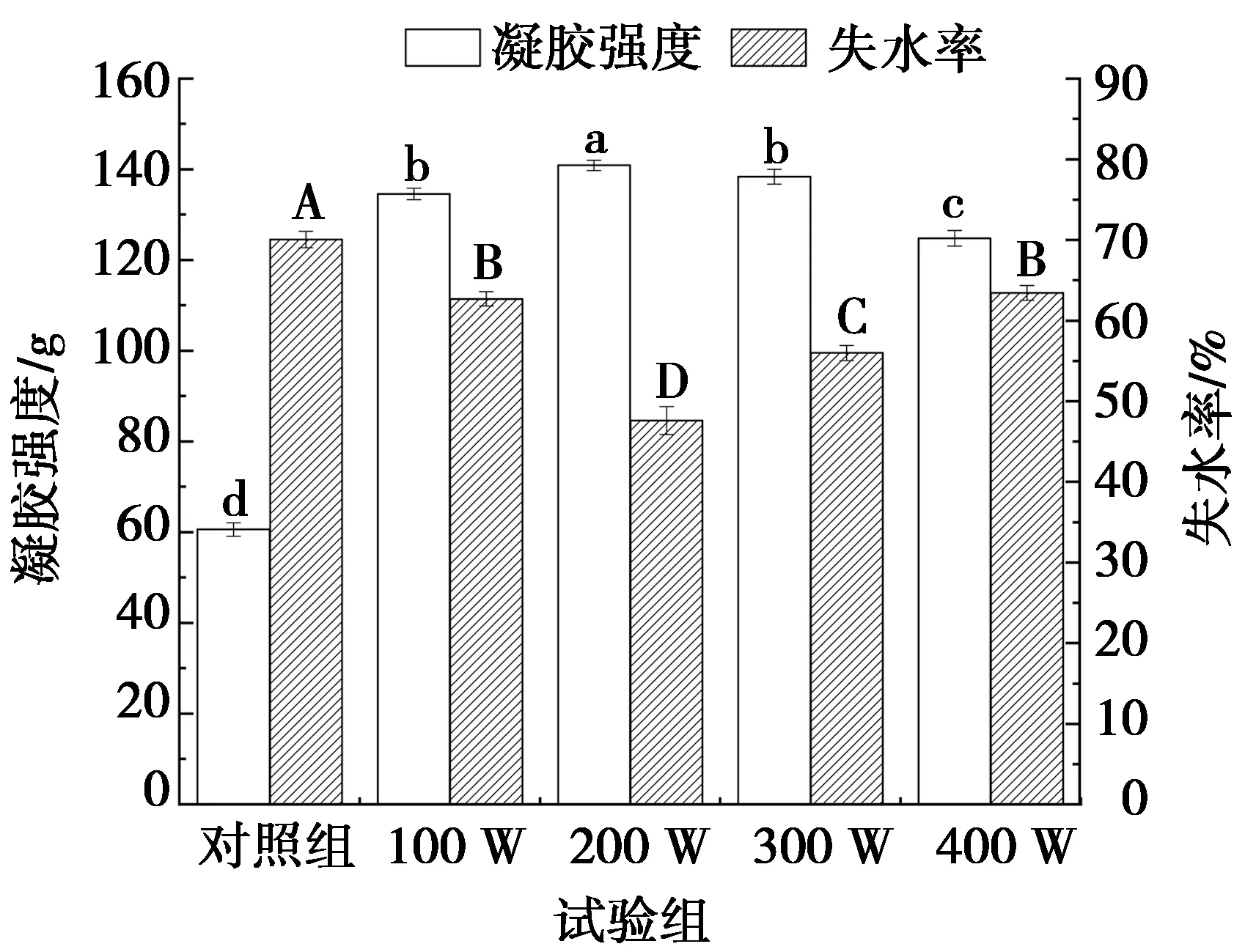
图7 超声功率对蛋清蛋白凝胶特性的影响
2.5 蛋清蛋白凝胶微观结构分析
一定程度的蛋白质聚集行为影响凝胶化的网络结构。图8为不同超声功率下蛋清蛋白凝胶的微观结构图(×3 000),可以反映出凝胶内部的表面微观结构。在相同放大倍数(×3 000)下,蛋清蛋白在不同超声功率下所形成的凝胶,其微观结构具有较大差异。在超声功率100 W(见图8b)时,凝胶表面蛋白有小范围的聚集,随着超声功率的增加聚集逐渐聚拢,表面颗粒也在超声处理后由明显的带状(见图8a)逐渐形成块状聚集(见图8c~图8e))。由于疏水性相互作用和超声波产生的冲击力,蛋白形成聚集体,且蛋白聚集体颗粒逐渐增大,并影响着凝胶的网络结构[39]。而200 W(见图8c)时,凝胶相对则具有较为致密的表观结构,颗粒分布相对均匀,这与本文流变特性及凝胶强度分析结构相吻合。

图8 不同超声功率下蛋清蛋白凝胶的微观结构图(×3 000)
3 结论
(1)蛋清溶液在超声作用下黏度升高,不同超声功率下蛋清蛋白在高频区的G′及G″的大小均为:200 W>300 W>400 W>100 W>对照组。随着超声功率的升高,蛋清蛋白溶液的浊度相比对照组分别增加了29.27%、61.03%、27.12%和13.56%。随着超声功率的增加,蛋清蛋白溶液游离巯基含量增加,荧光强度、总疏水基团和α-螺旋相对含量逐渐降低,这种变化趋势与蛋白质的聚集程度有关,其氢键作用减弱,蛋清蛋白分子结构展开,内部疏水基团暴露。
(2)超声后蛋清蛋白凝胶强度均有明显提高(P<0.05),大小为:200 W>300 W>400 W>100 W>对照组;失水率为200 W<300 W<400 W<100 W<对照组。当功率为200 W时,蛋清蛋白凝胶强度达到最高(140.85 g),失水率最低(47.61%),此时凝胶表面颗粒分布相对均匀,结构较为致密,蛋清蛋白发生的聚集使其凝胶性能表现最佳。超声可使蛋清蛋白发生去折叠及聚集行为,从而促进蛋白凝胶的形成,改善凝胶结构。
