持有Pi9基因的水稻单基因系IRBL9-W对稻瘟病菌苗期和成株期抗性差异
刘树芳 董丽英 李迅东 周伍民 杨勤忠, *
持有基因的水稻单基因系IRBL9-W对稻瘟病菌苗期和成株期抗性差异
刘树芳1, 2, #董丽英1, 2, #李迅东1, 2周伍民1,3杨勤忠1, 2, *
(1云南省农业科学院 农业环境资源研究所/云南省农业跨境有害生物绿色防控重点实验室,昆明 650205;2农业农村部昆明作物有害生物科学观测实验站,昆明 650205;3云南大学 农学院,昆明 650091;#共同第一作者;*通信联系人,E-mail: qzhyang@163.com)
是一个广谱稻瘟病抗性基因,田间病圃监测发现持有的水稻单基因系IRBL9-W在苗期高抗稻瘟病,但却感穗瘟。探明水稻单基因系IRBL9-W在苗期抗病而孕穗末期感染穗颈瘟的原因,为基因在水稻抗病育种中的有效利用提供参考。利用从IRBL9-W穗颈瘟病斑上分离的8个单孢菌株以及实验室保存的单孢菌株Y363,在温室分别对单基因系IRBL9-W苗期和孕穗末期进行接种鉴定;并利用病原菌基因的特异引物对9个单孢菌株进行PCR扩增及产物测序;提取水稻单基因系IRBL9-W苗期叶片和抽穗期穗部的总RNA,通过半定量RT-PCR以及实时qRT-PCR分析基因在苗期和穗期的表达。在温室人工喷雾接种条件下,IRBL9-W在苗期对从穗颈瘟上分离的8个单孢及对照菌株Y363均表现为抗病;随机选取的2个从IRBL9-W穗颈瘟病样分离的单孢菌株(YX2-7-1和YX2-15-1)及对照菌株Y363对孕穗末期IRBL9-W注射接种,接种的植株表现出典型的穗颈瘟症状;的等位基因分析结果表明,与相比,Y363中的等位基因与完全相同,而从IRBL9-W穗瘟分离的8个单孢菌株中编码区与基因完全相同,但在编码起始位置上游−264 bp处缺失16 bp的一段序列。由于IRBL9-W苗期对这些菌株均表现抗病,推测这段序列的缺失并不影响基因的功能;实时qRT-PCR分析结果表明,基因在穗部的表达量为苗期叶片表达量的47.3%。在水稻单基因系IRBL9-W中,与苗期叶片中基因的表达量相比,基因在穗部表达量的明显降低可能是造成IRBL9-W穗期感稻瘟病的原因。
水稻;稻瘟病菌;;苗期;成株期
水稻(L.)是世界上最重要的粮食作物之一,作为全球近半数人口的主食,在粮食安全中具有特殊的重要性。由真菌(无性态为)[1]引起的水稻稻瘟病是世界水稻产区危害最为严重的病害之一[2,3],不仅能侵染水稻的地上部分,同时也能侵染根部[3-4]。稻瘟病每年可造成10%~30%的水稻产量损失,严重的田块甚至绝收[3,5-6]。稻瘟病在田间常见的症状有叶瘟和穗瘟,叶瘟发生在水稻的营养生长阶段,在叶片上形成典型的纺锤形坏死病斑;而穗瘟发生在水稻的生殖生长阶段,病原菌感染水稻的穗颈基部、穗节或谷粒,造成穗粒空瘪,导致水稻严重减产[7]。
“水稻-稻瘟病菌”的互作模式符合Flor的“基因对基因”假说,即持有特定抗病基因的水稻品种与病原菌互作时,只有病原菌持有与该抗性基因相对应的无毒基因时,品种才表现出抗性,其他任何一种情况下品种均表现感病[8-10],水稻稻瘟病菌模式已成为植物-真菌致病系统研究中的一种重要模式系统[11]。生产实践证明,抗性品种的合理利用是控制稻瘟病最经济、有效和环境友好的措施。通过广泛的遗传分析,从水稻中鉴定并已定位了100多个主效抗性基因,其中28个已被克隆[12]。相较于穗瘟抗性在评价中存在的周期长、工作量大等问题,苗期人工接种周期短、稳定性好、效率高,在抗性遗传分析与抗性基因的挖掘中被广泛采用。在已鉴定的稻瘟病抗性基因中,绝大部分的基因是通过对苗期叶瘟的抗性解析并定位的,而仅有少部分的基因同时进行了叶瘟和穗瘟的抗性分析[13-15];来自籼稻品种谷梅2号的[13]和来自云南粳稻地方品种Yangmaogu的[14]既抗叶瘟也抗穗瘟,而来自日本籼稻品种Modan的抗病基因抗穗瘟却不抗叶瘟[15]。已克隆的、和均编码具有核苷酸结合位点-富含亮氨酸结构域(nucleotide- binding site and leucine-rich repeat, NBS-LRR)的蛋白,是已克隆的植物抗病基因中最多的一种类型[14,16-17]。Fang等[18]将来源于太湖流域的粳稻地方品种Bodao中的一个穗瘟抗性数量性状基因座(quantitative trait locus, QTL)精细定位到水稻第11染色体长臂末端40.6 kb的物理区间内;而Wang等[19]将太湖流域的另一个粳稻地方品种Jiangnanwan中兼抗叶瘟和穗瘟的QTL精细定位到水稻第11染色体长臂末端282 kb的物理区间内;所在区域涵盖了所在的位置,目前这2个基因是等位还是紧密连锁尚不清楚。通过广泛的遗传分析,目前已鉴定并定位了近20个抗穗瘟或兼抗叶瘟的主效抗性基因或QTL[12]。这些穗瘟抗性主效基因/QTL位点的定位,为开展基因的克隆并进一步阐明叶、穗瘟抗性的关系提供了良好的研究素材。
来源于小粒野生稻()的基因编码NBS-LRR蛋白[20],对13个国家的43个稻瘟病菌株均表现出很高的叶瘟抗性,具有广谱抗病的特点[21];后续的大量研究进一步验证了其对叶瘟抗性的有效性[22-25]。有意思的是,2016年我们对田间病圃用于监测稻瘟病菌群体致病性的24个以丽江新团黑谷为遗传背景的水稻单基因鉴别系进行穗瘟抗性监测时,发现苗期高抗叶瘟的水稻单基因系IRBL9-W()感染穗瘟。为进一步研究IRBL9-W感染穗瘟的原因,本研究用分离自该水稻单基因系IRBL9-W穗瘟标样的单孢菌株,在温室对苗期和孕穗末期的IRBL9-W进行稻瘟病菌接种分析,并采用分子检测技术和方法,以尝试解析IRBL9-W在苗期及穗期抗性差异的原因。
1 材料与方法
1.1 实验材料
2016年从水稻单基因系IRBL9-W上采集的8个穗颈瘟病样上分别分离的8个单孢菌株以及实验室保存的单孢菌株Y363,以及由国际水稻研究所Kobayashi N博士提供的以丽江新团黑谷为遗传背景的24个持有不同抗病基因的单基因系及对照感病品种丽江新团黑谷(LTH)(表1),用于本研究。
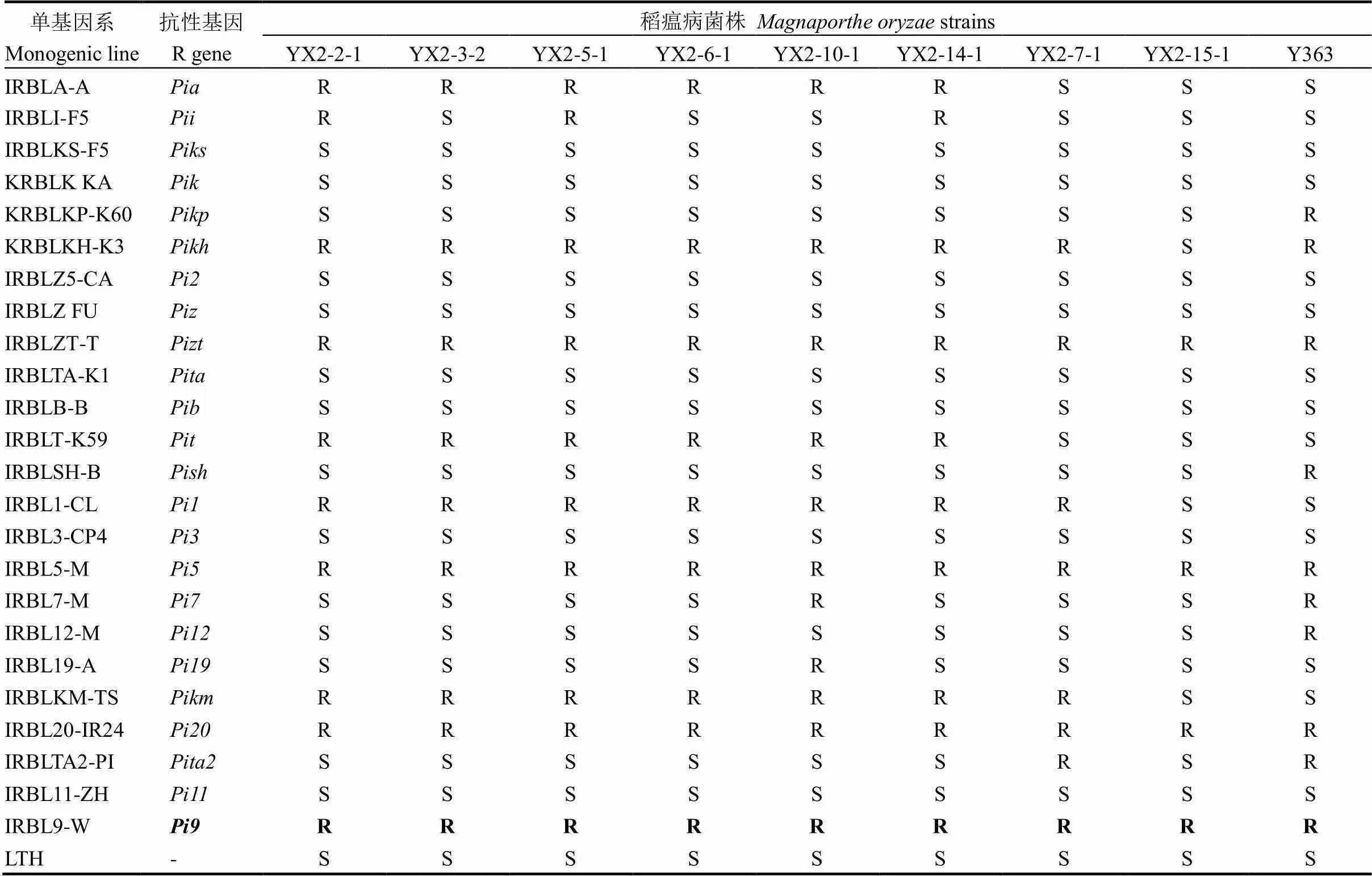
表1 稻瘟病菌单孢菌株在单基因系上的致病性测定
R-抗性;S-感病。
R, Resistance; S, Susceptible.
1.2 叶瘟接种评价
首先将低温保存于滤纸片上的8个水稻单基因系IRBL9-W穗瘟标样上分别分离的8个稻瘟病菌单孢菌株(YX2-2-1, YX2-3-2, YX2-5-1, YX2-6-1, YX2-10-1, YX2-14-1, YX2-7-1, YX2-15-1)以及对照菌株Y363在PDA培养基上活化备用;24个单基因鉴别系及对照LTH在浸种催芽后,在温室用镊子播于装有秧田土的 12 cm×18 cm×5 cm塑料育苗盒内,每品种播5粒,设3次重复;滤纸片上长期保存的菌株活化于PDA斜面培养基上,在水稻材料播种7 d后分别将供试菌株接种于燕麦培养基上;待水稻苗长至3.5叶期时,采用喷雾接种法将单孢菌株分别接种到单基因鉴别系上,7 d后调查抗感反应的表型。稻瘟病菌培养、接种及调查方法参照董丽英等[23]的方法进行。
1.3 水稻穗颈瘟接种评价
在温室将水稻单基因系IRBL9-W移栽在高度为25 cm,直径为30 cm的圆形黑色塑料桶中,每桶移栽5苗。当单基因系IRBL9-W生长至孕穗末期时,分别选取15株孕穗末期的水稻植株,并挂牌编号用于稻瘟病菌YX-2-7-1,2016YX-2-15-1和Y363的接种;每个单株用1 mL医用注射器在剑叶叶鞘近基部缓慢注入1 mL的孢子悬浮液至叶鞘内;15株对照单株分别注射1 mL不含稻瘟病菌孢子的接种液。接种后的水稻植株放置于保湿培养箱(IKEDA)中25℃黑暗培养24 h,之后转移至温室继续培养,4周后进行穗瘟的调查;稻瘟病菌的培养及孢子悬浮液的制备同叶瘟实验;调查标准参照刘水芳[26]等。
1.4 AvrPi9基因的PCR检测
根据已克隆的无毒基因[27](登录号为KM004023.1)的序列,利用Oligo 7软件分别在起始密码子上游661 bp及终止密码子下游137 bp处设计扩增的特异引物,扩增片段长度为1141 bp,引物序列为AvrPi9F,5′-GGTCCACTGCT CCATCTTGTTTG-3′;AvrPi9R,5′-CCCTTCTGCGC ATTACTGATACC-3′。通过PCR扩增9个稻瘟病菌菌株中的等位基因,并对PCR扩增产物进行测序分析。稻瘟病菌用液体培养基(每1 mL培养基含10 g蔗糖、2 g KH2PO4、2 g 酵母粉)在25℃下培养4 d,收集菌丝后用真菌DNA提取试剂盒进行DNA的提取。用分光光度计(NP80 Touch,IMPLEN)检测其浓度,并配制浓度为10 ng/μL的DNA工作液。PCR扩增的反应体系25 μL,其中含有2×Esmix 12.5 μL、10 μmol/L AvrPi9F引物1 μL、10 μmol/LAvrPi9R引物1 μL、10 ng/μL模板DNA 1 μL,ddH2O 9.5 μL。PCR扩增在C1000(Bio Rad)上进行, PCR扩增的反应条件如下:95℃下预变性3 min;95℃下变性30 s,55℃下退火30 s,72℃下延伸90 s,共32个循环;最终72℃下延伸5 min。PCR扩增产物取1.5 μL 在1% 琼脂糖凝胶上进行水平电泳并检测(图2),剩余的样品进行测序。
1.5 第1链cDNA的合成及半定量RT-PCR
采用OminiPlant RNA Kit(DNase I)提取IRBL9-W苗期叶片和孕穗末期穗部组织的总RNA。分别取1 μg的苗期叶片和穗部组织的总RNA,利用逆转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser,TAKARA)根据说明书的操作进行第1链cDNA的合成,反应总体积为20 μL,反应结束后加入20 μL的灭菌超纯水将第1链cDNA稀释备用。半定量RT-PCR利用的特异引物NBS2-G和NBS2-H进行扩增,并以作为内参基因,内参基因的正向引物为5′-CGTCTGCGATAATGGA ACTGG-3′,反向引物为5′- CTGCTGGAATGTGCT GAGAGA-3′[20]。分别以叶片和穗部组织逆转录的cDNA为模板,进行半定量RT-PCR扩增;PCR扩增的反应体系20 μL,其中含有2×Esmix 10 μL、10 μmol/L正向引物1 μL 、10 μmol/L反向引物1 μL 、模板cDNA 1 μL,ddH2O 7 μL,PCR扩增在C1000(BioRad)上进行,PCR扩增基因的反应循环数为22个,扩增基因的反应循环数分别为25、28、30、33个;PCR条件如下:95℃下预变性3 min;95℃下变性30 s,62℃下退火40 s,72℃下延伸1 min;最终延伸5 min。PCR扩增产物取3 μL在1%的琼脂糖凝胶上进行水平电泳检测。
1.6 实时qRT-PCR检测
采用前面描述的方法用苗期叶片及穗部提取的总RNA合成第1链cDNA,然后用2 μL 第1链cDNA反应液作模板进行qRT-PCR。扩增的引物组合为NBS2-G/NBS2-H,为内参基因[20]。选用SYBR Green试剂(iTaqTMUniversal SYBR Green Supermix,Bio Rad),设3次重复,qRT-PCR扩增在实时荧光定量PCR检测系统(Bio-RAD CFX96 Real-Time PCE Dection System)上进行分析。qRT-PCR体系为20 μL,含有2×SYBR Green Supermix 10 μL,cDNA模板2 μL,10 μmol/L的正反向引物各0.6 μL,ddH2O 6.8 μL。qRT-PCR条件如下:95℃下预变性30 s;95℃下变性5 s,62℃下退火延伸60 s,共进行40个循环。
2 结果与分析
2.1 水稻单基因系IRBL9-W在温室苗期和穗期接种鉴定分析
用以丽江新团黑谷为遗传背景的24个水稻单基因鉴别系,在3.5叶期接种上述9个稻瘟病菌株,7 d后调查表型。接种结果显示(表1),接种9个菌株的对照感病品种丽江新团黑谷均发病,表明这9个菌株均具有致病活性,且对不同的单基因系均表现出不同的抗感反应类型,致病类型呈现出多样性。而单基因系IRBL9-W在苗期对全部9个菌株均表现抗病,表明9个菌株均持有与抗病基因对应的无毒基因。
利用随机选取的2个分离自穗颈瘟病样的单孢菌株(YX-2-7-1和YX-2-15-1)及对照菌株Y363,在水稻孕穗末期通过注射接种的方法分别接种15个单穗。结果显示,接种稻瘟病菌悬浮液的植株感染穗瘟,形成白穗、空瘪(表2,图1-A~C),表明本研究使用的3个稻瘟病菌菌株能成功侵染稻穗,引起穗瘟的发生。而用不含稻瘟病菌孢子的接种液接种的15株IRBL9-W的穗部未见任何症状,表明不含孢子的接种液对植株的正常生长没有影响。
2.2 AvrPi9基因检测及测序分析
为验证苗期致病性测定分析推断9个菌株均含有基因的结果,利用根据基因序列设计的特异引物对上述9个单孢菌株进行PCR扩增,PCR产物在1%的琼脂糖凝胶电泳检测,获得一条特异性扩增并与预期分子量大小相当的条带(图2);PCR产物测序分析结果表明,Y363中扩增的序列与的序列完全相同,而8个从IRBL9-W感病的穗瘟病斑上分离的8个单孢菌株的序列在基因的编码区与的完全相同,但在编码起始位点(ATG)上游−264~−279 bp位置的16个碱基缺失。结合苗期9个菌株接种IRBL9-W均不致病,表明这16 bp序列的缺失对基因的功能没有影响。
2.3 半定量RT-PCR电泳分析
为进一步分析基因在苗期和成株期抗性反应差异的原因,采用半定量RT-PCR对抗病基因苗期叶片和抽穗期穗部的表达进行分析,以基因作为内参基因。结果显示,当扩增至22个循环时,内参基因的表达便能检测到,且扩增产物带型的亮度相近;而基因的表达需要到25个循环时才能检测到,且随着循环数的增加PCR扩增产物的条带更加明显,结果进一步发现穗部组织的表达量明显低于苗期叶片组织中的表达量(图3-A)。综合IRBL9-W()在苗期接种的抗病表型,孕穗末期穗部接种相同的菌株时IRBL9-W则出现感病的反应,表明表达量的降低是感穗瘟的原因。
a-植株数量;b-不含稻瘟病菌孢子的接种液。
arefers to the number of plants;brefers to inoculation solution withoutspores.

A~C-IRBL9-W接种菌株YX2-7-1、YX2-15-1和Y363在孕穗末期的症状; D~F-IRBL9-W(左)和丽江新团黑谷(右)苗期接种菌株YX2-7-1、YX2-15-1和Y363后的症状。
Fig. 1. Symptoms of monogenic line IRBL9-W inoculated withfungus at late-booting stage and seedling stage.
2.4 实时qRT-PCR扩增检测
为验证并检测在苗期及成株期表达的差异,通过实时荧光定量qRT-PCR进一步检测了基因在两个时期的表达情况。结果表明,在苗期叶片组织和成株期穗部组织的表达量确实存在显著差异,而且穗部组织的表达量仅为苗期叶片组织的47.3%(图3-B);结果进一步说明,当基因的表达量降至苗期表达量的近47.3%时,植株已不能正常防御稻瘟病菌的浸染。
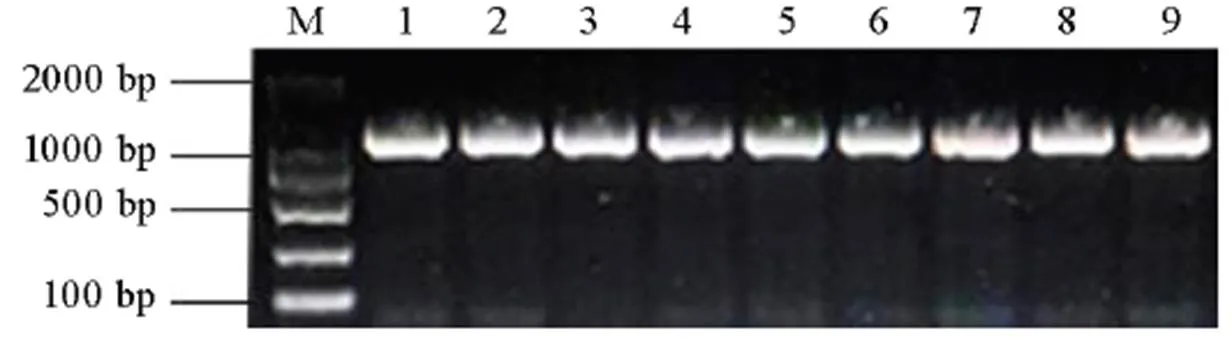
M-DNA分子量标记; 条带1~9分别指稻瘟病菌菌株YX2-2-1, YX2-3-2, YX2-5-1, YX2-6-1, YX2-10-1, YX2-14-1, YX2-7-1, YX2-15-1和Y363。
Fig. 2. Amplification offrom differentstrains.
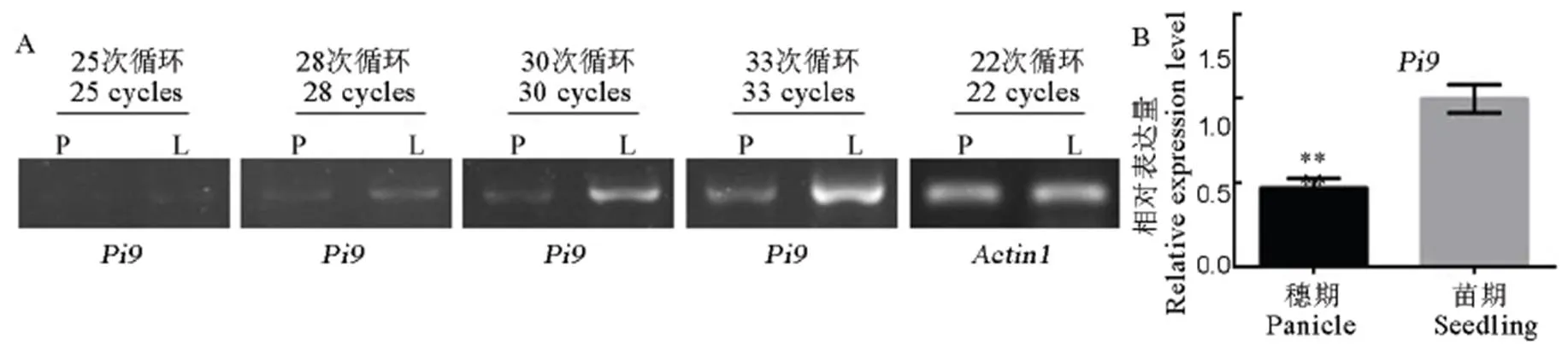
A-Pi9基因的半定量分析。从成株期穗部(P)及苗期叶片(L)制备的cDNA用作PCR模板进行扩增,Actin1用作内参基因;B-实时荧光定量RT-PCR比较分析Pi9基因在苗期和穗期的表达量。
Fig. 3. Expression level ofgene.
3 讨论
在水稻抗稻瘟病基因的研究中发现,尽管有些水稻品种/品系的抗病基因/QTL对叶瘟和穗瘟的抗性表现正相关[7, 13, 14, 16, 19],但有些水稻品种抗性基因的叶瘟与穗瘟却表现出负相关[7]。如对穗瘟有较好的抗性,但在营养生长阶段却由于基因的过低表达而感染叶瘟[17],而来源于Zhong156的(t)基因能有效抵抗稻瘟病菌株92-183的叶瘟侵染,但不能阻止其穗瘟侵染[13],表明抗性基因对叶、穗瘟的抗性存在差异。大量的苗期接种研究表明,在苗期对叶瘟具有广谱抗性[21-25]。本研究利用3个稻瘟病菌菌株在抽穗期接种发现IRBL9-W表现出典型的感病症状,表明基因在穗期未能像苗期一样表现出良好的抗病能力,而Wu等研究近等基因系稻瘟病抗性时也曾报道基因在苗期叶瘟抗性优于穗瘟抗性的现象[28-29]。本研究进一步发现,与苗期叶片组织中的表达量相比,基因在穗部组织的相对表达量仅为苗期叶片组织的47.3%,表明基因表达量降低导致IRBL9-W感染穗瘟,也进一步说明组成型表达的抗性基因必须达到一定的表达丰度后才能有效抵抗稻瘟病菌的入侵。目前对抗病基因在苗期叶片组织与抽穗期穗部组织表达丰度比较的报道不多。Hayashi等发现在苗期由于表达量低而表现出感病,但通过过表达分析发现表达量的增加可以提高对叶瘟的抗性[17],以及苗期、穗期均具有类似的高表达量的基因表现出兼抗叶瘟和穗瘟的表型[14],支持了本研究中基因在穗期感病是由于穗期穗部组织的表达量比苗期叶片组织表达量低的推论。对不同抗性基因的深入研究,将进一步阐明基因的表达量与抗性表型之间的关系,这对于有效选择标靶基因开展稻瘟病抗性育种具有很好的促进作用。
稻瘟病菌无毒基因中碱基序列的插入/缺失、转座子/反转录转座子的插入可导致无毒基因功能的丧失,而使得持有无毒基因相应抗病基因的品种表现出感病[30]。在本研究中,分离自IRBL9-W感病的8个独立病斑的单孢菌株中基因在其编码区上游−264~−279 bp位置发生一段16bp (TCTCC TACACTGGGGC)序列的缺失,但编码区序列未发生任何改变,且苗期接种IRBL9-W时,IRBL9-W表现为抗病反应,在IRBL9-W孕穗末期注射接种时,IRBL9-W感染穗颈瘟,与含有完整基因的菌株Y363表现出相同的结果,表明编码区上游这16 bp的缺失并不影响这些菌株中的正常识别功能。
在水稻抗稻瘟病育种中,阐明所用靶标基因对叶瘟和穗瘟的抗性特性是进行抗性基因聚合育种的关键。近年来,由于抗病基因在苗期表现出广谱的抗病特性而在水稻抗病分子育种中被广泛应用[30-33]。而本研究揭示出不抗穗瘟问题,这给如何更好地利用基因解决稻瘟病的抗性提出了新的挑战;有效聚合广谱抗叶瘟的基因以及其他抗穗瘟或兼抗叶、穗瘟的基因,以拓宽品种的抗谱,如与、等基因的聚合,以选育抗叶、穗瘟的新品种,赋予品种持久抗性。如何有效提高基因在成株期的表达量来提高其穗瘟抗性能力是需要进一步探索的问题。
本研究采用从感染穗颈瘟的病斑上分离的单孢菌株来分析基因对叶、穗瘟的抗感反应评价,研究结果揭示出基因在苗期抗叶瘟但不抗穗瘟。在实际生产中,此方法也可用于其他抗性基因开展类似的研究,以揭示特定抗病基因是否同样存在叶、穗瘟抗性差异的问题,可为品种叶、穗瘟抗性的评价提供借鉴和参考。
[1] Couch B C, Kohn L M. A multilocus gene genealogy concordant with host preference indicates segregation of a new species,, from[J]., 2002, 94(4): 683-693.
[2] Wilson R A, Talbot N J. Under pressure: Investigating the biology of plant infection by[J]., 2009, 7: 185-195.
[3] Savary S, Willocquet L, Pethybridge S J, Esker P, McRoberts N, Nelson A. The global burden of pathogens and pests on major food crops[J]., 2019, 3(3): 430-439.
[4] Sesma A, Osbourn A E. The rice leaf blast pathogen undergoes developmental processes typical of root-infecting fungi., 2004, 431(7008): 582-586.
[5] Skamnioti P, Gurr S J. Against the grain: Safeguarding rice from rice blast disease[J]., 2008, 27(3): 141-150.
[6] Dean R, van Kan J A L, Pretorius Z A, Hammond-kosack K E, Pietro A D, Spanu P D, Rudd J J, Dickman M, Kahmann R, Ellis J, Foster G D. The top 10 fungal pathogens in molecular plant pathology[J]., 2012, 13(4): 414-430.
[7] Puri K D, Shreshta S M, Chhetri G B K, Joshi K D. Leaf and neck blast resistance reaction in tropical rice lines under greenhouse condition[J]., 2009, 165(3): 523-532.
[8] Flor H H. Current status of the gene-for-gene concept[J]., 1971, 9(1): 275-296.
[9] Silué D, Notteghem J L, Tharreau D. Evidence of a gene-for-gene relationship in thepathosystem[J]., 1992, 82: 577-580.
[10] Jia Y, McAdams S A, Bryan G T, Hershey H P, Valent B. Direct interaction of resistance gene and avirulence gene products confers rice blast resistance[J]., 2000, 19: 4004-4014. https://doi. org/10.1093/ emboj/19.15.4004 PMID: 10921881.
[11] Ebbole D J.as a model for understanding host-pathogen interactions[J]., 2007, 45(1): 437-456.
[12] Kalia S, Rathour R. Current status on mapping of genes for resistance to leaf and neck-blast disease in rice[J]., 2019, 9: 209.
[13] Zhuang J Y, Ma W B, Wu J L, Chai R Y, Lu J, Fan Y Y, Jin M Z, Leung H, Zheng K L. Mapping of leaf and neck blast resistance genes with resistance gene analog, RAPD and RFLP in rice[J]., 2002, 128: 363-370.
[14] Ma J, Lei C, Xu X, Hao K, Wang J, Cheng Z, Wan J., encoding a novel CC-NBS-LRR protein, confers resistance to leaf and neck blast in rice[J]., 2015, 28(5): 558-568.
[15] Fujii K, Hayano-Saito Y, Saito K, Sugiura N, Hayashi N, Tsuji T, Izawa T, Iwasaki M. Identification of a RFLP marker tightly linked to the panicle blast resistance gene,, in rice[J]., 2000, 50: 183-188.
[16] Chen J, Shi Y F, Liu W Z, Chai R Y, Fu Y P, Zhuang J Y, Wu J L. Aallele from rice cultivar Gumei 2 confers resistance to[J]., 2011, 38: 209-216.
[17] Hayashi N, Inoue H, Kato T, Funao T, Shirota M, Shimizu T, Kanamori H, Yamane H, Hayano-Saito Y, Matsumoto T, Yano M, Takatsuji H. Durable panicle blast-resistance geneencodes an atypical CC-NBS-LRR protein and was generated by acquiring a promoter through local genome duplication[J]., 2010, 64(3): 498-510.
[18] Fang N, Wei X, Shen L, Yu Y, Li M, Yin C, He W, Guan C, Chen H, Zhang H, Bao Y. Fine mapping of a panicle blast resistance geneinlandrace Bodao and its application in rice breeding[J]., 2019, 12(1): 18.
[19] Wang R, Fang N, Guan C, He W, Bao Y, Zhang H. Characterization and fine mapping of a blast resistant genefrom therice landrace Jiangnanwan [J].,2016, 11(12): e0169417. doi: 10. 1371/journal. pone. 0169417.
[20] Qu S, Liu G, Zhou B, Bellizzi M, Zeng L, Dai L, Han B, Wang G L. The broad-spectrum blast resistance geneencodes a nucleotide-binding site-leucine-rich repeat protein and is a member of a multigene family in rice[J]., 2006, 172(3): 1901-1914.
[21] Liu G, Lu G, Zeng L, Wang G L. Two broad-spectrum blast resistance genes,(t) and(t), are physically linked on rice chromosome 6[J]., 2002, 267(4): 472-480.
[22] 雷财林, 张国民, 程治军, 马军滔, 王久林, 辛爱华, 陈平, 肖家雷, 张欣, 刘迎雪, 郭秀平, 王洁, 翟虎渠, 万建民. 黑龙江省稻瘟病菌生理小种毒力基因分析与抗病育种策略[J]. 作物学报, 2011, 37(1): 18-27.
Lei C L, Zhang G M, Cheng Z J, Ma J T, Wang J L, Xin A H, Chen P, Xiao J L, Zhang X, Liu Y X, Guo X P, Wang J, Zhai H Q, Wan J M. Pathogenic races and virulence gene structure ofpopulation and rice breeding strategy for blast resistance in Heilongjiang Province[J]., 2011, 37(1): 18-27. (in Chinese with English abstract)
[23] 董丽英, 王群, 刘树芳, 郑凤萍, 李迅东, 杨勤忠. 云南省稻瘟病菌群体对稻瘟病抗性单基因系的致病性分析[J]. 西南农业学报, 2012, 25(2): 467-473.
Dong L, Wang Q, Liu S, Zheng F, Li X, Yang Q. Pathogenicity analysis ofpopulations of Yunnan on monogenic lines for resistance to rice blast[J]., 2012, 25(2): 467-473. (in Chinese with English abstract)
[24] 汪文娟, 苏菁, 杨健源, 韦小燕, 陈凯玲, 陈珍, 陈深, 朱小源. 源于广8A 杂交稻组合的稻瘟病菌无毒基因型分析[J]. 中国农业科学, 2018, 51(24): 4633-4646.
Wang W J, Su Q, Yang J Y, Wei X Y, Chen K L, Chen Z, Chen S, Zhu X Y. Analysis ofavirulent genes in the infected hybrid rice combinations derived from a sterile line of Guang 8A[J]., 2018, 51(24): 4633-4646. (in Chinese with English abstract)
[25] Wang J C, Jia Y, Wen J W, Liu W P, Liu X M, Li L, Jiang Z Y, Zhang J H, Guo X L, Ren J P. Identification of rice blast resistance genes using international monogenic differentials[J]., 2013, 45: 109-116.
[26] 刘水芳, 杨秀荣, 孙淑琴, 刘春艳, 王勇, 张春祥, 顾红艳. 水稻品种抗稻瘟病鉴定技术[J]. 天津农业科学, 2007, 13(4): 55-58.
Liu S, Yang X, Sun S, Liu C, Wang Y, Zhang C, Gu H. Identification technique of rice resistance to[J]., 2007, 13(4): 55-58. (in Chinese)
[27] Wu J, Kou Y J, Bao J D, Li Y, Tang M Z, Zhu X L, Ponaya A, Xiao G, Li J B, Li C Y, Song M Y, Cumagun C J R, Deng Q Y, Lu G D, Jeon J S, Naqvi N, Zhou B. Comparative genomics identifies theavirulence effectorthat triggers-mediated blast resistance in rice[J]., 2015, 206(4): 1463-1475.
[28] Wu Y Y, Yu L, Pan C H, Dai Z Y, Li Y H, Xiao N, Zhang X X, Ji H J, Huang N S, Zhao B H, Zhou C H, Liu G Q, Liu X J, Pan X B, Liang C Z, Li A H. Development of near-isogenic lines with different alleles oflocus and analysis of their breeding effect under Yangdao 6 background[J]., 2016, 36: 12.
[29] Wu Y Y, Chen Y, Pan C H, Xiao N, Yu L, Li Y H, Zhang X X, Pan X B, Chen X J, Dai Z Y, Li A H. Development and evaluation of near-isogenic lines with different blast resistance alleles at thelocus inrice from the lower region of the Yangtze River, China[J]., 2017, 101: 1283-1291.
[30] Collard B C Y, Mackill D J. Marker-assisted selection: An approach for precision plant breeding in the twenty-first century.:, 2008, 363: 557-572.
[31] 倪大虎, 易成新, 李莉, 汪秀峰, 王文相, 杨剑波. 利用分子标记辅助选择聚合水稻基因和[J]. 分子植物育种, 2005, 3(3): 329-334.
Ni D H, Yi C X, Li L, Wang X F, Wang W X, Yang J B. Pyramidingand(t) in rice by marker-assisted selection[J]., 2005, 3(3): 329-334. (in Chinese with English abstract)
[32] 殷得所, 夏明元, 李进波, 万丙良, 査中萍, 杜雪树, 戚华雄. 抗稻瘟病基因的STS连锁标记开发及在分子标记辅助育种中的应用[J]. 中国水稻科学, 2011, 25(1): 25-30.
Yin D S, Xia M Y, Li J B, Wan B L, Zha Z P, Du X S, Qi H X. Development of STS marker linked to rice blast resistance genein marker-assisted selection breeding[J]., 2011, 25(1): 25-30. (in Chinese with English abstract)
[33] 陈建民, 付志英, 权宝权, 田大刚, 李刚, 王锋. 分子标记辅助培育双抗稻瘟病和白叶枯病杂交稻恢复系[J]. 分子植物育种, 2009, 7(3): 465-470.
Chen J M, Fu Z Y, Quan B Q, Tian D G, Li G, Wang F. Breeding hybrid rice restoring line with double resistance to rice blast and bacterial blight by marker-assisted selection[J]., 2009, 7(3): 465-470. (in Chinese with English abstract)
Different Reactions of Rice Monogenic Line IRBL9-W HarboringGene toContainingDuring Seedling and Adult-plant Stages
LIU Shufang1, 2, #, DONG Liying1, 2, #, LI Xundong1,2, ZHOU Wumin1,3,YANG Qinzhong1,2,*
(Agricultural Environment Resources Research Institute,/,,;Scientific Observing and Experimental Station of Crop Pests in Kunming,,,;,,;These authors contributed equally to this work;Corresponding author,)
【】 Thegene confers broad-spectrum resistance against. Rice monogenic line IRBL9-W carrying single blast resistance geneis highly resistant to leaf blast during the seedling stage, but it is susceptible to neck blast at adult-plant stage in blast nursery. It is important to analyze the mechanism behind the reversion of resistance to, which will provide important information for effective utilization ofin disease-resistant rice breeding program.【】Eight single spore strains ofisolated fromneck blast samples of diseased IRBL9-W, and one isolate Y363 were artificially inoculated by spraying at seedling stage to pathotype their pathogenicity on 24 monogenic lines including IRBL9-W. Two out of eight strains and control strain Y363 were further selected and inoculated on IRBL9-W at late-booting stage by injecting to evaluate their pathogenicity. The alleles ofgene cognate to rice blast resistance genewere amplified and sequenced with-specific primers in nine strains. Total RNA of the rice monogenic line IRBL9-W in seedling and late-booting stage was extracted from young leaf and panicle, respectively. The expression analysis ofgene was performed by semi-quantitative RT-PCR and real-time qRT-PCR.【】 The monogenic line IRBL9-W was completely resistant to the ninestrains at the seedling stage exposed to the artificial spraying. However, IRBL9-W was susceptible to panicle blast when inoculated with both two randomly selected strains (YX2-7-1 and YX2-15-1) isolated from panicle blast lesions of IRBL9-W, and the control strain Y363 by injecting inoculation at the late-booting stage. Compared with, allelic sequence amplified from Y363 was identical to cloned, and the coding region of the other eight strains isolated from IRBL9-W panicle blast was identical togene, except for a 16-bp deletion at −264 bp upstream of the coding starting position in the eight strains. Given high resistance of IRBL9-W to these strains at the seedling stage, we contended that this 16-bp deletion did not affect the function ofgene; qRT-PCR results showed that the relative expression level ofgene in panicle was only 47.3% as compared to that in seedling leaves.【】Compared with the relative expression level ofgene at the seedling stage in IRBL9-W, the significant decrease ofgene expression level in panicle of IRBL9-W could be the cause of susceptibility toat late-booting stage.
L.;;; seedling stage; adult-plant stage
10.16819/j.1001-7216.2021.0717
2020-07-24;
2020-11-24。
云南省基础研究计划重点资助项目(202001AS070006);科技部国家重点研发专项(2016YFD0100101);国家自然科学基金资助项目(31860524);云南省农业科学院院基金资助项目(YJZ201803)。

