AMPK激动剂预处理对肝缺血再灌注损伤大鼠模型的影响及相关机制
潘宁波,张旭阳,张 玉,杨龙灿,余 曦,李继维,唐天豪,黄 平,张 莹
1 贵州省人民医院 a.肝胆外科,b.信息科,贵阳 550000; 2 遵义医科大学附属第二医院,贵州 遵义 563000; 3 铜仁市人民医院 肝胆外科,贵州 铜仁 554300;4 毕节市第一人民医院 肝胆外科,贵州 毕节 551700
肝缺血再灌注损伤(hepatic ischemia-reperfusion injury,HIRI)是肝外科手术中难以避免且最严重的并发症之一,严重阻碍了肝脏手术在临床中的发展。有研究[1]发现,HIRI过程中必然伴随能量代谢的紊乱,而腺苷酸活化蛋白激酶(AMPK)信号通路作为一种维持生物能量稳定、平衡的调节器将发挥重要作用。同时有研究表明,AMPK信号通路在心[2]、脑[3]、肾[4]、肝[5]等重要器官的缺血再灌注损伤中发挥保护作用。因此,本研究使用5-氨基咪唑-4-甲酰胺核苷酸(AICAR)预处理,初步探讨AMPK信号通路改变对大鼠HIRI的影响及可能机制,为减轻HIRI提供一定实验依据。
1 材料与方法
1.1 实验动物及材料 54只健康SPF级SD雄性大鼠[生产许可证号:SCXK(辽)2015-0001;使用许可证编号:SYXK(黔)2018-0001],4~8周龄,220~250 g,购自辽宁长生生物技术股份有限公司。三磷酸腺苷(ATP)、TNFα和IL-6酶联免疫吸附试验(ELISA)试剂盒购自上海碧云天生物技术有限公司。RNA提取试剂盒购自美国Ambion公司,反转录试剂盒及扩增试剂均购自日本TaKaRa公司。AICAR购自美国APExBIO公司。磷酸化AMPK、磷酸化mTOR及内参抗体(GAPDH)均购自美国CST,磷酸化GLUT4购自英国Abcam,MRP2抗体购自武汉三鹰生物技术有限公司。
1.2 动物分组和模型建立 54只雄性大鼠适应性喂养1周后随机平均分为3组,每组18只。实验组:术前1 h腹腔注射AICAR,500 mg/kg;对照组及假手术组:术前1 h使用0.9%氯化钠注射液(500 mg/kg)腹腔注射。HIRI模型建立(实验组和对照组):依照Pringle法建立HIRI模型。麻醉大鼠,取腹部正中切口,逐层进入腹腔,进腹后暴露第一肝门,用无创血管夹阻断肝脏全部血流,阻断30 min后松开无创血管夹,使血流重新灌注,关腹。假手术组与HIRI模型同法进腹,仅暴露第一肝门,30 min后关腹。将各组手术后大鼠置于干燥清洁的鼠笼等待苏醒。于血流重新恢复灌注术后12、24、72 h每组随机取6只大鼠,留取血清,存放于-20 ℃冰箱备用;剪取整个肝左叶,一部分用甲醛固定,另一部分置于液氮速冻储存于-80 ℃冰箱备用。
1.3 肝组织病理HE染色 取肝组织用甲醛固定,然后脱水、包埋制作石蜡切片,光镜下观察肝损伤情况。
1.4 大鼠血清指标检测 取大鼠血清,送贵阳市金阳医院检验科使用全自动生化分析仪检测ALT、AST和TBil浓度。于-20 ℃冰箱取出待测血清,按照ELISA试剂盒说明书检测TNFα和IL-6。
1.5 大鼠肝组织ATP检测 大鼠肝组织100 mg,加入裂解液充分研磨匀浆取上清液,按照ATP试剂盒说明书要求检测。
1.6 实时荧光定量PCR(real time-PCR)检测 取100 mg肝组织,按RNA提取试剂盒说明书提取总RNA并检测其浓度跟纯度,接着将总RNA反转录为cDNA,随后进行real time-PCR。使用两步法PCR扩增标准程序:第一步95 ℃ 2 min,1个循环;第二步 95 ℃ 15 s,60 ℃ 60 s,39个循环。每个样本重复3次。结果分析:以GAPDH为内参,2-△△CT相对定量法计算相对表达量。引物序列见表1。

表1 引物序列
1.7 Western Blot检测 取肝组织50 mg,加入蛋白裂解液冰上研磨提取总蛋白,用BCA法测总蛋白浓度;制备电泳上样样品并保存于-80 ℃备用。制作分离胶,取50 μg 蛋白上样后电泳,转到聚偏二氟乙烯膜上,封闭液封闭2 h。加入一抗磷酸化AMPK(1∶1000)、磷酸化mTOR(1∶1000)、磷酸化GLUT4(1∶2000)、MRP2(1∶800)、GAPDH(1∶1000)4 ℃孵育过夜。加入二抗室温下孵育2 h。增强化学发光法显影曝光。Image lab 5.0凝胶图像分析系统计算条带的灰度值。
1.8 伦理学审查 本研究已通过贵州省人民医院伦理委员会审查,批号:[2019]094号。

2 结果
2.1 各组大鼠肝组织HE染色结果 大鼠肝缺血再灌注后12、24、72 h,假手术组的肝小叶及肝细胞形态、结构正常,汇管区结构完整。缺血再灌注后12 h,对照组与实验组大鼠肝小叶结构较假手术组紊乱,肝索断裂,部分肝细胞出现水肿、空泡样变性及少许坏死导致的气球样变,中央静脉及肝血窦扩张、充血,肝索断裂,实验组轻于对照组。缺血再灌注后24 h,对照组与实验组肝组织损伤较12 h加重,对照组见肝小叶结构紊乱进一步加重,肝细胞水肿、空泡样变性及坏死增多,中央静脉及肝血窦扩张、充血明显,汇管区可见少许炎症细胞浸润,实验组轻于对照组。缺血再灌注后72 h,对照组与实验组肝组织损伤程度明显较24 h减轻,对照组肝细胞水肿、坏死减少,中央静脉、肝血窦扩张及充血减轻,实验组肝损伤减轻程度明显优于对照组(图1)。

图1 各组大鼠肝组织HE染色结果(×200)
2.2 各组大鼠血清指标比较 术后12、24、72 h,对照组ALT、AST、TBil、TNFα、IL-6均高于实验组和假手术组(P值均<0.05),实验组各指标均高于假手术组(P值均<0.05)(表2)。
同组比较:术后24 h,对照组和实验组ALT、AST、TBil、TNFα、IL-6高于术后12 h(P值均<0.05);术后72 h,实验组和对照组各指标均较术后24 h下降,但高于术后12 h(P值均<0.05)(表2)。

表2 三组大鼠术后12、24、72 h血清指标水平比较
2.3 各组大鼠ATP水平比较 术后12、24、72 h,实验组肝组织ATP水平均高于对照组和假手术组,对照组均低于假手术组(P值均<0.05)(表3)。
同组比较:实验组术后24 h ATP水平高于术后12 h,而术后72 h低于24 h(P值均<0.05);对照组术后24 h ATP水平高于术后12 h,而术后72 h高于术后12 h(P值均<0.05)(表3)。

表3 三组大鼠术后12、24、72 h肝ATP水平比较
2.4 各组大鼠AMPK、mTOR、GLUT4、MRP2 mRNA水平比较 术后12、24、72 h,实验组AMPK、GLUT4、MRP2的mRNA相对表达水平均高于对照组和假手术组,对照组AMPK mRNA相对表达水平高于假手术组,对照组GLUT4、MRP2 mRNA相对表达水平均低于假手术组(P值均<0.05);实验组mTOR mRNA相对表达水平均低于对照组和假手术组,对照组高于假手术组(P值均<0.05)。
同组比较:对照组和实验组术后24 h,AMPK、GLUT4、MRP2、mTOR mRNA相对表达水平均高于术后12 h(P值均<0.05)。实验组术后72 h,AMPK、GLUT4、MRP2mRNA相对表达水平均低于术后24 h,高于术后12 h,而mTOR mRNA相对表达水平高于24 h(P值均<0.05);对照组术后72 h,AMPK、mTOR mRNA相对表达水平均低于术后24 h,高于术后12 h,而GLUT4、MRP2 mRNA相对表达水平均高于术后24 h(P值均<0.05)(表4)。

表4 三组大鼠术后12、24、72 h各蛋白mRNA相对表达水平比较
2.5 各组大鼠AMPK、mTOR、GLUT4、MRP2蛋白表达水平比较 术后12、24、72 h,实验组磷酸化AMPK、磷酸化GLUT4、MRP2表达水平均高于对照组和假手术组,对照组磷酸化AMPK表达水平高于假手术组,对照组磷酸化GLUT4、MRP2表达水平均低于假手术组(P值均<0.05);实验组磷酸化mTOR表达水平均低于对照组和假手术组,对照组高于假手术组(P值均<0.05)(图2,表5)。
同组比较:实验组术后72 h磷酸化AMPK、磷酸化GLUT4、MRP2表达水平均低于术后24 h,高于术后12 h,而磷酸化mTOR高于术后24 h(P值均<0.05);对照组术后72 h磷酸化AMPK表达水平低于术后12、24 h,磷酸化mTOR表达水平低于术后24 h而高于术后12 h(P值均<0.05),而磷酸化GLUT4、MRP2表达水平均高于24 h(P值均<0.05)(图2,表5)。

表5 三组大鼠术后12、24、72 h各蛋白相对表达水平比较
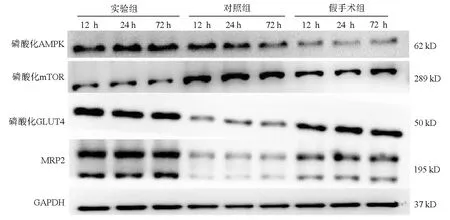
图2 三组大鼠术后12、24、72 h各蛋白相对表达结果
3 讨论
HIRI是一种涉及诸多因素、众多环节且机制非常复杂的病理生理过程。目前的研究[6-8]发现,炎症细胞因子、能量代谢紊乱、微循环障碍等参与了HIRI。因此,最大程度减轻HIRI是肝胆外科临床工作和实验研究亟待解决的问题。
AMPK是生物体内维持生物能量稳定、平衡的一种重要信号通路。已有研究[9-12]证实,HIRI时,机体摄取葡萄糖能力下降,糖酵解途径、代谢途径被抑制,mTOR信号通路被激活,ATP合成能力下降,导致机体能量供给不足,降低了MRP2转运胆红素能力,损伤肝细胞功能,加重肝炎症反应。因此,本实验使用AICAR预处理激活AMPK信号通路,进一步使其下游分子mTOR失活、GLUT4活化,ATP合成增加,促使MRP2转运胆红素而减轻HIRI。
本实验中,对照组在HIRI早期(术后12 h)血清AST、ALT、TBil、TNFα、IL-6和mTOR mRNA及其蛋白较实验组和假手术组表达水平上升,而AMPK、GLUT4、MRP2 mRNA及其蛋白较实验组和假手术组表达降低,ATP合成下降,肝组织和肝细胞功能出现损伤,此时能量合成障碍;在HIRI中期(术后24 h),血清AST、ALT、TBil、TNFα、IL-6和mTOR mRNA及其蛋白表达水平持续上升,AMPK、GLUT4、MRP2表达水平持续下降,肝组织和肝细胞损伤进一步加重,提示能量合成严重不足;在HIRI后期(术后72 h),各指标变化开始回升,说明肝脏开始恢复自身代谢与合成。而使用AICAR预处理后,无论在HIRI早期、中期,还是晚期,实验组肝组织和肝功能损伤程度均轻于对照组,血清AST、ALT、TBil、TNFα、IL-6和mTOR mRNA及其蛋白表达均低于对照组,ATP合成和AMPK、GLUT4、MRP2 mRNA及其蛋白变化均高
于对照组,说明AMPK活化后,抑制了下游分子mTOR表达,上调了下游分子GLUT4表达。有研究[10]证实,AMPK信号通路在调节肝组织中的GLUT4表达起着重要作用,与GLUT4的表达呈正相关,而GLUT4是主要转运葡萄糖的分子之一,影响肝脏、骨骼肌对葡萄糖的摄取、利用以及全身能量供应,能够改善糖代谢,提高能量生成,促进肝细胞功能快速恢复。另外,MRP2转运胆红素是一个主动转运、耗能的过程,其表达高低与能量呈正相关[12]。mTOR信号通路被激活,ATP合成能力下降,导致机体能量供给不足[13],降低了MRP2转运胆红素能力,加重肝脏炎症反应。实验组AICAR通过作用于α亚基中Thr-172位点而激活AMPK信号通路,使其下游分子mTOR失活、GLUT4活化,ATP合成增加,促使MRP2转运胆红素,减轻肝细胞损伤。本实验中,随着HIRI后时间的推移,机体逐渐恢复供能,炎症因子逐渐被清除,肝损伤逐渐减轻,提示能量代谢途径能减轻肝脏炎症反应,降低HIRI程度。通过AICAR预处理的实验组则更能促进肝脏自身合成与代谢的恢复,进而减轻HIRI。
综上所述,AICAR预处理能激活AMPK信号通路,改善能量代谢途径,减轻肝脏炎症反应,从而降低HIRI程度。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:潘宁波负责课题设计,资料分析,撰写论文;张旭阳、张玉、杨龙灿、余曦、李继维、唐天豪参与收集数据,修改论文;黄平、张莹负责拟定写作思路,指导撰写文章并最后定稿。

