年轻未分化子宫内膜癌一例并文献复习
王芳,陈佩芳
福建医科大学附属协和医院妇产科,福建 福州 350001
子宫内膜未分化癌(undifferentiated endometrial carcinoma,UEC)是一种罕见的、高度侵袭性且未被充分认识的子宫内膜癌亚型[1]。研究表明未分化癌占所有子宫内膜癌的9%[2]。未分化子宫内膜癌(UEC)最近才被认可并且较为罕见,通常在组织病理学评估中被错误分类[3]。UEC 的确诊需要依据组织病理活检并辅助其他相关检测。本文以一例年轻女性UEC 为报道内容,复习相关文献以介绍UEC 的临床、病理特征及治疗进展。
1 病例简介
患者,女性,27 岁,以“发现子宫肿物1 年余,阴道不规则出血1+个月,发热1 周”为主诉于2020 年5 月7日入院。1 年余前于外院查阴道彩超示“子宫多发实性结节(肌瘤?)”,定期复查彩超提示肌瘤逐渐增大。4个月前患者因继发不孕于外院行促排卵治疗,具体过程不详。1+个月前患者就诊于外院查阴道彩超示:子宫多发肌瘤,大者76 mm×75 mm,医生建议手术治疗,因阴道出血(考虑月经来潮)出院。8 d前患者发热,体温最高38.9 ℃,伴咳嗽、咳白色痰,就诊于外院查肺部CT 示“双侧胸腔积液,(右侧为著)伴右下肺部分压迫性肺不张”,全腹CT提示“左下腹占位性病变,大小约7.0 cm×6.0 cm×10.06 cm,伴盆腹腔积液,子宫增大伴腔内混杂密度灶,约6.7 cm×6.9 cm×8.2 cm”,予以抗感染、置入右侧胸腔引流管等治疗,患者仍反复发热,共放出胸水4 730 mL,胸腔积液未见好转,遂转诊于我院。婚育史:0-0-1(生化妊娠)-0,不孕4年,4 个月前行促排卵治疗。入院查体:体温(T)37.1℃,心率(P) 10 次/min,呼吸(R) 20 次/min,血压(BP)96/67 mmHg(1 mmHg=0.133 kPa),神志清楚,贫血外观,右肺呼吸音低,左肺呼吸音粗,未闻及干湿性啰音。全腹软,左下腹可触及一肿物大小约10 cm×8 cm,质硬,无压痛,移动性浊音阴性。妇检:子宫前位,如孕4 个月大小,不规则,质硬,无压痛。腹壁厚触诊不满意。
入院后查:血红蛋白45 g/L,糖类抗原(CA125)671.1 U/mL,人附睾蛋白(HE) 465 pmol/L,D-二聚体(DDI)19.32,结核相关检查未见异常,胸水找瘤细胞阴性。正电子发射计算机断层显像(PET-CT)提示:(1)左下腹-左侧盆腔高代谢肿物,考虑卵巢恶性肿瘤(MT);右侧附件区高代谢灶,考虑MT;全身多发骨转移,其中颈椎病灶侵犯相应椎管;双侧髂血管旁、腹膜后多发淋巴结转移;道格拉斯窝种植灶。(2)腹盆腔脂肪间隙改变,考虑种植可能性大。(3)子宫底部无代谢囊实性肿物,考虑良性,考虑妊娠囊或子宫肌瘤退变,请结合临床;子宫体左侧旁肌瘤;腹盆腔积液。(4)左肺少许炎症,左侧胸腔中-大量胸腔积液继发左肺部分实质受压膨胀不全;右侧胸腔引流管置入术后后改变,右侧胸腔少量积液。(5)全身其他部位18F-FDG PET/CT 显像未见明显异常。多学科会诊协助诊治,因考虑为卵巢恶性肿瘤可能,伴全身多发骨转移及多发淋巴结肿大,遂于2020 年5 月2 日在全麻下行“腹腔镜探查+开腹全子宫及双侧附件切除+腹膜病灶活检+大网膜切除术”,术中见腹盆腔内淡黄色腹水量约1 500 mL,大网膜与前腹壁呈絮状黏连,左侧卵巢肿物约20 cm×18 cm×15 cm,形态不规则,表面尚光滑,无破裂口,肿物表面见大量怒张血管,与大网膜、横结肠及左侧盆壁黏连致密;左输卵管增粗肿大7 cm×4 cm×3 cm,表面呈颗粒样,右卵巢增大约7 cm×5 cm×5 cm,表面见一血体,无破口,右输卵管外观正常。子宫增大如孕5个月大小,宫底一肿物向外突出,大小7 cm×7 cm,子宫后壁多发结节样凸起,质软。大网膜及两侧结肠旁沟见散在转移灶,大小0.2~2 cm,余未见转移灶。切下全子宫标本(图1),剖开见宫底部一肿物,大小7 cm×7 cm,肿物内部呈黄色鱼肉样改变,后壁下段见一切面灰白色鱼肉样占位性病变,边界不清,凸向黏膜下及后壁浆膜层。切下标本术中冰冻提示:恶性肿瘤浸润,具体类型需常规、免疫组化检测后方可明确。术后病理:全子宫子宫内膜未分化癌,浸润浆膜层,间质见大量脉管内瘤栓,肿瘤侵犯宫颈间质。左附件卵巢及输卵管见癌转移。右附件卵巢见癌转移;输卵管慢性炎及系膜囊肿。大网膜、腹膜、右腹壁腹膜、左腹壁腹膜、阴道壁肿物镜下见癌浸润。免疫组化结果:CK8/18、P53、P16 阳性,CK、Vim 部分阳性,Ki67 约80%细胞阳性,CD10、β catenin、ER、PR、EMA HNF-1β、SALL4、SMA、WT1、caldesmon、Pax8 阴性。术后纠正诊断:子宫内膜未分化癌Ⅳb期。患者于术后1个月死亡。
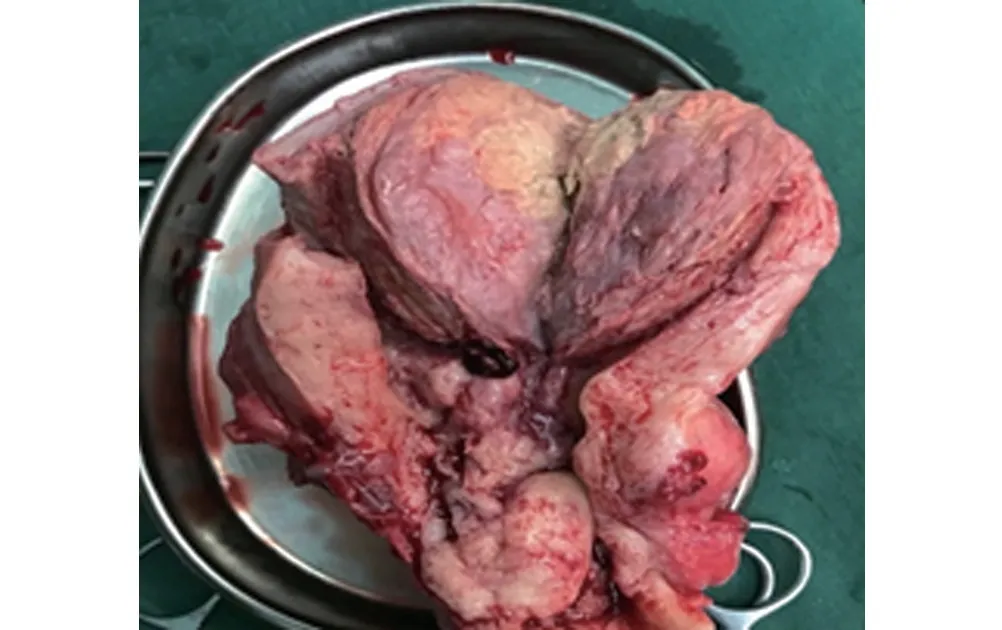
图1 子宫标本
2 讨论
UEC比子宫内膜样腺癌更具侵略性,国际妇产科联合会(FIGO)3级是其主要鉴别诊断。由于其具有高度侵袭性,因此正确识别此类型肿瘤非常重要[4]。未分化癌与分化好的子宫内膜样癌混合(1 级或2 级)时则定义为去分化癌(dedifferentiated endometrial carcinoma,DEC),2006 年由SLIVA 等[5]首次提出,2014 年首次被纳入世界卫生组织(WHO)女性生殖器官肿瘤分类中。
UEC诊断的中位年龄为65岁[1],有研究报道,40%的UEC 患者年龄小于50 岁,据报道最小的年龄为21岁[6]。绝经后出血是最常见的症状(76.9%),大多数患者诊断时为晚期(64.7%)[7],GANJU等[3]报道的24例患者中,10 例患者诊断时出现局部晚期或已转移(42%)。本例患者诊断时年龄27岁,阴道不规则出血1个月,病史较短,较为罕见,结合临床及PET-CT结果,考虑已远处转移(骨、肺转移),临床分期为Ⅳ期的晚期患者,术后仅1 个月死亡,可见未分化子宫内膜癌的恶性程度高,侵袭性强及预后差的特点。ALHILLI等[1]回顾性分析了3 994 例符合UEC 的诊断标准的患者,其五年总生存率为57%,认为分期是生存的最强预测因子,每增加一个分期,都会使5 年生存期减少15%~20%。
UEC病理显微镜下特征:(1)单一的中型或大型细胞组成;(2)无图案固体,片状增长;(3)不存在腺体、乳头、上皮分化,并且神经内分泌分化很少或很少(<10%)[2,5-6]。UEC 由单调的、典型的黏液性细胞片组成,这些细胞可能具有横纹肌样外观;它们通常表现出有限的细胞角蛋白和上皮膜抗原表达,通常对PAX8和激素受体呈阴性,缺乏膜性e-钙黏着蛋白,通常表现出DNA错配修复蛋白和SWI-SNF染色质重塑蛋白的表达缺失[8]。RAMALINGAM 等[9]发现p16 在34%的病例中呈弥漫阳性,而p53 在31%的病例中>75%的肿瘤细胞中表达。他们还发现,在50%的病例中E-cadherin和CD44完全丢失,在所有病例中Her-2/neu均为阴性,而在67%的病例中EGFR阴性。国内研究发现,在大约一半的DEC和UEC中观察到BRG1/INI1 缺失[10]。HOANG 等[11]将未分化的子宫内膜癌分为BRG1/INI1缺陷型和BRG1/INI1完整型。他们发现在所有BRG1/INI1 缺陷型肿瘤病例的未分化成分中,PAX8 和ER 染色完全消失。在95%的BRG1/INI1 缺陷病例中观察到野生型核p53 染色。结果在BRG1/INI1 完整病例中略有不同,其中33%的病例观察到PAX 8 表达,20%的病例表达ER,47%的病例显示p53染色发生突变。
UEC的遗传关联尚不清楚,在林奇综合征患者中发现了罕见病例,因为相当多的病例显示出一种或多种DNA 错配修复基因的丢失[6,12]。大约一半的未分化肿瘤表现出微卫星不稳定性,MLH1 启动子甲基化以及MLH1和PMS2的表达丧失[12]。RAMALINGAM等[9]发现MLH1 和PMS2 在50%的案例中同时丢失,而MSH2 和MSH6 在3%的案例中丢失。AL-HUSSAINI等[7]和HACKING等[13]发现PD-L1和PD-1在大多数MMR (DNA mismatch repair)缺陷UEC/DEC 病例中表达,PD-L1在MMR完整的癌症中不表达,未分化成分可能是免疫检查点抑制剂(抗PD-L1/PD-1 抗体)的靶标,这些发现可能有助于支持MMR 缺陷型UEC/DEC 中潜在的免疫疗法试验。TRAVAGLINO等[14]根据子宫内膜癌的四个TCGA(The Cancer Genome Atlas)分子亚类对未分化/去分化癌(UDC/DDC)进行分类,研究纳入了三个研究中的73 例患者,TCGA 亚组的合并患病率是:POLE 亚组为12.4%,MSI亚组为44%,p53abn 亚组为18.6%,p53wt 亚组为25%。其中以MSI 组占优势,表明存在生物学异质性。肿瘤中高突变/超突变的优势和p53abn组的低患病率表明,UEC/DEC 和其他高危组织之间存在重要的生物学差异,这支持在大多数UEC/DEC 中可能使用免疫治疗。
UEC 治疗方式包括全腹子宫切除术和双侧输卵管卵巢切除术,化学疗法和放射疗法,其治疗方案类似于FIGO 3级子宫内膜样癌[4]。常规紫杉醇联合卡铂和顺铂联合阿霉素对那些分化程度高的患者有效。但是,通过结合使用免疫检查点抑制剂结合常规治疗方法,可以控制未分化的成分并改善预后[7]。HAYASHI 等[15]报道了一项成功的UEC 案例,该案例通过外科手术结合由TTJ 方案(四氢吡喃基-阿霉素,紫杉醇和卡铂)进行治疗,该患者接受了6 个周期的TTJ治疗,并获得了完全缓解。
综上所述,UEC 是一种罕见的、高度侵袭性且未被充分认识的子宫内膜癌亚型,诊断主要依靠病理组织形态学及免疫组织化学表型,治疗效果差,复发转移率高,预后差。临床上应做到早发现、早诊断、早治疗,治疗原则以手术为主,辅助放化疗或靶向治疗可能在一定程度上改善预后。由于受病例数限制,未来仍需收集更多病例资料来探讨UEC的临床病理特点、有效治疗手段及预后情况等。

