NF-κB1 基因启动子-94del/ins ATTG 基因多态性与特发性血小板减少性紫癜的关系
杨占甲,李丽娟
(1 郑州人民医院输血科,河南450000;2 郑州大学第三附属医院检验科)
特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP)是由于机体产生抗自身血小板抗体而引起血小板减少的自身免疫性疾病[1],主要以血小板减少、骨髓巨噬细胞增加为特征[2]。目前临床治疗ITP 的药物主要是糖皮质激素,可缓解临床症状,但部分患者对药物不敏感或出现病情复发[3]。因此,对ITP 病因进行深入研究,寻找合适的治疗方法极为重要。NF-κB1 基因位于人类第4 号染色体(4q24),其基因多态性与多种疾病的易感性相关[4]。LEWANDER 等[5]研究发现NF-κB1-94del/ins ATTG多态性与肠癌易感性相关,韦晓梨等[6]报告NF-κB1-94del/ins ATTG 多态性与抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic antibody,ANCA)相关性小血管炎(ANCA-Associated vasculitis,AAV)发病相关。本研究选择2015年3月—2018年3月在本院诊疗的127 例ITP 患者,检测NF-κB1-94del/ins ATTG 基因型和等位基因频率,分析NF-κB1-94del/ins ATTG 基因多态性与ITP 的相关性。
1 资料与方法
1.1 临床资料 ITP 患者127 例,符合《血液病诊断与疗效标准》第3 版[7]关于ITP 的诊断标准,其中急性ITP 66 例,慢性ITP 61 例。急性ITP 组中男性20例,女性46 例,年龄24~59 岁,平均35.29±9.25 岁;慢性ITP 组中男性18 例,女性43 例,年龄24~59岁,平均35.61±9.37 岁。以同期本院体检健康者130例为正常对照组,其中男性53 例,女性77 例,年龄22~60 岁,平均37.56±9.44 岁。各组研究对象性别、年龄比较,差异均无统计学意义(P>0.05)。本研究经我院伦理委员会批准,研究对象均知情同意。收集患者入院时红细胞计数(RBC)、血红蛋白(Hb)、血小板计数(PLT)、血清C 反应蛋白(CRP)、类风湿因子(RF)水平等资料。
1.2 NF-κB1-94del/ins ATTG 基因检测方法
1.2.1 试剂与仪器:基因组DNA 提取试剂盒(TIANGEN BIOTECH 公司),Tap DNA 聚合酶、dNTP(美国Promega 公司),9700型PCR 仪(美国ABI 公司)。
1.2.2 DNA 提取:采集研究对象肘静脉血3 mL 置于EDTA 抗凝管,常规蛋白酶K 消化,苯酚/氯仿提取DNA 溶解于TE 中,取DNA 进行琼脂糖凝胶电泳以检测DNA 提取情况,其余DNA 于-20 ℃保存。
1.2.3 基因组DNA 扩增:取样本DNA 进行PCR 扩增,引物序列根据GenBank 中NF-κB1 核苷酸序列设计,上游:5’-TTTAATCTGTGAAGAGATGTGAAT-3’,下游:5’-CTAGCAGGGCGCTCCCGAAT-3’。PCR扩增体系:DNA 模板2 μL,上下游引物各1 μL,2×Tap PCR Master Mix 25 μL,双蒸水补足50 μL。PCR 反应条件:94 ℃30 s,65 ℃45 s、72 ℃45 s,循环30 次后,72 ℃下延伸7 min。PCR 扩增片段为279 bp,用2%琼脂糖凝胶电泳,紫外分析仪观察DNA 扩增情况。
1.2.4 限制性内切酶酶切PCR 扩增产物:取PCR扩增产物10 μL,采用限制性内切酶Van911(PflMI)进行酶切反应,该位点有野生纯合子WW(ins/ins)、杂合子WD(ins/del)和变异纯合子DD(del/del)。采用2%琼脂糖凝胶电泳分离酶切产物,紫外分析仪观察酶切情况。
1.3 统计学处理 应用SPSS 20.0 统计学软件进行数据处理分析。计量资料以±s表示,组间比较采用F 检验;计数资料以频数和率表示,组间比较采用χ2检验,按Hardy-Weinberg 平衡定律检验分析样本的群体代表性和组间差异。P<0.05 为差异具有统计学意义。
2 结果
2.1 Hardy-Weinberg 平衡定律检验 正常对照组、急性ITP 组、慢性ITP 组NF-κB1-94del/ins ATTG等位基因频率期望值与观察值比较,差异均无统计学意义(P>0.05)。符合Hardy-Weinberg 平衡定律,说明群体达到遗传平衡,提示所选样本适合群体遗传学研究。见表1。
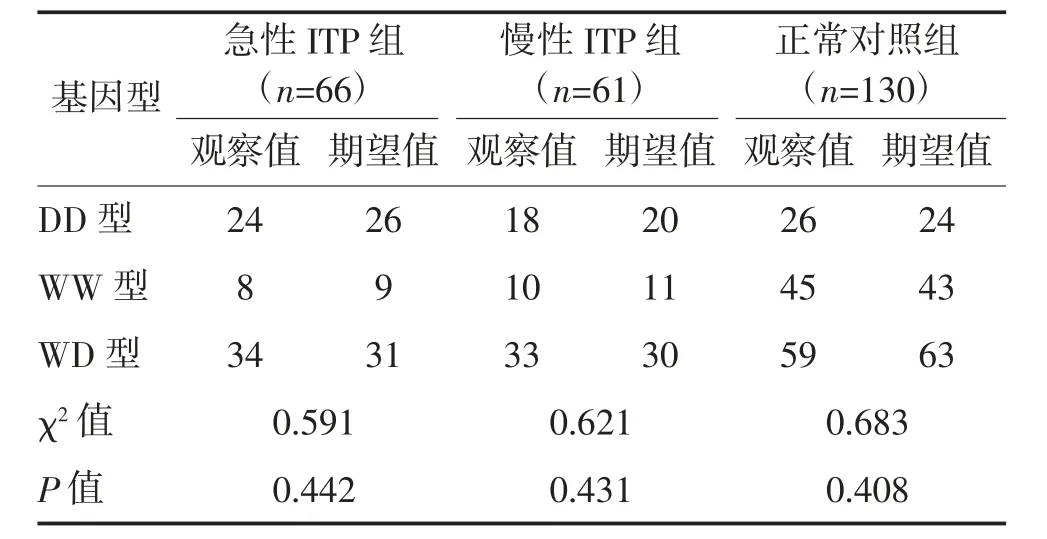
表1 Hardy-Weinberg 遗传平衡检验结果 例
2.2 基因组DNA 提取及NF-κB1-94del/ins ATTG基因型PCR 扩增 NF-κB1-94del/ins ATTG 基因型分为缺失型纯合子(DD型)、插入型纯合子(WW型)和插入型杂合子(WD型)。琼脂糖凝胶电泳显示各基因型条带见图1,其中DD 基因型酶切后得到2个片段:254 bp、35 bp;WW 基因型酶切后得到3个片段:206 bp、48 bp、35 bp;WD 基因型酶切后得到4个片段:254 bp、206 bp、48 bp、35 bp。电泳过程中因为48 bp、35 bp 片段太小,跑出凝胶之外,以致未能观察到相应条带。
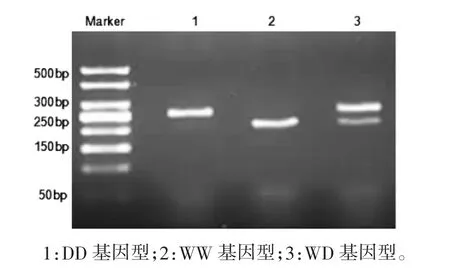
图1 NF-κB1-94del/ins ATTG 基因多态性酶切电泳图
2.3 各组NF-κB1-94del/ins ATTG 基因型及等位基因频率比较 正常对照组与ITP 组NF-κB1-94del/ins ATTG 基因型及等位基因分布符合Hardy-Weinberg 平衡定律。与正常对照组比较,急性、慢性ITP组DD 基因型分布显著升高,WW 基因型显著降低,差异均有统计学意义(P<0.05),WD 基因型的差异无统计学意义(P>0.05);急性ITP 组与慢性ITP 组基因型比较,各基因型的差异均无统计学意义(P>0.05)。等位基因比较显示,急性ITP 组D 等位基因频率显著高于慢性ITP 组和对照组,W 等位基因频率显著低于慢性ITP 组和对照组,差异均有统计学意义(P<0.05);慢性ITP 组D 等位基因频率显著高于对照组,W 等位基因频率也显著降低(P<0.05)。见表2。
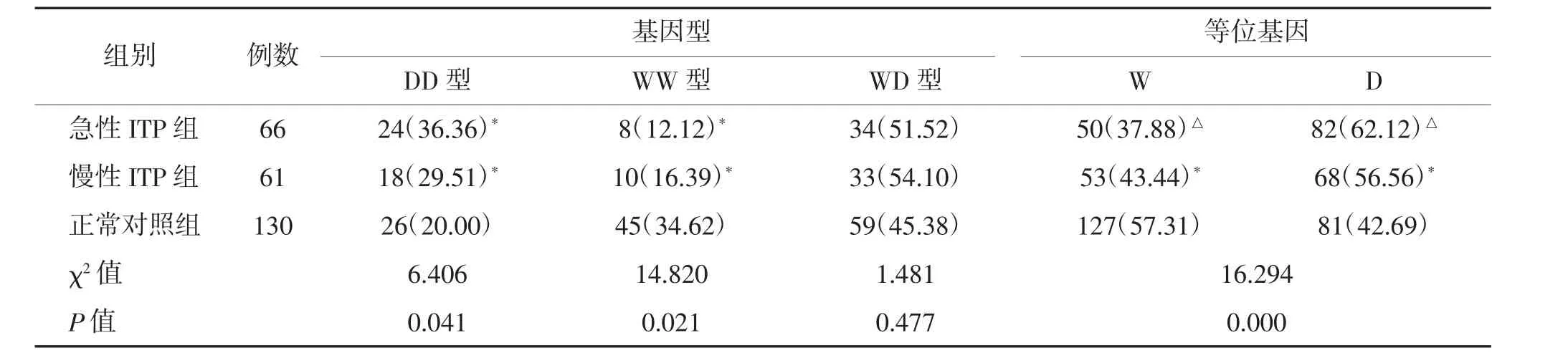
表2 各组NF-κB1-94del/ins ATTG 基因型及等位基因频率比较 n(%)
2.4 各基因型ITP 患者临床资料比较 NF-κB1-94del/ins ATTG 不同基因型ITP 患者年龄、性别、Hb、RBC 水平比较,差异均无统计学意义(P>0.05)。各基因型患者PLT、CRP、RF 水平比较,差异均有统计学意义(P<0.05)。WW 基因型患者PLT 高于DD型和WD型,CRP、RF 水平低于DD型和WD型,差异均有统计学意义(P<0.05);DD型与WD型差异无统计学意义(P>0.05)。见表3。
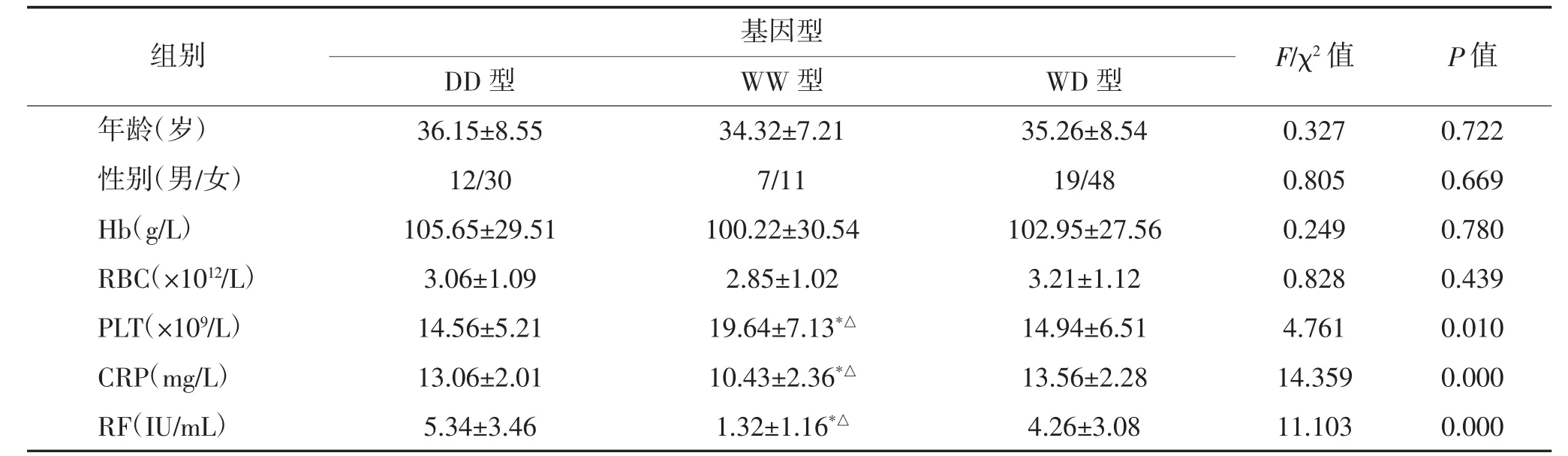
表3 各基因型患者临床资料比较 例(%)
2.5 影响ITP 多因素Logistic 回归分析 以是否发生ITP 为因变量,以CRP、RF、NF-κB1-94del/ins ATTG 为自变量进行Logistic 回归分析,结果显示NF-κB1-94del/ins ATTG 基因多态性是影响ITP 的独立危险因素。见表4。
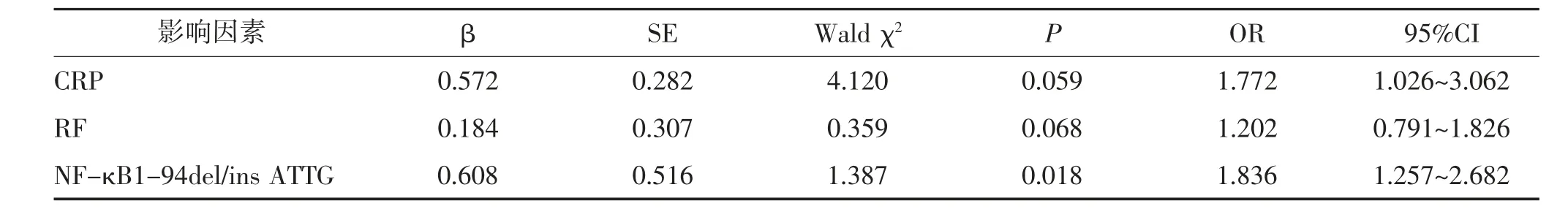
表4 影响ITP 的多因素Logistic 回归分析
3 讨论
ITP 是常见的获得性出血性疾病,其发病与免疫功能异常相关,因血小板免疫性破坏引起外周血中血小板减少,临床上主要表现为皮肤、黏膜或内脏出血。目前关于ITP 的病因和发病机制尚未完全清楚,与其他免疫性疾病相同,具有一定的遗传性。
有研究报道,NF-κB1-94del/ins ATTG 基因多态性调控多种凋亡和炎症相关基因的表达,炎症细胞因子又进一步激活上游NF-κB1 基因过度转录、翻译NF-κB1 蛋白,形成级联放大效应[8]。目前关于NF-κB1-94del/ins ATTG 基因多态性与ITP 相关性研究鲜有报道。NF-κB 是P65 和P50 的异源二聚体,编码P50 的NF-κB1 基因定位于4 号染色体(4q24),可诱导下游100 多个基因的转录[9]。研究发现,ITP患者中NF-κB 活化比显著升高,NF-κB 转移至核内结合特定基因启动子或增强子而调节基因转录[10]。多项研究表明,NF-κB1-94del/ins ATTG 基因多态性与免疫炎症性疾病密切相关,如类风湿性关节炎[11]、溃疡性结肠炎[12]、冠心病[13]、系统性红斑狼疮[14]等。KARBAN 等[12]报道,炎症性肠病患者中NFκB1-94del/ins ATTG 的DD 基因型显著高于对照组。LÓPEZ-MEJÍAS 等[11]研究类风湿性关节炎NFκB1-94del/ins ATTG 多态性,发现DD 基因型类风湿关节炎的风险显著高于WW 基因型。系统性红斑狼疮研究显示,WD 基因型的患病风险较低[14]。本研究结果显示,急、慢性ITP 患者与正常对照组均存在NF-κB1-94del/ins ATTG 基因多态性,与正常对照组比较,急性、慢性ITP 组DD 基因型分布显著升高,急性ITP 组D 等位基因频率高于慢性ITP 组和对照组,W 等位基因频率显著降低,差异均有统计学意义(P<0.05),提示DD 基因型分布过高可能增加ITP患病的风险,这与在其他自身免疫性疾病中检测结果一致。
NF-κB 是调控自身免疫性疾病发生发展的重要基因,参与体内氧化应激和炎症反应[15]。作为体内重要的核转录因子,NF-κB 调控白介素1β(IL-1β)、肿瘤坏死因子-α(TNF-α)等的表达[16]。CRP 是非特异性炎症反应标志物,主要由IL-6 调控,部分受IL-1β、TNF-α 的调控[17]。CRP 是重要炎症信号通路因子,可促进炎症介质的释放[18]。RF 是以变性IgG 为抗原的自身抗体,在类风湿关节炎患者的血清或者滑膜液中可检测到,只要存在变性IgG,并产生抗变性IgG 自身抗体,则于血清或病变中可以检测出RF[19]。CRP 和RF 在自身免疫性炎症疾病中具有重要作用[20]。
本研究结果显示,NF-κB1-94del/ins ATTG 不同基因型ITP 患者血清CRP、RF 水平的差异具有统计学意义(P<0.05),与DD、WD 基因型比较,WW 基因型血清CRP、RF 水平均显著下降,提示WW 基因型可能影响NF-κB1 下游基因的转录与翻译,抑制炎性细胞因子的产生。Logistic 回归分析显示,NFκB1-94del/ins ATTG 基因多态性是影响ITP 的独立危险因素,提示机体NF-κB1-94del/ins ATTG 基因型分布异常可能增加ITP 患病的风险。
综上所述,ITP 的发生发展与NF-κB1-94del/ins ATTG 基因多态性具有一定相关性,有望为ITP 的基因治疗提供参考。

