抗菌肽抑制金黄色葡萄球菌的黏附及生物被膜形成研究
赵 洋,张 欣,夏雨婷,赵瑞利,*,李 颖,张振洲,于恩远,曾 君, 张湟溆,刘湘荃
(1.天津农学院动物科学与动物医学学院,天津市农业动物繁育与健康养殖重点实验室,天津 300384; 2.天津市动物疫病预防控制中心)
金黄色葡萄球菌(Staphylococcusaureus,S.aureus)属于一种革兰阳性菌,能在体内产生α毒素、肠毒素、血浆凝固酶、酚溶解蛋白等多种毒力因子,能引起人和动物的各种感染性疾病。耐甲氧西林金黄色葡萄球菌(MRSA)随着内酰胺类抗生素的大量使用而进一步增加。研究表明,金黄色葡萄球菌形成的生物被膜,它们是促进细菌耐药性的重要原因。
生物被膜是指一种微生物为了适应其周围环境,黏附于介质的表面,并被其自身分泌的胞外基质(Extracellular polymericsubstances,EPS)包裹而形成的三维网状结构。其形成与周围环境及自身基因调控有关。生物被膜内的各种细菌对抗菌药物和宿主免疫系统具有非常强的耐药性,通过抗菌药物治疗很难将其完全消灭或消除,若增加抗生素用量,不但不能杀灭被膜内细菌,还可能会引起毒副作用。因此寻找新的作用于生物被膜形成的生物活性物质成为研究的热点,本试验利用已改造的嵌合体肽,研究对金黄色葡萄球菌的黏附及其生物被膜形成的抑制作用,为防控生物被膜耐药菌以及新型抗生物被膜菌的抗菌药物提供理论依据。
1 材料
1.1 抗菌肽样品
抗菌肽样品由浙江鸿拓生物技术有限公司采用固相合成法(SPPS)合成。通过HPL.C(Waters 600 controller)反相C18柱层析脱盐、纯化,利用快原子轰击质谱法(AB3200)来测定分子质量,其纯度≥95%。抗菌肽序列信息见表1。

表1 抗菌肽序列
1.2 主要试剂
使用试剂见下表2。

表2 试剂名称及生产厂家
1.3 主要仪器
使用的主要仪器见表3。

表3 仪器名称及生产厂家
2 方法
2.1 金黄色葡萄球菌的分离培养
将金黄色葡萄球菌分别接种于MH、血琼脂、麦康凯、伊红-美蓝琼脂培养基,置于37℃恒温培养箱中培养24 h,并进行染色镜检。
2.2 革兰氏染色
用95%的酒精擦洗盖玻片,保证盖玻片无菌,在每一张载玻片上分别滴1~2 滴生理盐水,用接种环轻轻挑取单一菌落溶解到生理盐水中,在一盏酒精灯上烘焙晾干,用移液管在每一张载玻片中央分别滴入适量结晶紫染液,染色 1 min 后缓慢进行冲洗。用移液管将适量碘液滴到载玻片上,染色1 min后进行冲洗。再用移液管吸取适量无水乙醇脱色 30 s 左右,时间一般不能太久,直至流出的乙醇不会显示紫色为止,随即缓慢地进行冲水。用移液管吸取适量复红染液染色 30 s,随即进行冲水,注意以上冲水不能直接冲洗细菌。用滤纸轻轻按压吸干载玻片上面的水分,向载玻片上滴1~2滴香柏油,放置显微镜下用油镜观察。
2.3 药敏试验
采用药敏纸片扩散法测定,取4个或5个分离纯化后的菌落,制成菌悬液。将已经稀释的菌液均匀接种于MH培养基上,选用目前在国内兽医临床上较为常见的19种药敏纸片(隶属杭州微生物试剂有限公司),用无菌镊子夹取药敏纸片均匀贴在培养基表面,每片间距一般间隔3 cm左右,37℃连续培养24 h后即可进行实验观察并获得观察结果,测量抑菌圈直径大小。参考药物抑菌圈的相关标准基本可以判定对其药物敏感性。
2.4 细菌鉴定及生物被膜相关基因鉴定
2.4.1 DNA提取 挑取菌落放入离心管中,100℃煮沸 20 min,离心取上清 5 μL 作为DNA模板。
2.4.2 PCR扩增及测序 根据一个金黄色葡萄球菌的基因序列设计出特异性基因(nuc)及生物被膜主要基因(icaA,fib)的PCR引物。
根据合成的特异性引物进行PCR扩增,扩增体系:DNA模板5μL,l0×Buffer2.5 μL,dNTP2 μL,上、下游引物各1 μL,Taq酶0.5 μL,用ddH20补至25 μL。PCR扩增程序:95℃预变性5 min;95℃变性35 s,55℃退火35 s,72℃延伸35 s,共35个循环;然后72℃终延伸10 min。测序并进行BLAST比对分析,引物信息见表4。

表4 引物信息
2.5 抗菌肽对金黄色葡萄球菌生物被膜胞蛋白的影响
2.5.1 蛋白提取 培养生物被膜及收集上清液,吸取20 μL样品于96孔板中,再依次加入200 μL的G-250染料,室温下静止放置5 min后使用酶标仪在595 nm 处测定吸光度值。
2.5.2 BCA 蛋白浓度测定 按照 BCA蛋白浓度试剂盒制备标准品测定生物被膜胞外蛋白含量。(1)BCA工作液配置:根据实验所需,以BCA试剂: Cu试剂=50∶1的比例(体积比)进行配置;(2)稀释BSA标准品:取 BSA标准品15 μL,加入 135 μL PBS稀释,混匀后备用;(3)设置标准品:分别取标准品0 μL,2 μL,4μL,6 μL,8 μL,12 μL,16 μL,20 μL,加入96孔板中,每孔加 PBS溶液至20 μL,每个浓度2个复孔;(4)样品稀释:取5 μL待测样品,加PBS 溶液至20 μL,每种样品设置2个平行对照;(5)分别将各孔中加入200 μLBCA工作液,37℃培养箱孵育30 min;(6)用酶标仪测定 A560 nm,根据标准曲线计算出蛋白浓度。
2.6 扫描电镜观察抗菌肽对金黄色葡萄球菌生物被膜的影响
向6孔细胞培养板中依次放入细胞爬片,每孔分别加入1%葡萄糖的TSB4 mL,按照1∶100比例依次分别加入经过24 h培养的菌液和含T-La(FS)、RGD-T-La(FS)、T-La(S)、RGD-T-La(S)的4MIC的金黄色葡萄球菌菌悬液,放于37 ℃培养箱中持续进行培养72 h。将样品使用无菌PBS(pH为7.4)清洗2次来除去样品中的浮游细菌,15 min/次;然后用2.5%电镜专用固定液在4 ℃条件情况下固定24 h后,用无菌PBS(pH为7.4)漂洗3次,分别用30%、50%、70%、80%、90%、95%不同梯度的乙醇脱水1次,15 min/次;再用无水乙醇脱水2次,20 min/次;然后进行真空干燥,对整个样品进行喷金后再次使用扫描电镜观察样品。
2.7 抗菌肽对金黄色葡萄球菌生物被膜相关基因转录水平的影响
将金黄色葡萄球菌生物被膜培养至成熟期,于96孔板中依次分别加入含有1%葡萄糖的TSB菌悬液100 μL,然后依次分别加入终浓度为4 MIC的T-La(S)、RGD-T-La(S)、T-La(FS)、RGD-T-La(FS),每孔依次分别加入100 μL,阴性对照组加200 μL菌悬液,每组设3个重复,37 ℃孵育24 h。采用Trizol法,利用RNA抽提试剂盒说明书的方法提取总RNA,反转录合成cDNA,实时荧光定量PCR检测,两个生物被膜相关基因的表达进行相对定量,荧光定量的PCR反应体系参照UltraSYBR Mixture说明书进行。
3 结果分析
3.1 金葡菌的分离培养
细菌在MH培养基中均匀地混合生长,形成一些不透明的白色菌落;血琼脂培养基上生长出微型菌落,呈现淡灰色,透明状,圆形,凸起,光滑,边缘规则,露珠状,产生β溶血;未见在麦康凯培养基和伊红美蓝培养基中生长。(结果见图1)
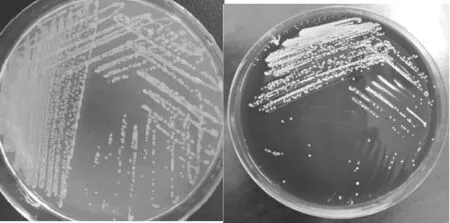
A. MH培养基 B. 血琼脂培养基
3.2 革兰氏染色结果
革兰氏染色结果显示见图 2,分离得到的菌株为革兰氏阳性菌,球形,排列为葡萄串状,初步认定为葡萄球菌。
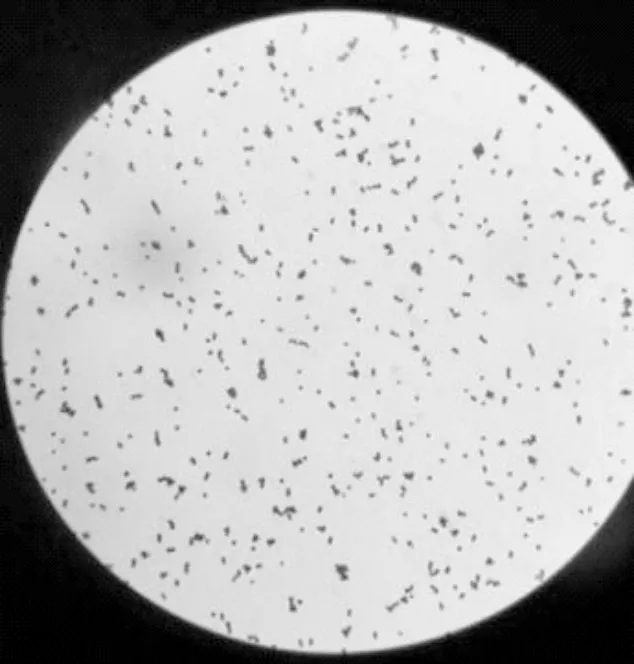
图2 革兰染色镜检结果
3.3 药敏试验
各种药物的抑菌圈直径与其标准对照得出以下结果,见表5,本实验分离的金黄色葡萄球菌对多西环素、庆大霉素、卡那霉素、新霉素、头孢氨苄、羧苄西林、头孢曲松、头孢他啶、红霉素、米诺环素、青霉素、西环素、头孢拉定、头孢哌酮、头孢呋辛、哌拉西林耐药,对氨苄西林、头孢唑林、丁胺卡那处于中介。
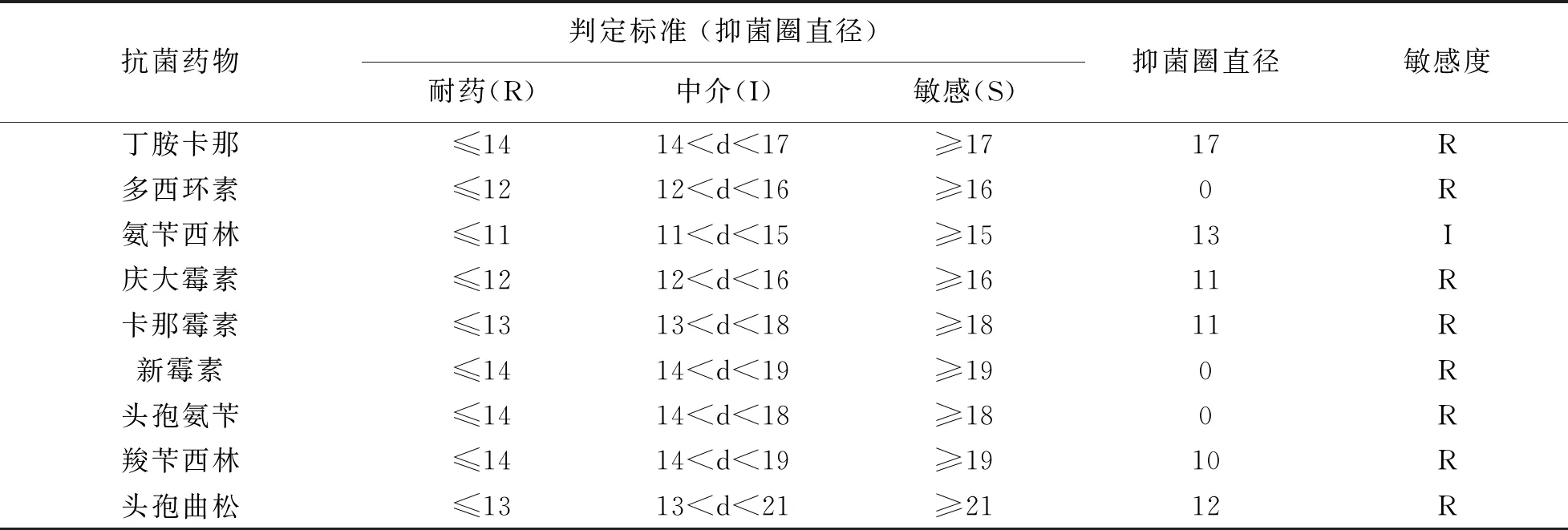
表5 金黄色葡萄球菌药敏试验判定结果与判定标准 mm
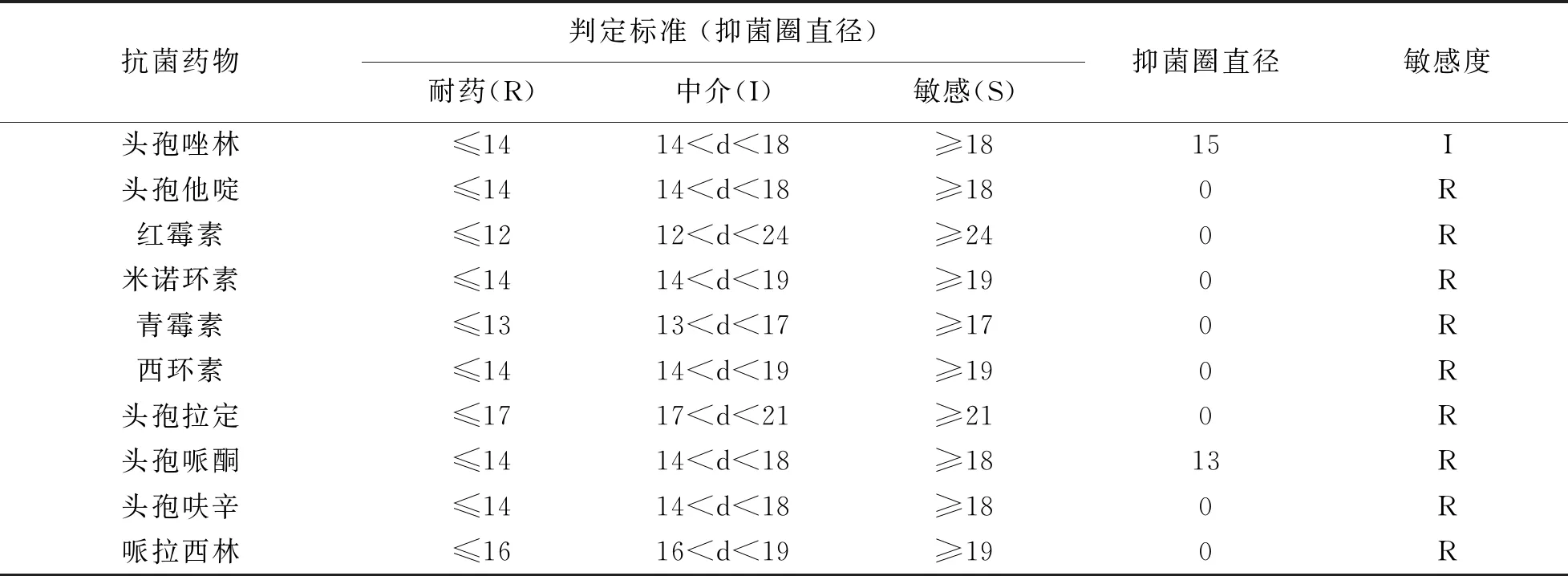
续表5
3.4 金黄色葡萄球菌16S rRNA、特异性基因及生物被膜相关基因PCR检测结果
通过PCR扩增的16S rRNA基因大小约为1 500 bp。耐热核酸酶基因nuc被特异性扩增,出现大小为270 bp的条带,与目标产物的大小一样。icaA基因和fib基因PCR扩增结果为阳性,条带大小分别约为178 bp和239 bp。结果见图3。
3.5 抗菌肽对金黄色葡萄球菌生物被膜胞外蛋白含量的影响
测定抗菌肽对金黄色葡萄球菌的生物被膜中胞外蛋白含量的影响,由图4可知,随着抗菌肽浓度的增加,对金黄色葡萄球菌生物被膜胞外蛋白的抑制率呈现逐渐上升的趋势。4种多肽(T-La(S)、RGD-T-La(S)、T-La(FS)和 RGD-T-La(FS))在4MIC浓度时,抑制的比率分别为31.44%、39.62%、70.52%和51.87%; T-La(FS)对生物被膜胞外多糖抑制率显著或极显著高于T-La(S)、RGD-T-La(S)和RGD-T-La(FS)(P<0.05;P<0.01),以 T-La(FS)的抑制效果最为显著。表明抗菌肽主要抑制金黄色葡萄球菌生物被膜胞外蛋白合成与分泌,阻断胞外聚合物的大量产生,降低金黄色葡萄球菌生物被膜的形成。
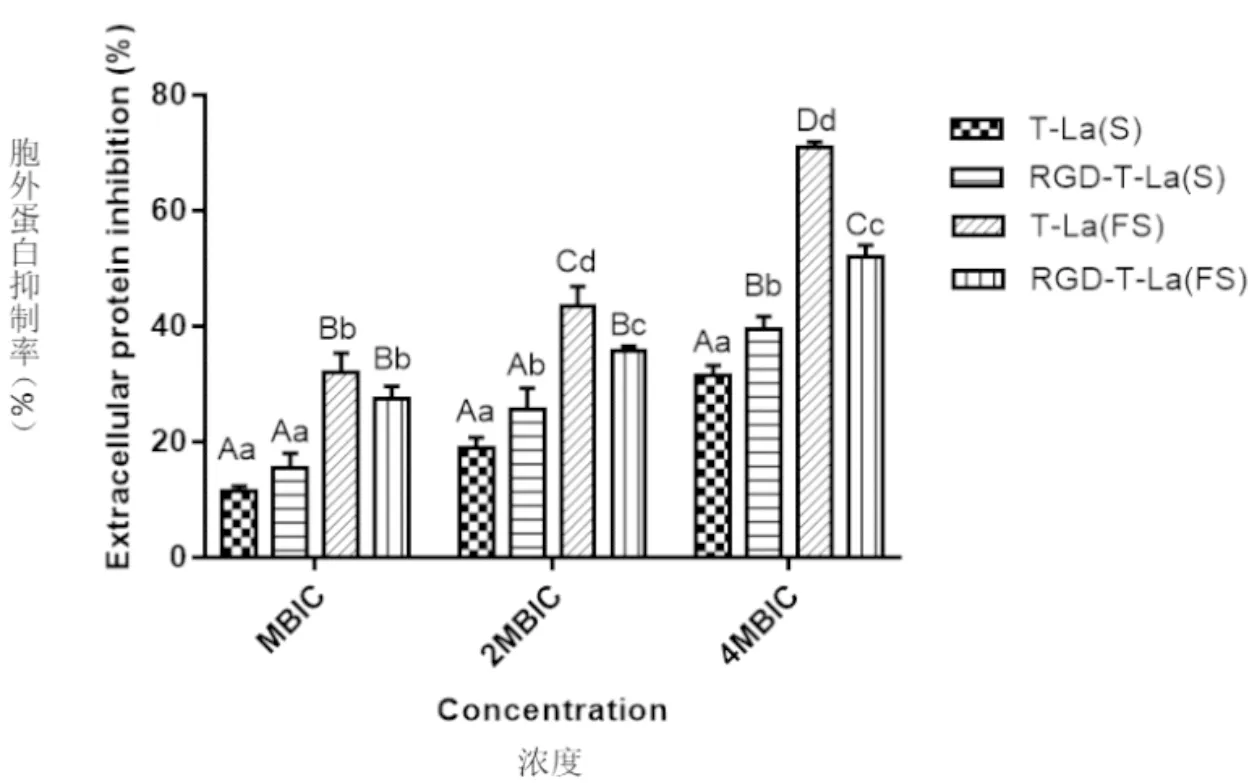
图4 抗菌肽对金黄色葡萄球菌生物被膜胞外蛋白含量的影响
3.6 扫描电镜观察抗菌肽对金黄色葡萄球菌生物被膜的影响
检测结果见图5,对照组的细菌呈球形、结块状,可以看到细菌之间存在黏液,且其表面有大量的丝状黏液,即菌体所分泌的大量胞外物质,少数细菌未被完全包裹,仍能清楚地看到附着的单个球状菌体,图中可以明显的看出随着多肽的加入其菌体的黏附性降低,与对照组相比加入T-La(FS)的菌体黏附性最低,其次为RGD-T-La(FS)、T-La(S),相对来说RGD-T-La(S)的黏附性最高。

图5 生物被膜扫描电镜观察结果

续图5 生物被膜扫描电镜观察结果
3.7 抗菌肽对金黄色葡萄球菌生物被膜相关基因转录水平的检测结果
与对照组相比,RGD-T-La(S)、T-La(FS)、RGD-T-La(FS)对icaA的转录有极显著的抑制作用(P<0.01),T-La(FS)对icaA的抑制作用极显著高于T-La(S)、RGD-T-La(S)(P<0.01);RGD-T-La(S)、T-La(FS)、RGD-T-La(FS)对fib的转录有极显著的抑制作用(P<0.01),T-La(FS)对fib的抑制作用显著或极显著高于T-La(S)、RGD-T-La(S)(P<0.05、P<0.01);表明抗菌肽能抑制icaA、fib基因的转录水平,且T-La(FS)的抑制作用较强(见图6)。
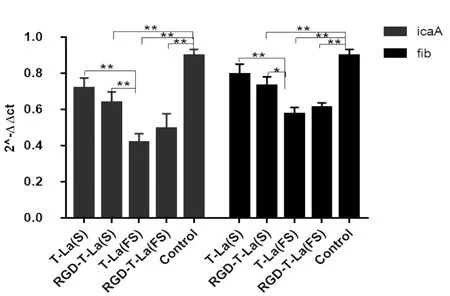
图6 抗菌肽对生物被膜相关基因icaA、 fib转录的影响
4 讨论
金黄色葡萄球菌形成生物被膜较容易,能够很好地防止和抵御宿主的免疫反应,还有可能导致细菌对抗生素及消毒剂敏感性降低,生物被膜的产生与其耐药性有着密切联系。本实验分离的金黄色葡萄球菌对多种临床常用的多种抗生素耐药。目前已有研究表明抗菌肽可以抑制细菌生物被膜的生成,本试验在扫描电镜下观察抗菌肽作用后,细菌周围的膜状物质逐渐消失,细胞外基质大量减少,而在对照组中的金黄色葡萄球菌生物被膜结构较为完整。胞外蛋白在生物被膜结构的形成和发育中同样扮演重要的作用,试验结果表明抗菌肽能够抑制金黄色葡萄球菌生物被膜胞外蛋白合成与分泌。
生物被膜形成是一个非常复杂的过程,有多重因子参与同时受多种基因调控。由于细胞间基因调控系统在生物被膜形成中起着重要作用,因此生物被膜相关基因的表达受到抑制则生物被膜形成受到抑制。本试验中4种多肽对于金色葡萄球菌生物被膜内活菌总数抑制能力由强到弱分别为T-La(FS)、RGD-T-La(FS)、T-La(S)、RGD-T-La(S)。半定量黏附试验结果表明,在多肽的作用下,金黄色葡萄球菌生物被膜的形成显著降低,T-La(FS)相比于RGD-T-La(FS)、T-La(S)、RGD-T-La(S)具有较强的生物被膜形成的抑制作用。通过检测其主要生物被膜基因fib、icaA的转录水平,与对照组相比,fib、icaA的转录水平降低,且T-La(FS)的抑制作用最强。金黄色葡萄球菌在形成生物被膜时,细胞间的多糖黏附素在发挥着非常重要的作用,而这种多糖黏附素合成的基础是ica基因,ica操纵子包括一个调节基因icaR和四个功能基因icaA、B、C、D。icaR基因位于ica基因的上游,编码一种转录阻遏物,通过与DNA结合调控转录,icaA蛋白位于细胞膜,具有N-乙酰葡萄氨基转移酶活性,icaD是一种伴侣蛋白的可能性比较大,其主要作用能够引导icaA分子能够正确地折叠和插入细胞膜,icaB是一种分泌性蛋白质,作用及其原理是脱去多聚N-乙酰葡聚胺分子上的乙酰基,icaC是一种插入细胞膜的疏水性蛋白质,帮助合成较长的聚合物,并且能够不断将合成的多糖物质转移至细胞的表面。fib是一种由金黄色葡萄球菌分泌的能与纤维蛋白结合的蛋白,其能调节金黄色葡萄球菌的毒力和生物被膜的形成,fib转录水平的降低能够减弱fib蛋白和nuc基因启动子之间的相互作用,从而导致nuc基因的表达下降,减弱生物被膜的形成能力,抗菌肽通过影响生物被膜相关基因转录水平可以抑制金黄色葡萄球菌生物被膜的形成。

