Claudin-4在胆囊癌中的表达及与临床病理特征、预后的关系
王 勇,庞 青,满忠然,谈 燚,刘会春,金 浩
(蚌埠医学院第一附属医院肝胆外科,安徽 蚌埠 233004)
胆囊癌(Gallbladder carcinoma,GBC)是一种少见的恶性肿瘤,其发病率在全球范围内呈上升趋势。据最新报道,全球GBC的发病率约为2/10万[1]。GBC的易感因素主要包括胆结石、慢性胆囊炎、慢性细菌性胆管炎、环境暴露等[2]。由于GBC起病隐匿,早期缺乏典型症状,大多数患者就诊时已出现毗邻脏器的侵袭及淋巴结转移,导致该肿瘤的预后较差[3]。据报道,GBC的5年总体生存率(Overall survival,OS)约为2.7%~20.1%[4]。迄今为止,GBC的相关预后因素尚未完全明确。既往研究表明,血清糖类抗原19-9(Carbohydrate antigen 19-9,CA19-9)水平、TNM分期、炎症指标等可能影响GBC患者的生存[4]。为改善GBC患者的预后,寻找新的治疗靶点及预后标志物是目前研究的迫切需求。
紧密连接结构的异常、细胞黏附结构的破坏而引起的细胞增殖、分化异常在肿瘤的发生发展中起着重要的作用[5]。Claudin-4在体内广泛表达并发挥特定的生理功能[6]。Claudin-4已被发现在多种肿瘤中表达异常且发挥了重要的调控作用。最新研究表明,Claudin-4在上皮肿瘤中表达失调,可作为转移性上皮肿瘤和间质肿瘤的鉴别指标[7]。此外,Claudin-4在乳腺癌、胃癌等多种肿瘤中具有重要的作用[8-9]。然而,Claudin-4与GBC的关系,目前尚无文献报道。本研究中,我们探讨Claudin-4在GBC中的表达及与临床病理特征、预后的关系,现将结果报道如下。
1 对象与方法
1.1 研究对象选取自2014年1月至2018年12月间在蚌埠医学院第一附属医院住院的50例GBC患者为研究对象,其中男性20例,女性30例,平均年龄(63.2±9.5)岁。纳入标准:(1)经病理诊断为胆囊腺癌;(2)年龄≤80岁;(3)接受GBC根治手术。排除标准:(1)转移性胆囊恶性肿瘤;(2)伴远处转移;(3)接受姑息性手术;(4)既往因GBC接受过化疗、放疗等治疗;(5)随访资料不完整或无肿瘤组织标本。选取同期接受手术的胆囊腺瘤和慢性胆囊炎患者各20例作为对照组。胆囊腺瘤组男3例,女7例,平均年龄(62.5±10.2)岁;慢性胆囊炎组男4例,女6例,平均年龄(62.1±8.7)岁。三组之间性别、年龄差异无统计学意义。本研究遵守赫尔辛基宣言[10]。
1.2 免疫组化法检测Claudin-4的表达兔抗人Claudin-4多克隆抗体购自美国Abcam公司;二抗羊抗兔IgG多克隆抗体购自北京中衫金桥生物科技有限公司。采用二步法进行免疫组化染色。胆囊组织经石蜡包埋后连续切片4 μm,经反复脱蜡、冲洗后抗原修复。加入一抗(1:200)在孵育盒内4 ℃孵育过夜。去除一抗后加入HRP标记二抗,室温下孵育15 min,显色后观察显色强度。应用苏木素复染,显微镜观察染色强度,调至合适强度。乙醇脱水、透明,中性树胶封片。
免疫组化结果由两位病理科医师独立进行评估,随机观察每张切片中10个高倍视野区域,细胞核或细胞浆染色为阳性,评分标准如下。染色程度:0分:无染色;1分:轻度染为淡黄色;2分:中度染为棕黄色评;3分:重度染为棕褐色。阳性细胞比例:染色细胞/总细胞计数≤10%为0分;11%~30%评为1分;31%~50%评为2分;>50%评为3分。综合评分:染色程度与阳性细胞比例乘积:≥3分为阳性,<3分为阴性。
1.3 资料收集及随访使用电子病历收集以下数据:患者的年龄、性别、胆囊结石病史、CA19-9、癌胚抗原(Carcinoembryonic antigen,CEA)、肿瘤分化、TNM分期等。随访至2019年6月或至患者死亡。随访内容包括:术后每1~3个月复查生化常规、肿瘤指标、腹部彩超及CT,记录生存情况。
1.4 统计学分析我们采用SPSS 22.0软件对数据进行统计分析。分类资料组间比较采用卡方检验。主要观察结局为OS,采用KM生存曲线及log-rank检验进行分析。将单因素分析中P<0.05的变量进入多因素Cox回归模型。P<0.05表示差异有统计学意义。
2 结果
2.1 Claudin-4在GBC中的表达情况免疫组化检测(图1)提示,Claudin-4在GBC中的表达水平显著高于慢性胆囊炎和胆囊腺瘤。GBC组织中Claudin-4的阳性表达率为74%(37/50),显著高于慢性胆囊炎20%(4/20)和胆囊腺瘤25%(5/20),且差异具有统计学意义(表1,2=23.687,P<0.001)。慢性胆囊炎与胆囊腺瘤两组之间Claudin-4的表达差异无统计学意义。
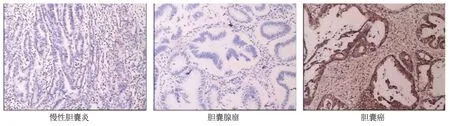
图1 Claudin-4免疫组化检测(×100)

表1 Claudin-4在慢性胆囊炎、胆囊腺瘤及GBC组织中的表达情况
2.2 Claudin-4与GBC患者临床病理特征的关系将患者根据Claudin-4表达情况分为阳性(n=37)和阴性组(n=13),分析其与GBC临床病理特征的关系。如表2所示,Claudin-4与CA19-9、肿瘤分化程度显著相关。如图2所示,Claudin-4阳性的患者分化程度较低,CA19-9水平较高。

表2 Claudin-4与GBC患者临床病理特征的关系
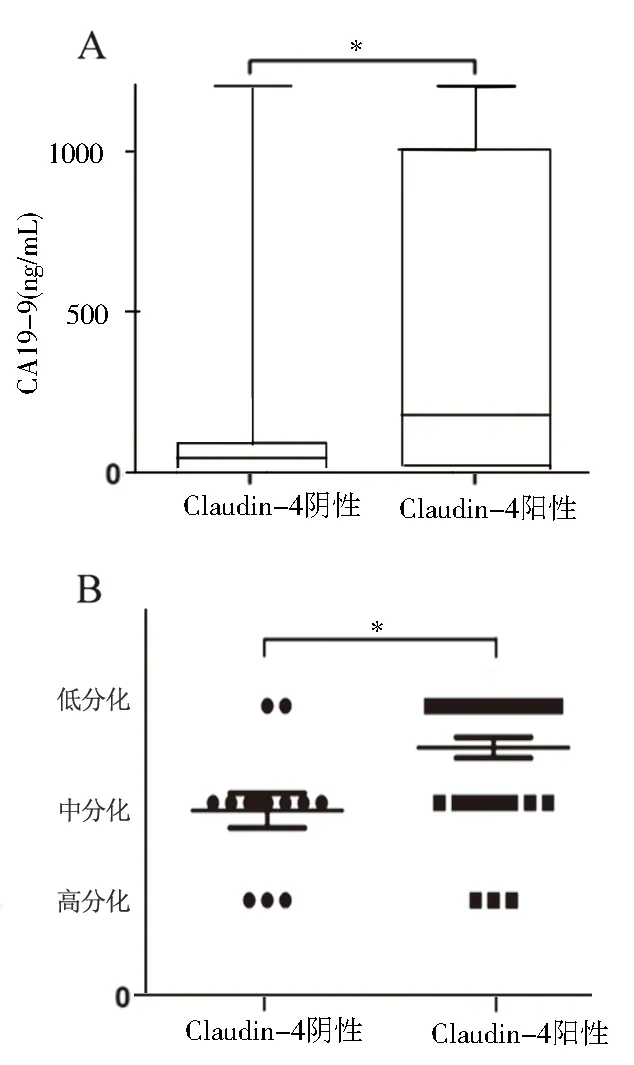
图2 Claudin-4表达与CA19-9(A)及肿瘤分化程度(B)的关系
2.3 总体生存的对比患者术后KM生存曲线如图3所示,log-rank检验提示Claudin-4阳性与阴性表达组之间OS差异具有统计学意义(P=0.029)。

图3 KM生存曲线及对比
单因素分析表明,术前CA19-9、肿瘤分化程度、TNM分期及Claudin-4表达是影响患者术后OS的因素(表3)。随后,上述因素进入Cox多因素回归模型,结果表明,术前较高的肿瘤分化程度[HR=2.95,95%CI(1.15,7.60),P=0.025]、TNM分期[HR=3.6,95%CI(1.07,12.51),P=0.038]及Claudin-4表达[HR=4.81,95%CI(1.16,20.76),P=0.035]是影响患者预后的独立危险因素。
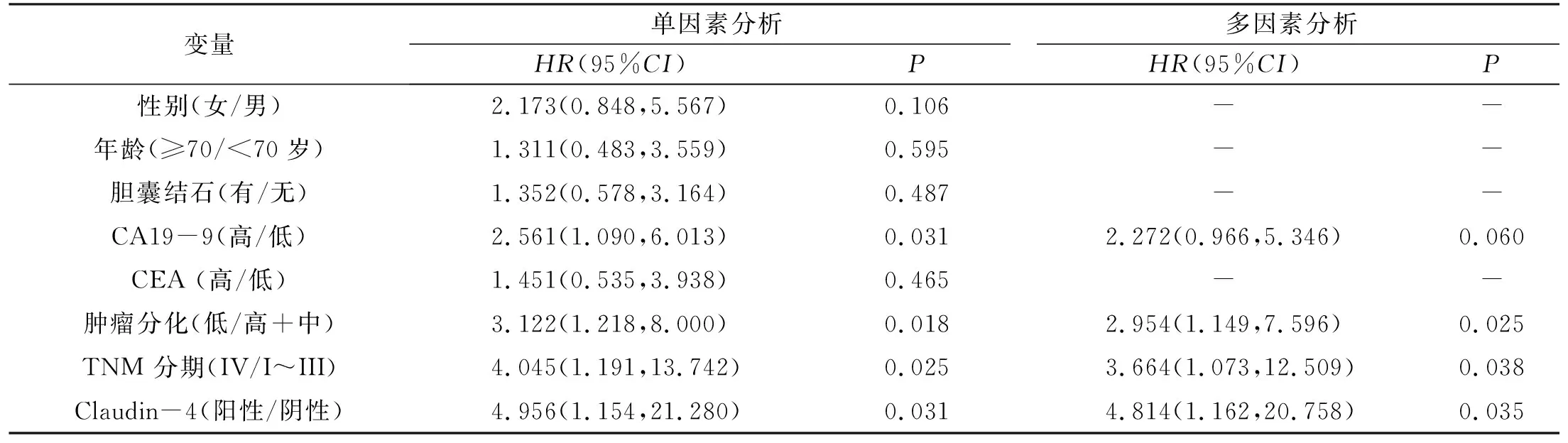
表3 影响OS的单因素和多因素分析
3 讨论
近年来,GBC在我国的发病率呈逐年上升的趋势。GBC是最常见的胆道恶性肿瘤,占全球所有胆道恶性肿瘤的46%~95%[11]。该病在不同地区的发病率有差异,以智利、日本、印度北部发病率较高[1]。随着影像和外科技术的进步,GBC的诊断和治疗水平有了很大的提高。然而,已经确定的GBC的预后因素较少且价值有限,因而有必要探索新的生物标志物。
Claudin-4是细胞连接结构的重要组成部分,其蛋白含有209个氨基酸,分子大小为22KD,属于整合素蛋白家族,与产气荚膜梭菌肠毒素受体有极高的相似度。Claudin-4在多种肿瘤中表达异常且发挥了重要的作用。Duarte等检测了Claudin-4在原位乳腺癌中的表达,发现88.4%(76/86)的患者表达水平升高,且Claudin-4高表达的乳腺癌患者有较差的无瘤生存率[8]。Moris等通过免疫组化检测了Claudin-4在胃癌中的表达情况,发现66.7%的患者Claudin-4表达异常,且Claudin-4与肿瘤T分期显著相关,但不影响患者预后[9]。Sasaki等发现Claudin-4与胰腺癌肿瘤侵袭、淋巴结转移和远处转移有关,而靶向Claudin-4可增加化疗药物5-FU治疗的有效性和安全性[12]。此外,Claudin-4的活性降低或表达缺失,可导致卵巢癌细胞的凋亡增加,细胞迁移能力减弱,动物体内的肿瘤负荷也降低[13]。在胆道系统肿瘤中,Ryu等研究表明,Claudin-4在肝内胆管细胞癌中的表达显著高于肝细胞肝癌,其可作为诊断肝内胆管细胞癌的独立标志物[14]。国内王云等[15]研究表明Claudin-4在胆管癌中高表达,与胆管癌的分化程度相关,且有助于胆管癌的早期诊断。
该研究中,我们首次探讨了Claudin-4在GBC中的表达情况,发现74%的GBC患者Claudin-4表达阳性,显著高于慢性胆囊炎及胆囊腺瘤。进一步研究发现,Claudin-4与CA19-9水平显著正相关,且Claudin-4阳性的患者肿瘤分化程度较低。此外,Claudin-4还可用于指导GBC患者的预后。除Claudin-4之外,我们还发现TNM分期、肿瘤分化程度也是GBC患者独立的预后因素,与既往研究的结果一致[4]。
然而,本研究仍有一些缺陷。首先,仅纳入50例GBC患者,且均来源于我院,因此该研究结果需要多中心大样本的研究进一步验证。其次,该研究缺少体外实验的验证,后续需要通过细胞实验进一步验证Claudin-4在GBC中的作用及潜在机制。综上所述,本研究发现了Claudin-4在GBC中的潜在临床应用价值,有望为GBC的临床诊疗及预后评估提供新的思路。

